2021ATS BEAR Cage 创新奖:微生物组移植治疗肺动脉高压
2021-11-12 刘少飞 MedSci原创
肠道微生物组在肺部和心血管疾病中具有重要de 作用,但是在肺动脉高压(PAH)中是否存在肠-肺联系的证据,这一定是值得探索的方向。

肠道微生物组是宿主生理学不可或缺的一部分,包括新陈代谢和免疫。对微生物组如何影响慢性疾病,例如慢性阻塞性肺病 (COPD)、哮喘、心力衰竭、特发性肺纤维化的研究一直在目前科学发现的热点。与健康对照相比,COPD 患者的粪便微生物组在几种细菌种类和微生物代谢物的相对丰度方面存在差异。出生后第一年通过 16S rRNA 基因测序评估的粪便微生物群多样性较低,与 7 岁时的哮喘发展相关,被认为有哮喘发展风险的婴儿的细菌产生的抗炎水平较低,短链脂肪酸(SCFA),醋酸盐,在他们的粪便中。在饮用水中补充包括醋酸盐在内的 SCFA 的小鼠,肺部炎症细胞浸润显着减少,而喂食低纤维饮食的小鼠循环中的 SCFA 水平降低,气道高反应性增加。三甲胺 N-氧化物 (TMAO) 是一种在红肉消化过程中产生的细菌衍生代谢物,与中风和心肌梗塞有关,体外研究表明,TMAO 会增加血小板的活化和聚集。与喂食正常饲料的对照组相比,给予补充 TMAO 的饲料的小鼠心肌细胞横小管功率和左心室射血分数显着降低。这些研究为肠道微生物组的表征以影响新疗法的发展提出了强有力的论据。
那么,肺动脉高压(PAH)中是否存在肠-肺联系的证据?
肺动脉高压(PAH)的特征是血管周围肺部炎症和肺血管重塑,导致肺血管阻力增加。右心室后负荷的增加会导致右侧心力衰竭并最终导致死亡。尽管药物疗法有所发展,但 PAH 死亡率并未显着改善。虽然炎症在 PAH 中起着机械作用,但导致它的潜在因素仍不清楚。 PAH 中的炎症可能是由促炎和抗炎肠道微生物代谢物、细胞因子和其他介质的失衡和/或循环细菌的直接影响引起的,所有这些都源于生态失调、肠道屏障功能障碍导致代谢物的渗透性增加和或细菌,并可能减少炎症性肠道微生物代谢物的肝脏过滤。有证据表明 PAH 的发展在一定程度上与肠道微生物群有关。一种可能的病因机制是细菌或细菌成分从肠道直接易位到循环中。支持这一点的是发现骨形态发生蛋白受体 II 型 (BMPR2) 等位基因杂合缺陷的小鼠在急性暴露于脂多糖 (LPS) 后会出现 PAH,而野生型小鼠则不会。在 20% 的特发性 PAH 和 80% 的遗传性 PAH 病例中发现了 BMPR2 种系突变。暴露于 LPS 与细胞因子分泌增加有关(无论是在鼠模型中,还是在体外培养的人和PAH小鼠的肺动脉平滑肌细胞中)。因此,LPS 受体 Toll 样受体 4 (TLR4) 被认为在 PAH 的发展中起关键作用。支持这一提议,发现 TLR4 缺陷小鼠在缺氧模型中对发展 PAH 具有抗性。支持肠道通透性在 PAH 中的作用,与对照组相比,用野百合碱治疗的大鼠具有增加的全身肠道脂肪酸结合蛋白(肠道通透性的标志物)、小肠纤维化和增加的厚壁菌与拟杆菌的比例。
PAH 的 sugen-hypoxia大鼠模型也复制了增加的厚壁菌门与拟杆菌门的比率。 进一步加强肠道微生物群如何促进 PAH 发展的关联,与仅用 sugen 和 缺氧。 尚不清楚这些作用是促进 PAH 发展的因果关系,还是肠道缺氧或灌注不足的旁观者效应,需要进一步研究来回答这个问题。 然而,这些研究表明微生物组确实在 PAH 的发展或进展中发挥作用。 因此,我们假设 PAH 的特征是肠道生态失调,导致肠道通透性改变,循环微生物代谢产物的负担改变,促进血管周围炎症和 PAH。
PAH 中的人类肠道微生物群与健康对照者有何不同?
使用宏基因组学测序分析 PAH 患者与参考队列的粪便微生物组组成,在测量生态指标时显示出明显的差异,包括香农和辛普森指数测量的丰富度和多样性降低,均匀度降低,以及存在的特定物种的相对丰度的区别。 该研究提供了微生物组影响 PAH 疾病的进一步证据,发现与参考队列相比,PAH 队列中与 TMAO 产生正相关的物种增加,而与 SCFA 分泌正相关的物种减少。
如何将这些知识应用于治疗 PAH?
我们计划确定微生物群移植疗法 (MTT),也称为粪便微生物群移植,是否可以治疗 PAH。这种疗法使用来自严格筛选的健康供体的粪便样本中的纯化细菌,这些样本经过严格的感染病原体测试,然后冻干,并放入胶囊形式以供口服。 MTT 是艰难梭菌结肠炎的安全治疗方法,对免疫功能低下的患者也是安全的。口服给药途径将允许重复给药,我们预计这在没有抗生素调节的情况下很重要,这将为植入创造一个生态空间。
为了测试 MTT,我们旨在确定其在 PAH 中的安全性和可行性。我们的团队有一项经 FDA 批准的PAH MTT I 期安全性和可行性试验。在这项开放标签试验中,12 名诊断为 PAH 的患者将每天服用一次 MTT 胶囊,持续 7 天。我们的主要终点将是安全性和可行性。为了解决这些终点,我们将监测患者服用胶囊的成功情况和不良事件的发生。患者将每天接受监测两周,然后每月监测六个月。
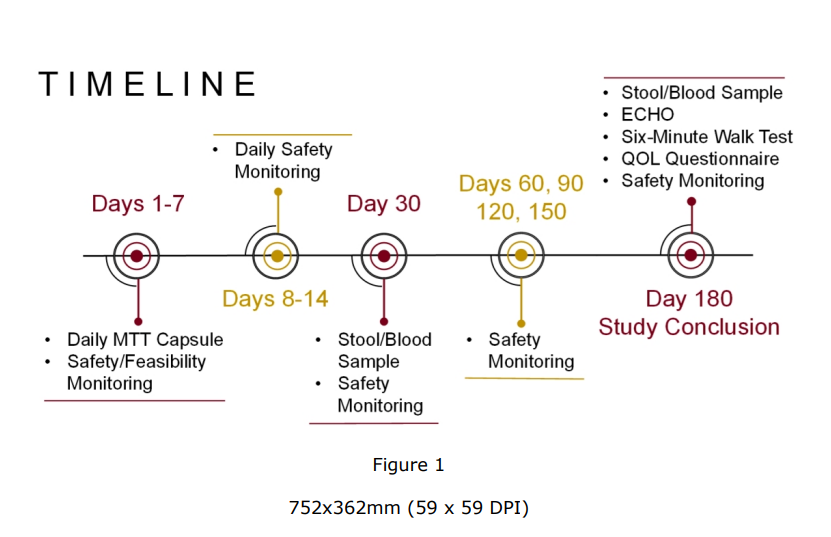
本研究的时间表如图所示。虽然我们不会根据基线微生物组特征或特定 PAH 治疗来选择患者进行研究,但如果安全可行,未来的随机、安慰剂对照试验可以帮助确定 MTT 如何影响基于基线微生物组特征的疾病以及各种药物疗法可能如何受到影响或如何影响 MTT 的疗效(因为细菌代谢会影响药物疗法的代谢)。未来,随机安慰剂对照试验还可以确定 MTT 如何影响对次要血流动力学终点的同步药理治疗效果。
研究结论:
尽管在了解 PAH 的发病机制方面取得了长足的进步,并且已经开发出改善发病率和死亡率的药物疗法,但 PAH 仍然无法治愈。因此,需要新的方法来表征和治疗这种疾病。我们的研究是研究 MTT 作为 PAH 治疗方法的第一步。此外,未来的研究还可以识别特定的微生物组特征,该特征可用作 PAH 的预测生物标志物或结果生物标志物。在未来的研究中,如果 MTT 成功或提高已建立的药物疗法的疗效,MTT 可能成为一种简单、无毒的疗法以改善 PAH 预后的基石。
参考文献:
Moutsoglou DM. 2021 ATS BEAR Cage Winning Proposal: Microbiome Transplant in Pulmonary Arterial Hypertension. Am J Respir Crit Care Med. 2021 Nov 10. doi: 10.1164/rccm.202108-1833ED. Epub ahead of print. PMID: 34758276.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#cagE#
107
#微生物#
156
#动脉高压#
83
棒
91
不错,学习了。
117
学习
90
#ATS#
77
#创新#
76
#微生物组#
86