11月29日,苏州生物医药企业艾博生物宣布继今年8月获得7.2亿美金C轮融资后再次完成3亿美元C+轮融。3个月融资10.2亿美元,艾博生物为何能连续获得巨额投资?究其根本,是艾博掌握了行业发展的“流量密码”——mRNA。
mRNA为何被称为“流量密码”?
2021年2月初,世界顶尖科学家协会(WLA)发布报告全球年度报告,mRNA入选2020年度有影响力的科学突破;2月24日,《麻省理工科技评论》(MITTechnology Review)发布2021年“全球十大突破性技术”名单,mRNA疫苗位列Top1;9月26日,2021年拉斯克临床医学研究奖(Lasker~DeBakeyClinical Medical Research Award)授予了在mRNA技术上做出开拓性贡献的KatalinKarikó与Drew Weissman。mRNA疫苗成为了新冠期间的“关键词”。
在过去几年里,mRNA技术最亮眼的成就莫过于新冠疫苗的研发。截止2021年,已有两款mRNA新冠疫苗投入市场。一是辉瑞制药(Pfizer)和BioNTech的Comirnaty(BNT162b2),近期公布的数据显示其在12-15岁青少年人群中的疫苗效力达到了100%。该疫苗此前已获得美国FDA批准作为2针免疫程序,用于16岁及以上人群的免疫接种。二是Moderna的mRNA-1273,该疫苗于2021年11月经美国疾病控制和预防中心(CDC)推荐通过紧急使用授权(EUA),用于18岁及以上人群加强针注射。
不管是国内的艾博生物,还是国外的辉瑞与Moderna,在过去的几年间都获得了多轮巨额投资,成为资本推崇的“宠儿”,而能够有此机遇正是因为mRNA技术未来巨大的发展潜力以及mRNA药物可能给疾病治疗带来的革命性变革。新冠疫苗使得mRNA技术异军突起般出现在了大家视野里,让大家关注到了mRNA的未来可期,因而迅速发展成为医药行业的“流量密码”。

来源:Lasker Foundation
什么是mRNA
mRNA,也就是信使RNA,简单来说,就是一个基因以及一个基因的DNA,转录合成一个mRNA分子,最终制造一个特定的蛋白质用来治疗和预防疾病。
研究表明,mRNA几乎可针对任何基因靶点,基因递送后表达量效率高。mRNA能够快速开发,快速验证,大幅缩短药物研发周期。mRNA不需要进入细胞核、不插入基因组,只瞬时地表达编码蛋白,外源基因造成遗传风险更低。此外,mRNA生产工艺相对简单,生产周期也耗时更短。与其他基因药物相比,mRNA技术具有广泛的应用前景。
从20世纪60年代发现mRNA到如今实现商业化,mRNA发展已历经40年。mRNA技术的应用领域主要分为三大块:免疫疗法、蛋白质替代疗法以及再生医学疗法,其中免疫疗法中的肿瘤免疫治疗和感染性疫苗是目前的研究热点,也是技术最为成熟的领域。
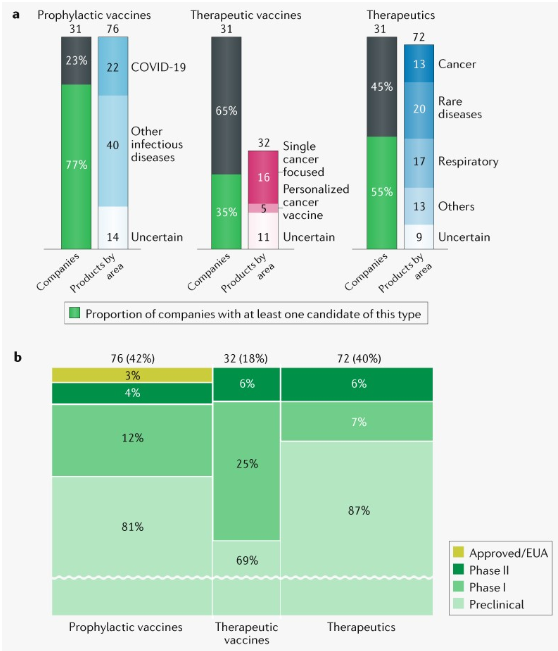
mRNA主要应用领域及产品进度
来源:https://doi.org/10.1038/d41573-021-00147-y
mRNA技术壁垒
mRNA主要技术点在于修饰调控/序列优化系统与递送系统。修饰调控/序列优化系统组件包括帽子结构(Cap)、5’端非翻译区(51JTR)、开放阅读框( ORF)、3端非翻译区(3TJTR)和多聚腺苷酸(Poly(A))尾等。细胞外含有大量RNA酶造成mRNA的降解,进而导致mRNA药物半衰期非常短暂,而半衰期又是影响mRNA治疗药物的药代动力学和药效学的重要因素。为了优化mRNA的效率,研究人员一直在探讨如何优化序列,包括对5’-cap、3’-poly...(A)尾、5'-UTR和3'-UTR以及编码区(CDS)的化学修饰。
递送系统分为非耙向递送系统和耙向递送系统。非耙向递送是指运输进人机体的mRNA非特异性地进人各类细胞或组织,靶向递送则是指通过结合抗体或核酸适配体等方式,将mRNA钯向递送到特定的细胞或组织。非靶向递送系统包括脂质纳米粒(LNP)、多聚体纳米颗粒和蛋白衍生物-mRNA复合体。mRNA是单链分子,如何避免胞内表达前降解是最关键的,因此递送系统就显得尤为重要。目前应用最多的递送系统为LNP,其他递送系统包括脂质多聚合物(LPP)、聚合物纳米颗粒(PNP)、无机纳米颗粒(INP)阳离子纳米乳(CNE)等。
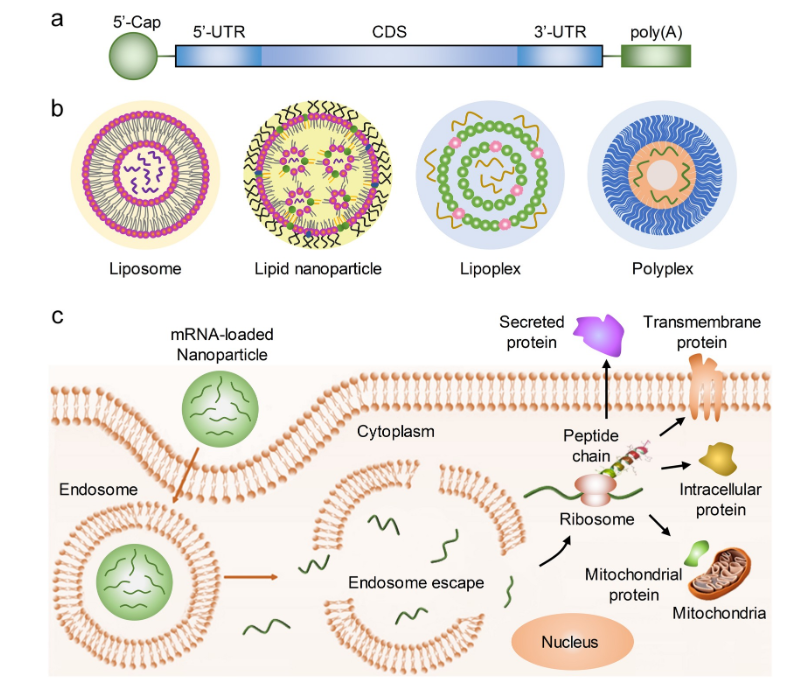
mRNA递送以及蛋白质表达
来源:https://doi.org/10.1016/j.biotechadv.2020.107534
Moderna、BioNTech以及Curevac公司除了采用LNP递送系统外,还有其他递送系统处于研究阶段。LPP是我国斯微生物拥有自主知识产权的递送技术,深信生物也具备核心阳离子递送系统专利,瑞博生物有自主研发的GalNAc递送技术平台可以肝靶向递送药物。从过去的发展来看,递送系统对mRNA技术发展至关重要,拥有专利递送系统才能在市场中站稳脚跟。
mRNA产业未来可期
2021年上半年,全球RNA疗法领域融资达12亿美元,其中mRNA领域融资额占比35%,递送系统融资额也达到16%。融资企业主要是美国(13家)、中国(9家)、欧洲(4家)。据估计,预防型mRNA疫苗在全球范围内每项管线资产的平均峰值销售额约为8亿美元(除COVID-19疫苗外的产品),2035年风险调整后的市场总规模为70-100亿美元(不包括COVID-19疫苗)和120-150亿美元(包括COVID-19疫苗)。
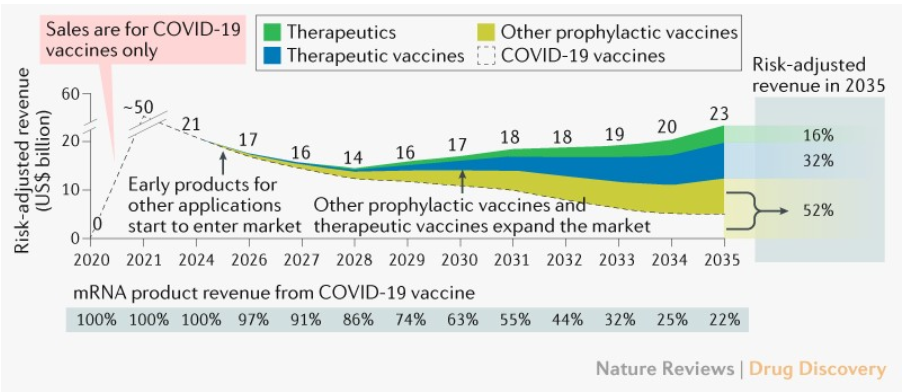
mRNA技术市场预测
来源:https://doi.org/10.1038/d41573-021-00147-y
国际:三足鼎立,领跑世界
Moderna毫无疑问是mRNA领域的“老大”,除了已上市的新冠疫苗,该公司还有多项预防性疫苗在研,除此之外还涉及系统分泌和细胞表面治疗、肿瘤免疫治疗、局部再生治疗以及全身细胞疗法领域。Moderna研究重点倾斜疫苗研发,60%的临床在研项目都是疫苗产品。与Moderna并称“mRNA双雄”的BioNTech则专攻癌症,致力于发展个性化癌症治疗技术,能够抓住机遇实现疫苗商业化还要归功于其优质的临床前、临床后研究团队以及代工生产的合作伙伴,如宾夕法尼亚大学、比尔梅琳达盖茨基金会Genevant等等。“第三巨头”CureVac备受瞩目主要在于其疫苗产品CVnCoV可在5℃环境下稳定保存并保持活性长达3个月,在室温下可保存24小时,但最后临床有效率几乎仅为前两者的一半是令人遗憾的。然而,CureVac并未就此放弃MRNA疫苗研究,将继续与葛兰素史克合作进行第二代新冠候选疫苗的研发,目前处于临床前研究阶段,预计2022 年推向市场。“三巨头”在扩大产能的同时也积极进行技术攻关,力争获得更高效率的递送系统。
国内:积极合作,潜力巨大
国际产业快速发展的同时,国内mRNA产业也按下了快进键,国内领先企业主要是斯微生物与艾博生物。斯微生物拥有自主知识产权的mRNA全产业链技术平台和专利LPP技术,完整的mRNA疫苗分析及质控技术平台,以及年产亿剂mRNA疫苗的大规模生产的关键技术和设备。旗下第二代新冠mRNA疫苗已经进入临床I期试验,该疫苗是国内首个能够高效中和Delta变异株的迭代新冠疫苗产品,数据显示,该疫苗中和抗体水平优于国际已批准产品,并且可以激起针对delta变异株的高效价中和抗体。除了疫苗领域外,斯微生物还涉足基因治疗、肿瘤疫苗、兽用疫苗等领域,现有20余项研发管线及工业化mRNA合成及相关制剂技术。
斯微生物研发管线
mRNA技术的产业链包括上游原材料、中游生产制造环节以及下游的流通运输。从国内外产业发展来看,中游疫苗企业是产业链中最核心环节。中游疫苗企业的生产制造涉及到核心技术专利,如序列设计、LNP递送系统合成,技术壁垒最高,所以在价值链中的占比最大超过80%。上游原材料、分离纯化耗材以及分装灌装的成本合计占终端销售价的12%左右。冷链运输端占终端价的6.7%。因此,国内mRNA技术企业可将发展重点聚焦在中游的设计生产制造领域。
虽然国内mRNA领域整体的产业设施、技术能力、人才积累仍然比较薄弱,距离国际企业还有一段距离,但是随着越来越多的企业布局、资本入局,大型制药公司的参与,政策的鼓励,国内外的发展差距正在逐渐缩小。国内企业只要潜心技术攻坚,未来的市场将规模巨大。

国内mRNA领域公司
新冠疫情的爆发给了短时间内将mRNA疫苗推向市场的可能,并以此推动整个mRNA药物研发领域快速向前发展。最新变异的病毒奥密克戎毒株又给人类提出了新的挑战,如何提高疫苗效率应对不断变化的病毒,保护人类健康,期待未来mRNA完美蜕变,以不断的技术攻坚解决纷繁复杂的难题。
参考资料:
[1]Follow-Up Data FromPhase 3 Trial Of Pfizer-BioNTech COVID-19 Vaccine Support Safety And HighEfficacy In Adolescents 12 Through 15 Years Of Age.
[2]U.S. CDC AdvisoryCommittee on Immunization Practices Recommends Booster Vaccination withModerna’s COVID-19 Vaccine
[3]https://doi.org/10.1038/d41573-021-00147-y
[4]http://www.gyzq.com.cn/a/20200408/65049629.html
[5]https://doi.org/10.1038/nrd4278
[6]德邦证券报告《新冠促进中国疫苗产业全面升级》
[7]西南证券报告《mRNA技术迎来快速发展期,未来前景广阔》
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言