STTT:中山大学蔡木炎/郭荣平/谢丹通过遗传和表观遗传学综合分析揭示多灶性肝细胞癌的DNA修复改变
2023-06-28 iNature iNature 发表于威斯康星
该研究对mHCC的遗传和表观遗传学ITH进行了全面评估,并对可能与肿瘤进化有关的DDR改变的重要性有了新的认识。
肝细胞癌(HCC)是全球第四大致死性癌症,超过50%的病例被诊断为多灶性HCC(mHCC),预后不佳。mHCC表现出更复杂的瘤内异质性(ITH)和克隆进化过程,从而降低了临床治疗的疗效ITH。然而,对于DDR改变在mHCC遗传和表观遗传学进化中的作用知之甚少。
2023年6月23日,中山大学肿瘤防治中心蔡木炎、郭荣平及谢丹共同通讯在Signal Transduction and Targeted Therapy 在线发表了题为“Integrated genetic and epigenetic analysis reveals DNA repair alterations in multifocal hepatocellular carcinoma”的研究论文,该研究对mHCC的遗传和表观遗传学ITH进行了全面评估,并对可能与肿瘤进化有关的DDR改变的重要性有了新的认识。
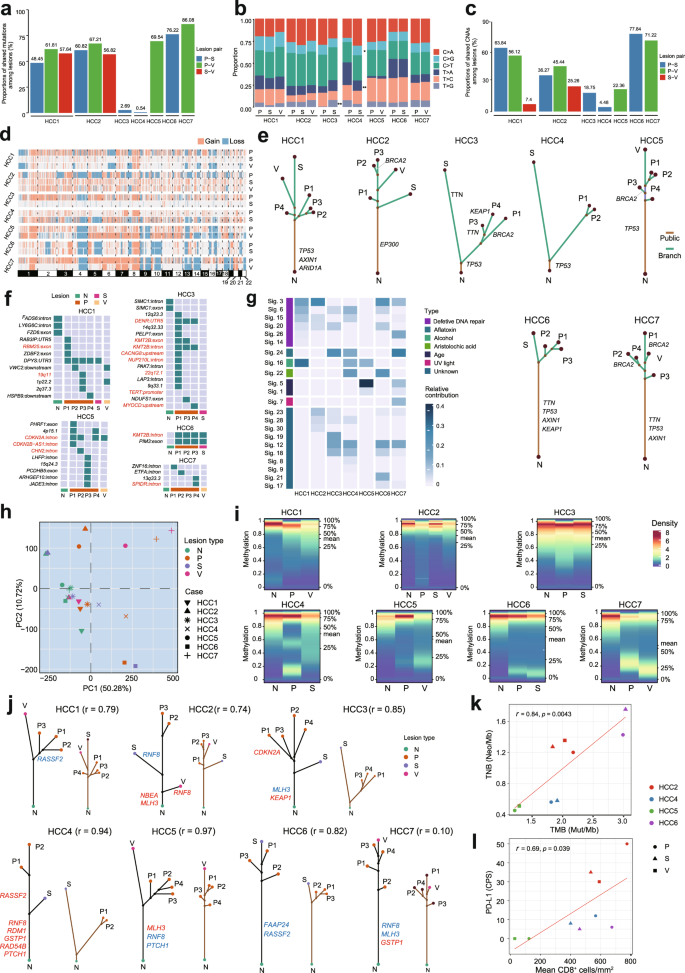
为了破解mHCC中的遗传ITH,研究者对7名mHCC患者的多个病变(ML)进行了全外显子组测序(WES),包括原发性肿瘤、卫星结节和门静脉癌栓。总体而言,研究者发现突变谱和拷贝数改变(CNAs)谱在病变之间和患者之间都是异质的,这表明mHCC的实质性遗传ITH。TP53、AXIN1、KEAP1和TTN是患者中最常见的突变基因。总之,对mHCC的遗传和表观遗传学ITH综合分析揭示了多灶性肝细胞癌的DNA修复改变。

由所有患者的非沉默突变构建的系统发育树显示出分支进化模式。与其他患者相比,HCC3和HCC4的原发性肿瘤和卫星结节表现出更多样的突变和CNA模式,并且在系统发育树中具有更大的遗传距离。HBV DNA整合被认为是HCC肿瘤发生的主要因素。研究者进一步鉴定了HCC1、HCC3、HCC5、HCC6和HCC7中的HBV整合位点。其中,HCC1、HCC5和HCC6的原发性和继发性病变具有共同的HBV整合位点,表明继发性病变继承了原发性肿瘤的HBV整合。这些遗传学发现表明HCC3和HCC4遵循多中心起源(MO),而其他患者更有可能是肝内转移(IM)。根据临床表现,与IM患者相比,MO HCC患者似乎有良好的预后。
为了探索哪些突变过程在mHCC的遗传进化中起作用,研究者进一步进行了突变特征分析。病变之间和患者之间的总体突变谱是不均匀的。有趣的是,在肿瘤血栓的病变中观察到了Signature 5。值得注意的是,除HCC5外的所有病例都具有DDR相关特征,包括Signature 3、6、14、15、20和26,这表明DDR改变可能在mHCC的进化谱中发挥重要作用。在mHCC患者的主干和分支上经常检测到DDR基因如TP53和BRCA2的突变,这表明DDR缺乏可能是肿瘤发生不同阶段的普遍特征。
值得注意的是,DNA损伤检查点基因TP53在除HCC2外的所有患者中都发生了突变,HCC2主要分布在6名患者的躯干上。具体而言,在四名患者(HCC4、HCC5、HCC6和HCC7)的所有病变中,发现TP53突变是克隆事件,这突出了该基因作为进化创始人的潜在作用。BRCA2突变在四名患者中被鉴定为分支事件,表明其可能在mHCC的晚期进化中发挥作用。在突变DDR基因的不同功能类别和途径中,研究者发现P53途径、核苷酸和切除修复途径在mHCC的遗传进化中经常发生改变。
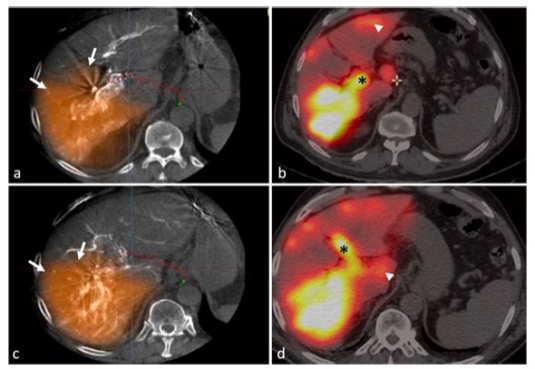
对遗传和表观遗传学异质性的综合评估表明,DNA损伤修复(DDR)改变是多灶性肝细胞癌(mHCCs)的普遍特征(图源自Signal Transduction and Targeted Therapy )
总之,该研究表明,基因DDR的改变可能会促进肿瘤进化的不同阶段,这可能为理解ML进化的潜在机制提供新的见解。在接受免疫治疗的患者中,mHCC的DDR变化可能是免疫治疗疗效的潜在预测因素。
原文链接:
https://www.nature.com/articles/s41392-023-01446-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言