2024必看十大肿瘤热点综述
17小时前 梅斯肿瘤新前沿 MedSci原创 发表于陕西省
本文旨在概述2024年发表的必读肿瘤研究综述,涵盖从基础研究到临床应用的多个方面,以期为科研人员、临床医生和相关领域的读者提供最新的研究动态和思路。
2024年,肿瘤研究继续在全球科研领域占据重要地位。随着生物医学技术的不断进步,科研人员对肿瘤的认识日益深入,治疗方法也愈发多样化。肿瘤,作为一种复杂且多变的疾病,其发生、发展和治疗涉及多个层面和机制。本文旨在概述2024年发表的必读肿瘤研究综述,涵盖从基础研究到临床应用的多个方面,以期为科研人员、临床医生和相关领域的读者提供最新的研究动态和思路。
01.Nature Reviews Immunology:癌细胞代谢与抗肿瘤免疫
文章名:Cancer cell metabolism and antitumour immunity
doi:10.1038/s41577-024-01026-4
长期以来,癌症细胞的代谢变异一直被视为恶性转变及肿瘤发展进程中的关键标志。然而,近期不断涌现的研究进一步揭示了这些代谢变化对于肿瘤免疫微环境以及宿主免疫系统激发有效抗肿瘤应答能力的深远且复杂的影响。2024年4月,维尔康奈尔医学中心的Claire Vanpouille-Box与Lorenzo Galluzzi作为共同通讯作者,在《Nature Reviews Immunology》期刊上发表了一篇题为“Cancer Cell Metabolism and Antitumour Immunity”的综述文章。该文章详尽探讨了癌症细胞代谢重塑对天然免疫及适应性免疫的多维度影响机制,并深入讨论了针对这些代谢途径的潜在治疗策略。
癌症的发生与演进伴随着广泛的代谢途径显著变迁,这些变化可大致归结为三大情境:首先,特定酶编码基因的突变导致代谢产物积累,这些突变往往是肿瘤起始的核心驱动力;其次,癌基因或抑癌基因的遗传或表观遗传变异亦能直接作用于代谢过程;第三,随着肿瘤在时间与空间上的不断演变,癌细胞会发展出适应恶劣微环境的代谢适应策略,这些适应策略是肿瘤内部及肿瘤间异质性的主要促成因素,且常牵涉到肿瘤基质,为癌细胞生长与分裂提供必要的代谢底物。
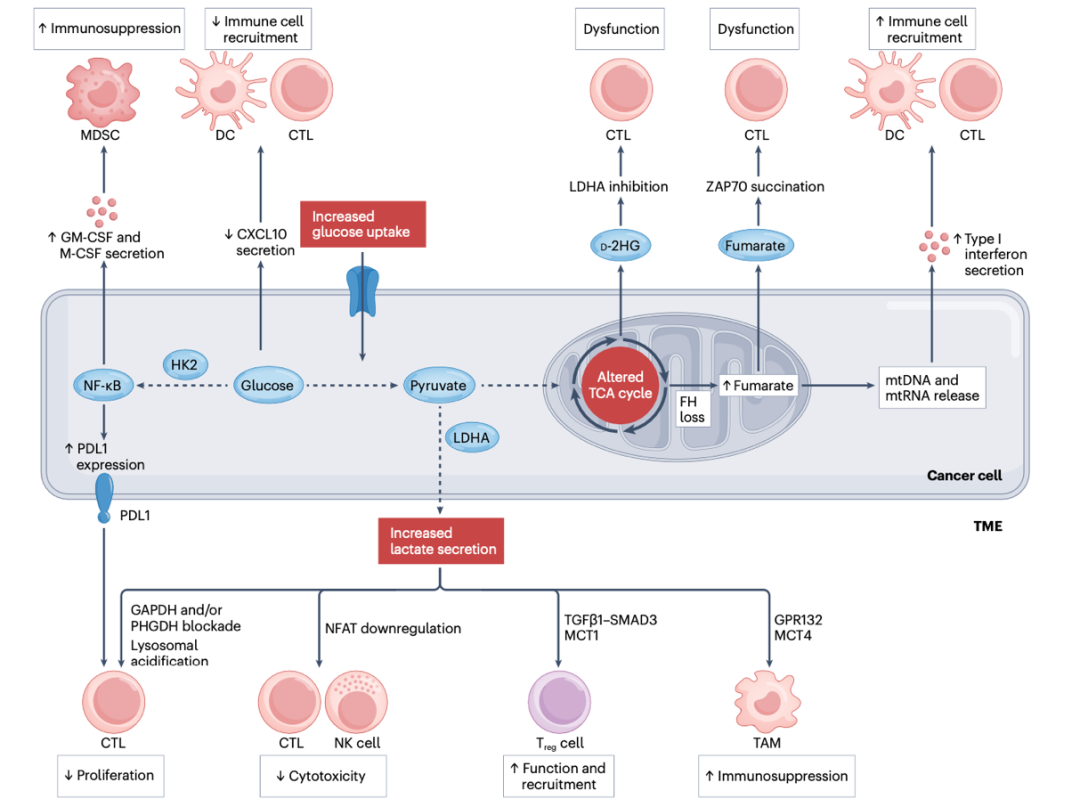
葡萄糖、乳酸和三羧酸循环对抗肿瘤免疫的影响
当前主流观点认为,肿瘤的发生不仅是由遗传或表观遗传突变所驱动的癌细胞内在变化,还牵涉到显著的肿瘤细胞外源性因素,这些因素驱动着肿瘤细胞表型、分泌及行为特征的获得,使其能够规避宿主免疫系统的识别与清除。本文的核心在于探讨癌细胞核心代谢变化如何干预自然免疫及治疗诱导的免疫监视过程,并评估了通过针对这些代谢变化来强化抗肿瘤免疫应答的潜力。
02.Nat Rev | 肿瘤微环境如何驱动癌症
文章名:Beyond genetics: driving cancer with the tumour microenvironment behind the wheel
DOI: 10.1038/s41568-023-00660-9
长期以来,癌症被视为一种主要由累积突变驱动的遗传性疾病。然而,最新的证据表明,即便是在仅表达一种或少数几种致癌基因的成年组织细胞中,也可能在某些条件下形成具备恶性肿瘤所有特征的癌症。这些看似矛盾的观察结果,在忽视环境因素诱导的表观遗传变化时,显得尤为难以解释,因为这些变化可能加速或抑制恶性转化的进程。2024年2月,美国洛克菲勒大学的Elaine Fuchs教授团队在国际权威期刊《Nature Reviews Cancer》上发表了一篇题为“超越遗传学:肿瘤微环境驱动癌症发展”的论文,深入探讨了某些致癌基因如何启动干细胞与其环境间的双向错误通讯,通过非遗传机制重塑下游事件,进而改变组织的形态发展轨迹。
本综述聚焦于肿瘤生物学中的非遗传驱动因素,这些因素中的许多早已被揭示。随着我们对突变负荷无法全面解释癌症特性的认识日益加深,癌症遗传学家开始转向非遗传变异以寻求答案。先进的分子技术和高通量工具的应用,特别是在突变负荷低且稳定的动物模型中的实践,极大地推动了我们对肿瘤微环境及其在癌症进展中关键作用的认知。过去十年间,新的数据支持了一个观点:对于多数癌症而言,一旦干细胞发生初始致癌突变,非遗传驱动因素便可能成为肿瘤发生与进展的诸多因素中的主导力量。实际上,小鼠恶性侵袭性肿瘤的发生可由单一癌基因的激活引发,而人类癌症的研究则显示,遗传多样性是肿瘤进展的早期事件之一,且伴随转移过程的遗传变异极为有限。这些最新研究强调了将癌症单纯视为遗传性疾病的局限性。相反,它们揭示了组织干细胞在获得癌基因后,会开启一条与其微环境错误通讯的时间路径,导致新的信号传导级联激活,并伴随染色质和转录后的变化。尽管这些复杂通信网络的分子细节仍在不断揭示中,但加剧因素对癌症的影响很可能至少部分源自其自然组织的再生特性。
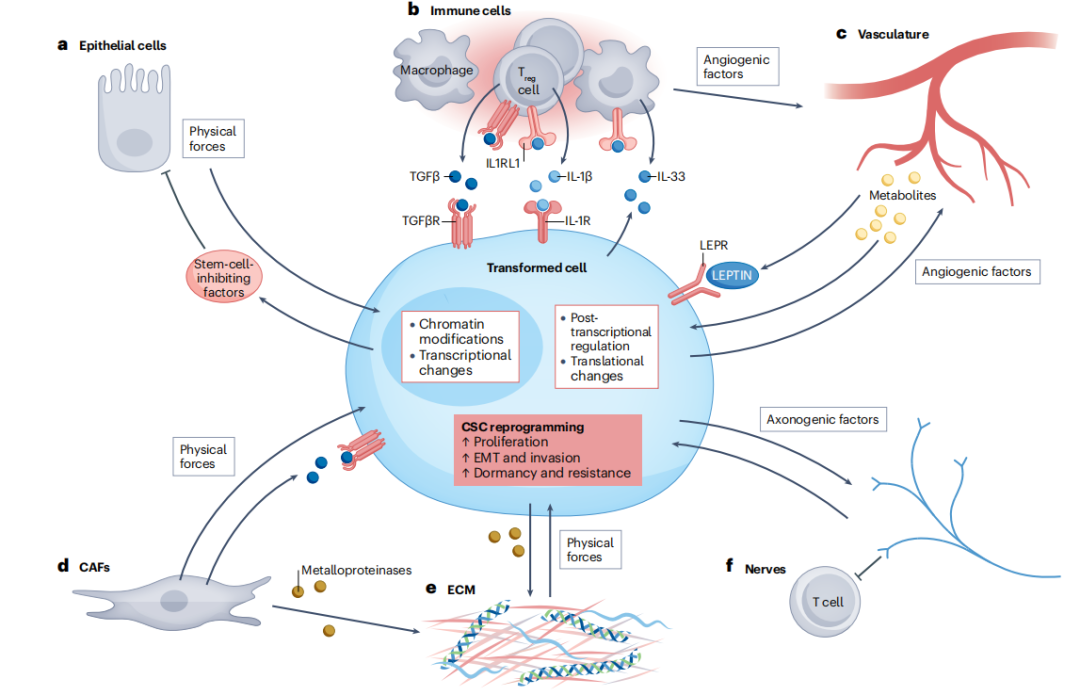
转化细胞与微环境之间的串扰诱导了癌症干细胞的状态
对于如表皮和肠道这样几乎持续自我更新的组织而言,炎症在癌症进程中的重要性可能不同于更新速率较低的胰腺和汗腺等组织,后者在追求组织增殖时干细胞需进行额外的动员。尽管仍存在诸多未解之谜,但新兴的证据体系为开发多样化癌症疗法提供了希望。特别是,非遗传因素在推动(有时甚至是必需)肿瘤进展中的作用对于新疗法的开发至关重要,因为大多数癌症患者死于复发和转移性疾病。干细胞长期积累的表观遗传记忆,以及它们对压力情境的记忆和加剧反应的能力,对于非遗传驱动的可塑性和癌症具有深远意义,而DNA甲基化对三维染色质拓扑结构的长期重组效应同样如此。正如本综述所强调的,该领域正开始转变对突变负荷的看法,认为在许多情况下,可能不可逆地锁定那些本可通过肿瘤起始的癌症干细胞(CSCs)与其周围肿瘤微环境(TME)之间的不适应交流而激活的表观遗传路径。过去数十年专注于癌症基因组的测序,而未来十年则可能集中于通过空间高通量配体-受体分析来深入理解癌症中的细胞通信网络。
综上所述,癌变过程和肿瘤发展可视为遗传与非遗传因素之间的动态平衡,这种平衡尤其针对特定的癌细胞及其在肿瘤发展过程中不断变化的微环境。将癌症置于这一范畴内,能更精确地反映癌细胞行为的复杂性,这将有助于未来的研究揭示新的治疗靶点,为癌症治疗策略的开发提供有力支持。
03.Cell Cancer :TME中的可溶性介质的分泌和感应
Distinct spatiotemporal dynamics of CD8+ T cell-derived cytokines in the tumor microenvironment
DOI: 10.1016/j.ccell.2023.12.010
在免疫应答中,CD8+T细胞通过与靶细胞形成突触释放裂解颗粒,包含细胞毒性分子如穿孔素和颗粒酶,以清除被感染的或异常的细胞。此外,T细胞受体(TCR)信号转导会触发一系列细胞因子的释放,如干扰素γ(IFNγ)、肿瘤坏死因子α(TNFα)和白细胞介素-2(IL-2),这些细胞因子能单独或协同作用,引起细胞转录组的广泛变化。例如,IFNγ受体(IFNγR)信号转导能增强抗原呈递、免疫检查点分子的表达,并招募其他免疫细胞。IFNγ和TNFα还参与调节巨噬细胞和树突状细胞的活化与成熟,以及促进肿瘤细胞的衰老、凋亡和铁死亡。本研究旨在深入分析IFNγ和TNFα等细胞因子对肿瘤微环境(TME)的影响。
2024年1月8日,来自荷兰肿瘤研究所的Ton N. Schumacher 团队在Cancer Cell(IF 50.3 Q1)发表题目为“Distinct spatiotemporal dynamics of CD8+ T cell-derived cytokines in the tumor microenvironment”的研究。本研究通过bulk mRNA测序分析人卵巢癌(OVCAR5)细胞在不同细胞因子或细胞因子组合暴露下的转录组变化,揭示了由IFNγ或TNFα选择性诱导的基因集,并鉴定出由这些细胞因子组合诱导的新基因集。这些基因集的相对表达提供了丰富的细胞因子暴露时间信息,区分了不同表达模式的基因。
同时,研究发现,来源于T细胞-肿瘤细胞共培养物的细胞培养基中高水平的IFNγ和TNFα诱导的基因表达谱与双重细胞因子暴露时观察到的相似。通过机器学习模型,作者编制了一组细胞因子信息基因,用于区分细胞因子反应和无反应基因,并经过多次迭代训练,得到一组612个细胞因子响应基因。其中,90种基因对IFNγ或TNFα具有单反应,而大部分基因在IFNγ和TNFα同时存在时表现出协同反应。此外,分析基因表达动力学发现,不同细胞因子暴露时间下,基因表达呈现“早期”、“Plateau”和“晚期”等不同模式,为预测细胞因子暴露持续时间提供了可能。本研究不仅揭示了IFNγ和TNFα等细胞因子对肿瘤微环境的复杂影响,还通过创新方法提供了细胞因子暴露时间和类型的详细信息,为理解免疫应答和肿瘤控制提供了新的视角。
04.Cell Stem Cell重磅综述:肿瘤干细胞定义与肿瘤干性特征
Hallmarks of cancer stemness
DOI: 10.1016/j.stem.2024.04.004
肿瘤干细胞作为肿瘤复发和治疗耐药的根源,一直是癌症研究的焦点。除了已知的肿瘤启动能力、自我更新能力和分化的能力的定义性特征标志(defining hallmark),肿瘤干细胞的“可塑性”作为一项新兴特征标志(emerging hallmark),为我们提供了对抗癌症的新视角。
最近,研究人员在Cell Stem Cell上发表了题为“Hallmarks of cancer stemness”的综述。该综述的发表改变了以往对癌症研究的散乱认知,将众多艰涩难懂的概念归纳为可以简短表述的特征,成为肿瘤癌症领域研究必读经典,并且指导了后续一众肿瘤药物的开发。
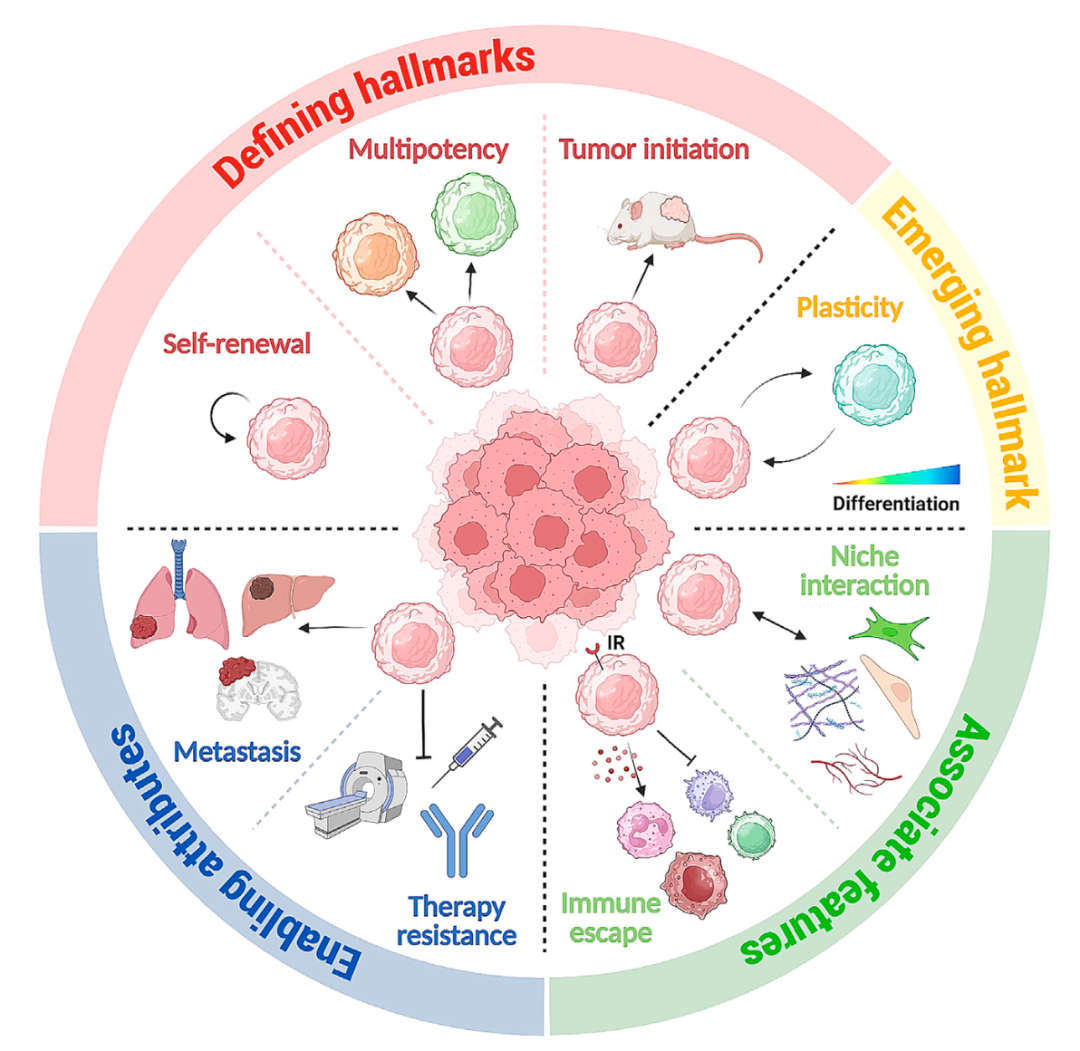
肿瘤干细胞的定义性特征、新兴特征和使能特征示意图
05.Cancer Cell:癌症中的乳酸化和修饰
Lactylation in cancer: Current understanding andchallenges
DOI: 10.1016/j.ccell.2024.09.006
乳酸化是一种新型蛋白质翻译后修饰,最早于2019年通过肽免疫沉淀与HPLC-MS/MS分析相结合被鉴定。这种修饰最早被发现与癌细胞和巨噬细胞中通过表观遗传调节对基因转录的调节有关。乳酸化的发现为理解Warburg效应的功能意义提供了一条新途径,因为乳酸是这种修饰的关键驱动因素。随后的研究表明,乳酸化发生在多种蛋白质上,包括组蛋白和非组蛋白,并且与不同的生理和病理背景有关。本文概述了当前对乳酰化的理解,并讨论了将这种修饰明确归因于特定生物学作用所面临的固有挑战。
研究人员强调了在病理生理相关条件下精确调控乳酰化水平的必要性,除此之外,还需要进一步的研究来确定,乳酰化除反映次要的代谢改变外在肿瘤生物学中是否发挥关键作用。

06.Mol Cancer丨干细胞中的超级增强子组学综述
Super-enhancer Omics in Stem Cel
DOI: 10.1186/s12943-024-02066-z
在探索干细胞特性的奥秘中,增殖、自我更新、发育潜能、分化路径以及再生能力等关键属性,均依赖于由遗传信息与表观遗传调控共同维护的干细胞身份。超级增强子(SE),作为一类由密集排列的活性增强子构成的调控元件,通过精密调控转录程序,在稳固干细胞特性方面扮演着核心角色。SE所介导的转录复合物,囊括了SE本身、非编码RNA、核心转录因子、媒介分子及其他共激活因子,它们通过形成相分离的凝聚体结构,为干细胞命运的多样化调控提供了精准的“开关”机制。随着组学技术的不断革新与拓展,特别是聚焦于SE多维度特征的研究,“超级增强子组学”这一新兴概念应运而生,它与广泛的泛组学研究紧密交织,共同绘制着生命科学的宏伟蓝图。

2024年8月1日,中南大学屈强团队在《Molecular Cancer》期刊上发表的题为“Super-enhancer Omics in Stem Cell”的综述文章,深刻揭示了SE在干细胞领域中的时空组织规律与核心概念,并详尽阐述了SE介导的转录复合物如何与干细胞的核心特性——包括身份维持、自我更新、多能性、分化潜能及发育过程——紧密相连。文章进一步揭示了干细胞中SE与致癌SE如何通过操控癌症干细胞内部的基因组与表观遗传变异,从而调控癌干细胞行为的复杂机制。此外,该综述还展望了利用小分子药物、基因组编辑技术及反义寡核苷酸等手段,靶向SE复合物成分,以治疗SE相关器官功能障碍及包括癌症在内的多种疾病的潜力。通过SE这一独特视角,该综述不仅为干细胞研究开辟了新视野,也为未来科研与实践提供了宝贵的洞见与指导。
07.Cancer Cell |多组学空间分析:肿瘤微环境的临床转化新视角
Spatial oncology: Translating contextual biology to the clinic
DOI:10.1016/j.ccell.2024.09.001.
2024年10月,Cancer Cell杂志发表了题为“Spatial oncology: Translating contextual biology to the clinic ”的综述,探讨了多组学空间分析在肿瘤微环境研究中的应用,并评估其在临床治疗中的潜在价值。
研究结果表明,多组学空间分析能够揭示肿瘤微环境中的细胞间相互作用和组织结构,这对于理解肿瘤的免疫逃逸和治疗抗性至关重要。例如,通过空间转录组学分析,研究人员能够识别出与免疫治疗反应相关的特定免疫细胞亚群,以及与治疗反应性相关的空间生物标志物。此外,研究还发现,肿瘤微环境中的特定细胞状态和空间组织结构与患者的预后和治疗反应密切相关。这些发现为开发新的治疗策略和预测治疗效果提供了重要信息。
研究者强调了空间分析技术在肿瘤学中的转化潜力。通过将分子信息与组织背景相结合,这些技术不仅能够揭示肿瘤的复杂性,还能够为临床决策提供精确的分子和空间信息。尽管这些技术在临床应用中仍面临挑战,如成本、生物信息学工具的开发和高通量工作流程的需求,但它们的发展前景令人振奋。未来的研究将进一步探索这些技术在临床治疗中的应用,并评估其对患者护理的潜在影响。随着技术的不断进步和成本的降低,预计这些技术将在未来的肿瘤治疗中发挥越来越重要的作用,为患者提供更精准的治疗方案。
08.Cancer Cell:肿瘤免疫逃逸的机制
The hallmarks of cancer immune evasion
DOI: 10.1016/j.ccell.2024.09.010
尽管在癌症早期,恶性细胞可以被免疫系统有效地消除,但也可以通过遗传或表观遗传改变,实现明显的免疫逃逸。2024年10月Cancer Cell上发表了题为“The hallmarks of cancer immune evasion”的综述,作者根据肿瘤免疫的“3E”模型提出了新的“3C”模型来回顾癌症免疫逃避的特征、与这些特征相关的宿主改变以及预防或逆转此类免疫逃避机制以达到治疗目的的有前景的策略。
本综述提出了一个新的概念框架来对癌症免疫逃避进行分类,表明恶性细胞逃避免疫识别和消除的大多数机制涉及“三个C”:伪装、强制或细胞保护。癌细胞表现出遗传或表观遗传缺陷,同时涉及多个“C”,以实现免疫逃避和加速疾病进展。新的临床相关的策略急需开发以规避它们。
09.Cell丨肿瘤是一种全身性复杂疾病
Embracing cancer complexity: Hallmarks of systemic disease
https://doi.org/10.1016/j.cell.2024.02.009
过去 50 年见证了对致癌机制的理解取得了非凡的进展,这些机制被综合为癌症的标志。尽管有这个逻辑框架,我们对机体全身性表现的分子基础和癌症相关死亡的根本原因的理解仍然不完整。展望未来,阐明肿瘤如何与远处器官相互作用以及多方面的环境和生理参数如何影响肿瘤及其宿主,对于预防和更有效地治疗人类癌症的进展至关重要。
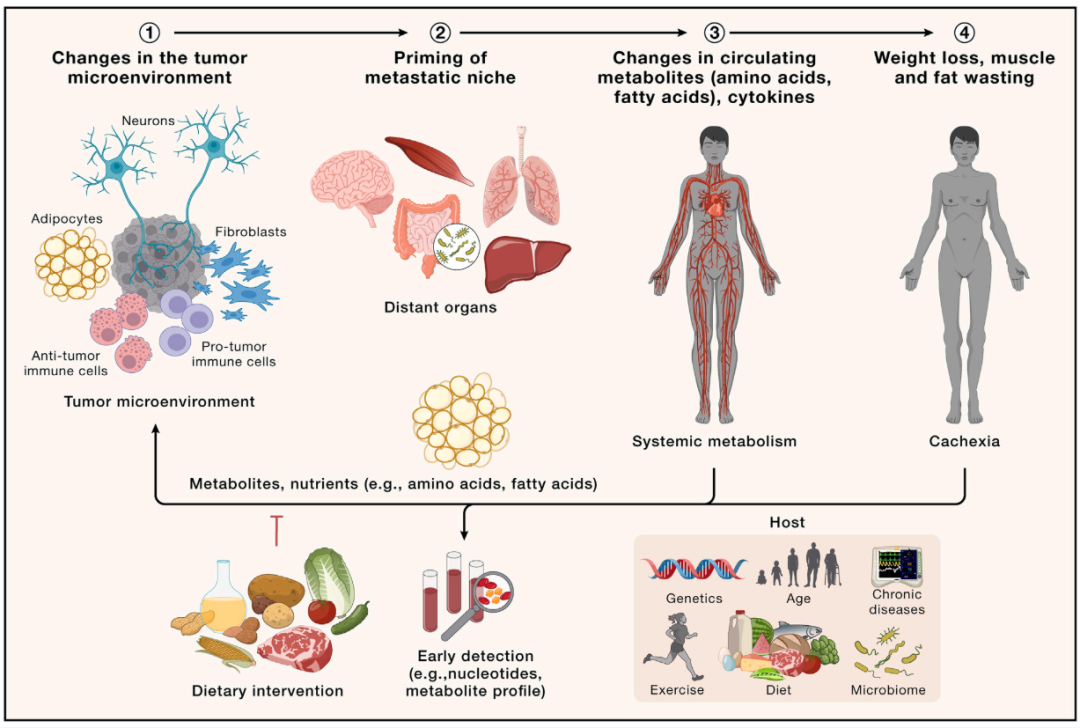
来自英国Francis Crick 研究所的Charles Swanton在Cell上发表观点性文章Embracing cancer complexity: Hallmarks of systemic disease。作者讨论了癌症作为一种全身性疾病的复杂性,包括肿瘤的发生和发展、肿瘤微环境和免疫宏观环境、衰老、代谢和肥胖、癌症恶病质、昼夜节律、神经系统相互作用、肿瘤 - 相关的血栓形成和微生物组。作者认为纳入人类遗传变异的模型系统对于破译这些现象的机制基础并阐明基因与环境的相互作用至关重要,从而提供分子肿瘤学的综合理解,预防癌症并改善患者的生活质量和癌症结果。这篇文章强调了癌症不仅仅是一种局部疾病,而是一种与身体的各种生理系统和外部环境相互作用的系统性疾病,主张采取全面的癌症研究和治疗方法,考虑癌症与身体生理和外部环境交织在一起的众多方式。
10.第十篇:Nature丨肿瘤组织中的微脉管组成细胞
Tumor vasculature at single-cell resolution
https://www.nature.com/articles/s41586-024-07698-1
肿瘤的生长离不开周围血管提供的氧气与营养物质。2024年7月10日,重庆大学附属三峡医院印明柱教授团队利用单细胞测序技术捕获肿瘤组织中的微脉管组成细胞,阐释了肿瘤脉管系统的复杂形成过程。相关研究成果以Tumor vasculature at single-cell resolution为标题发表在Nature杂志。该研究构建了第一份肿瘤脉管系统全息细胞图谱,不仅为更好理解肿瘤血管生成的复杂过程提供了新的视角,还为开发新的抗血管生成治疗策略提供了重要的理论基础。

结语
在回顾了2024年的十大肿瘤综述研究后,能够深切体会到肿瘤研究正经历着一场深刻的范式转变:从以往聚焦于单一环节的探索,逐步迈向全面系统的研究范畴;从单一组学的孤立视角,进化到多组学跨领域的深度整合,这种整合甚至跨越了传统意义上的组织界限,实现了跨越时空的深远联结。尤为重要的是,当前的研究重心已转向对肿瘤动态演变过程的深入剖析与交互机制的细致探索。
总而言之,2024年的肿瘤研究领域见证了众多里程碑式的突破。从基础科学的肿瘤代谢机制、细胞死亡路径的阐释,到临床实践的精准医疗策略,科研人员以前所未有的热情与智慧,不断拓宽着肿瘤防治的边界,为患者带来了新的希望。但鉴于肿瘤作为一种高度复杂且全身性的疾病,其起病与进展深受多重因素的交织影响,未来的研究仍需不断深化,力求更加透彻地揭示肿瘤的生物学本质,以期研发出更为高效且安全的治疗方案,为全球肿瘤患者点亮生命之光。
参考文献:
doi:10.1038/s41577-024-01026-4
DOI: 10.1038/s41568-023-00660-9
DOI: 10.1016/j.ccell.2023.12.010
DOI: 10.1016/j.stem.2024.04.004
DOI: 10.1016/j.ccell.2024.09.006
DOI: 10.1186/s12943-024-02066-z
DOI:10.1016/j.ccell.2024.09.001.
DOI: 10.1016/j.ccell.2024.09.010
https://doi.org/10.1016/j.cell.2024.02.009
https://www.nature.com/articles/s41586-024-07698-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#综述# #肿瘤研究#
6