武汉理工大学常柏松研究员/中科院上海药物所程震教授《AFM》:可激活 Janus 纳米粒子用于精确近红外二区成像及癌症协同治疗
2024-03-01 BioMed科技 BioMed科技 发表于上海
该工作合成了一种雪人状的Janus异质结构纳米探针,用于可激活的近红外二区生物成像指导下的PTT/CDT肿瘤协同治疗,这为单组分诊断治疗剂的设计应用提供了一种新的策略。
2024年2月25日,武汉理工大学材料复合新技术国家重点实验室常柏松研究员与中科院上海药物所程震教授合作在Advanced Functional Materials上以“Activatable Janus nanoparticles for precise NIR-II bioimaging and synergistic cancer therapy”为题,报道了在肿瘤诊断治疗一体化研究上取得的最新进展。论文第一作者:鲍家晟(武汉理工大学硕士研究生),共同一作:刘瑞褀(上海药物所博士后),通讯作者:常柏松研究员,共同通讯作者:中科院上海药物所程震教授。该工作合成了一种雪人状的Janus异质结构纳米探针(Ag2S-Ag-mPEG,简称AAP),用于可激活的近红外二区(NIR-II,1000-1700 nm)生物成像指导下的PTT/CDT肿瘤协同治疗,这为单组分诊断治疗剂的设计应用提供了一种新的策略。
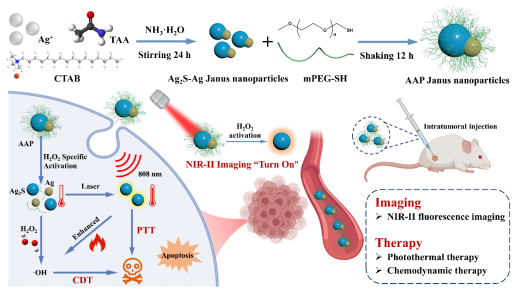
图1. AAP Janus探针合成途径示意图及可激活的NIR-II成像引导下CDT和PTT协同治疗作用。
将精准诊断与有效治疗的功能整合在一起,设计多功能治疗剂,对于同时实现高分辨率生物成像的精准控制和对恶性肿瘤的及时治疗干预具有重要贡献。治疗医学的研究,一个重要的前提是对多功能生物材料进行严格的规划和合成,特别是那些对物理、化学、生物、双、三或多种刺激具有敏锐和精确敏感性的智能纳米治疗剂。广泛使用的治疗材料通常需要同时装载诊断和治疗药物。然而,复杂的合成过程、有限的负载量和不理想的药物在肿瘤部位的释放行为是多组分治疗材料面临的主要挑战。此外,单个组分的复杂性可能对生物系统造成不利影响。因此,设计较少成分的治疗材料的设计对于广泛的生物关键肿瘤相关应用尤其具有决定性意义。
针对上述问题,研究团队利用一步法合成了AAP Janus纳米粒子,其活性极微弱的荧光信号可以被肿瘤微环境中过表达的过氧化氢显著激活,实现精准的肿瘤部位成像。同时,AAP Janus探针展现出金属Ag和半导体Ag2S的双重特性。Ag部分通过消耗过氧化氢可以产生羟基自由基(·OH)进行高效化学动力学治疗(CDT),而Ag2S部分具有令人印象深刻的光热治疗(PTT),Ag和Ag2S部分的组合进一步增强了AAP Janus探针协同治疗效果。AAP Janus探针作为一种单组分治疗剂,其材料设计为NIR-II生物成像引导的肿瘤协同治疗提供了一个巧妙的平台,为提高疗效和减少副作用提供了一种可行的方法。
要点一:雪人状的Janus纳米探针的设计和结构调控
利用透射电镜(TEM)对合成的AAP Janus纳米粒子的形貌和结构进行了表征,可以清晰的看到AAP Janus纳米粒子的雪人状结构,尺寸约为17 nm,浅色的“身体”部分是Ag2S成分,而另一个深色的"头部"则是Ag成分。XRD和XPS分析也表明了异质二聚体AAP Janus纳米粒子的成功合成。红外光谱和动态光散射则表明mPEG成功包覆在Ag2S-Ag Janus纳米粒子表面。
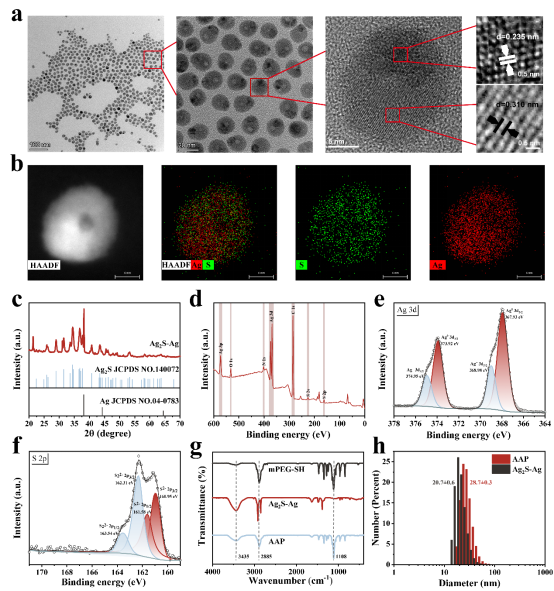
图1. AAP Janus纳米粒子的结构表征。(a) Ag2S-Ag Janus纳米粒子的TEM图像,(b) Ag2S-Ag Janus纳米粒子的HAADF图像和元素图谱,(c) Ag2S-Ag Janus纳米粒子的X射线衍射图样。(d-f) Ag2S-Ag Janus纳米粒子的XPS分析。(g) mPEG-SH、Ag2S-Ag和AAP Janus纳米粒子的红外光谱。(h) Ag2S-Ag和AAP Janus纳米粒子的动态光散射粒径。
要点二:可激活的NIR-II荧光成像
Ag2S纳米材料具有极佳的近红外-II荧光发射性能,然而,由于AAP Janus 纳米粒子中等离子体Ag分子的存在,材料几乎没有荧光信号。随着H2O2的加入,AAP Janus 纳米粒子中的Ag0与H2O2反应生成Ag+,从而消耗了AAP Janus 纳米粒子中的等离子体Ag部分,其在1270 nm处的近红外-II荧光强度随之恢复。实现了AAP Janus 纳米粒子的NIR-II荧光从"OFF to ON"的转变。
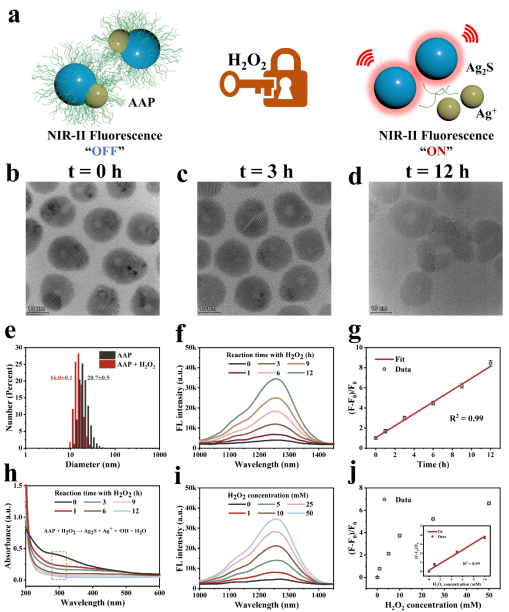
图2. AAP Janus纳米粒子的荧光性能。(a) AAP Janus 纳米粒子的H2O2激活示意图。(b-d) AAP Janus纳米粒子与H2O2反应后的TEM图像。(e) AAP Janus 纳米粒子与H2O2反应前后的粒径变化。(f-g) H2O2处理不同时间后AAP Janus纳米粒子的荧光光谱和相对强度。(h) H2O2处理不同时间后AAP Janus纳米粒子的紫外可见吸收光谱。(i-j) 不同浓度的H2O2处理后AAP Janus纳米粒子的荧光光谱和相对强度。
要点三:AAP Janus纳米粒子的PTT效果
AAP Janus 纳米粒子具有极佳的光热性能,光热转换效率(η)约为56.8%。通过调节AAP Janus 纳米粒子的浓度、辐照功率密度和辐照时间,可以优化AAP Janus纳米粒子的温升,实现可控的治疗温度。
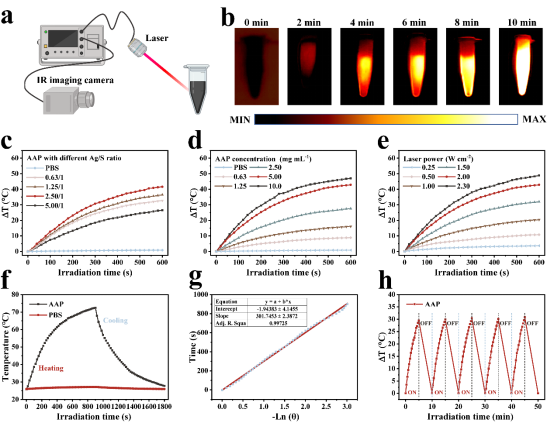
图3. AAP Janus纳米粒子的光热转换能力。(a) 光热转换实验示意图。(b) AAP Janus 纳米粒子在808 纳米激光照射下的热图像。(c) 不同Ag/S投料比的AAP Janus纳米粒子在808纳米激光照射下的温度变化曲线。(d) 不同浓度的AAP Janus纳米粒子在 808 纳米激光照射下的温度变化曲线。(e) AAP Janus 纳米粒子在不同激光功率下的温度变化曲线。(f-g) AAP Janus 纳米粒子的光热转换效率。(h) AAP Janus 纳米粒子在五次循环照射下的温度变化。
要点四:AAP Janus纳米粒子的CDT效果
AAP Janus 纳米粒子可以通过类芬顿反应催化TME中的H2O2以产生具有细胞毒性的·OH实现CDT应用。AAP Janus纳米粒子对H2O2的亲和力与天然酶HRP相当。同时,动力学研究结果表明,AAP Janus纳米粒子具有良好的类POD活性,能高效催化·OH的生成,这为其在CDT中的应用打开了大门。
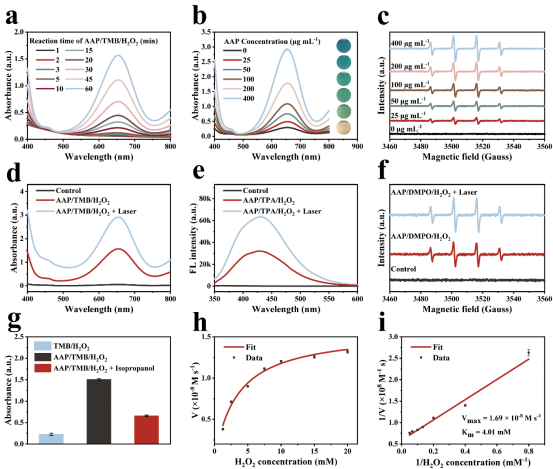
图4. AAP Janus纳米粒子的类POD活性。(a) AAP Janus纳米粒子和TMB/H2O2在反应不同时间的紫外可见吸收光谱。(b) 不同浓度的AAP Janus纳米粒子和TMB/H2O2反应的紫外可见吸收光谱。(c) 不同浓度的AAP Janus纳米粒子和H2O2反应的ESR图谱。(d) AAP Janus纳米粒子和TMB/H2O2在有无激光照射时的紫外可见吸收光谱。(e) AAP Janus纳米粒子和TPA/H2O2在有无激光照射时的荧光光谱。(f) 有无激光照射时AAP Janus纳米粒子和H2O2反应的ESR图谱。(g) 加入异丙醇后AAP/TMB/H2O2在652 nm处的吸光度。(h-i) 以H2O2为底物的AAP Janus纳米粒子的Lineweaver-Burk图。
要点五:AAP Janus纳米粒子协同治疗效果
为了验证上述NIR-II成像和PTT/CDT效果,团队单独制备了Ag和Ag2S纳米粒子,探究各组分所发挥的作用。AAP Janus 纳米粒子可通过H2O2对Ag组分的刻蚀,恢复Ag2S组分的荧光,在肿瘤部位实现精准的近红外-II荧光成像。同时,Ag2S部分可在激光照射下实现可控升温,具有很好的光热转换效率,实现高效的PTT。Ag成分具有类POD的活性,能催化H2O2生成·OH。此外,两组分相互促进,可显著增强协同PTT/CDT效果。
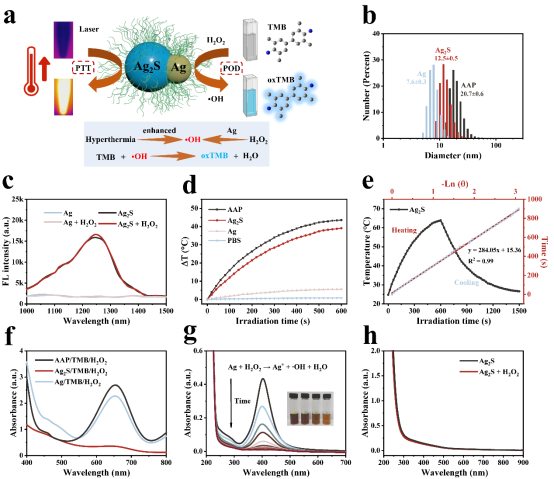
图5. AAP Janus纳米粒子的协同治疗效果。(a)AAP Janus 纳米粒子的协同治疗示意图,其中Ag2S组分主要实现可激活的近红外-II成像和PTT,Ag组分实现CDT。(b) Ag纳米粒子、Ag2S纳米粒子和AAP Janus纳米粒子的粒径。(c) 加入H2O2前后Ag纳米粒子和Ag2S纳米粒子的荧光光谱。(d) 用激光照射Ag纳米粒子、Ag2S纳米粒子和AAP Janus纳米粒子的温度变化曲线。(e) Ag2S纳米粒子加热和冷却过程的温度变化以及光热转换效率。(f) 不同反应体系的紫外可见吸收光谱。(g-h) 加入H2O2前后Ag纳米粒子和Ag2S纳米粒子的紫外可见吸收光谱。
要点六:AAP Janus纳米粒子的体外和体内研究
体外实验观察了AAP Janus纳米粒子的细胞毒性和PTT/CDT治疗效果以及NIR-II成像能力,评估其对肿瘤细胞的成像效果和杀伤能力。同时在荷瘤小鼠研究AAP Janus纳米粒子的体内成像和抗肿瘤作用。可以发现,AAP Janus纳米粒子可以被肿瘤组织过量的过氧化氢特异性激活实现精准的NIR-II成像,同时在激光照射下,可以对肿瘤组织实现较强的CDT/PDT作用,有效抑制了肿瘤生长,肿瘤抑制率高达96.2%。此外H&E染色及主要器官血液生化指标显示,AAP Janus纳米粒子组具有良好的生物相容性。
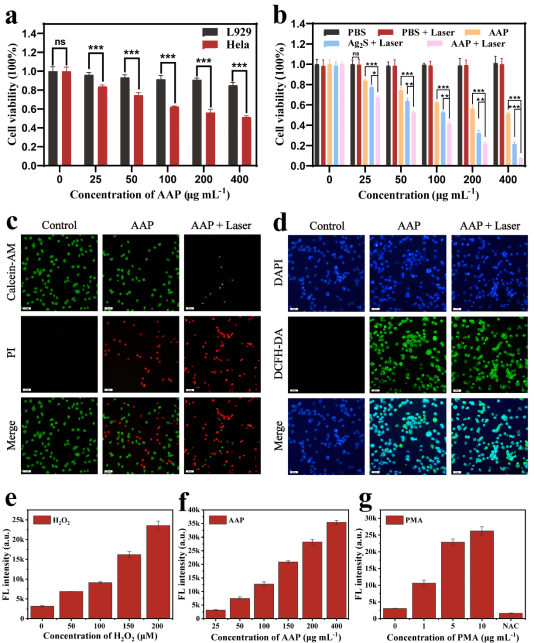
图6. AAP Janus纳米粒子的体外研究。(a) 不同浓度的AAP Janus纳米粒子对L929和HeLa细胞的细胞活性的影响。(b) 不同处理条件下HeLa细胞的细胞活性。(c) 活细胞(绿色)和死细胞(红色)的荧光染色结果。(d )与AAP Janus纳米粒子孵育后,用DAPI(蓝色)和DCFH-DA(绿色)染色的HeLa细胞荧光图像。(e-g) AAP Janus探针在细胞中的荧光成像性能,分别用不同浓度的H2O2、AAP Janus纳米粒子和PMA/NAC进行处理。
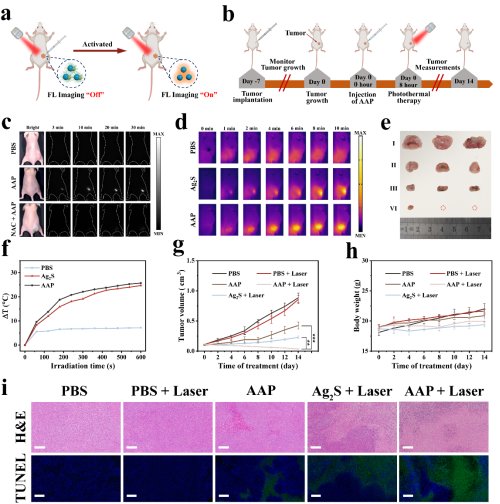
图7. AAP Janus纳米粒子的体外研究。(a) AAP Janus纳米粒子在荷瘤小鼠体内H2O2响应NIR-II荧光成像示意图。(b)AAP Janus纳米粒子的肿瘤处理过程示意图。(c)注射AAP Janus纳米粒子后的NIR-II活体成像。(d) AAP Janus纳米粒子和Ag2S纳米粒子在808 nm激光照射下荷瘤小鼠肿瘤部位的红外热像图。(e) 不同治疗条件治疗后的离体肿瘤图像。(f) AAP Janus纳米粒子和Ag2S纳米粒子在808 nm激光照射下荷瘤小鼠肿瘤部位的温度升高曲线。(g)不同治疗条件下小鼠肿瘤体积变化。(h) 治疗期间不同治疗条件的小鼠体重变化。(i) 不同治疗条件的肿瘤切片H&E染色及TUNEL分析。
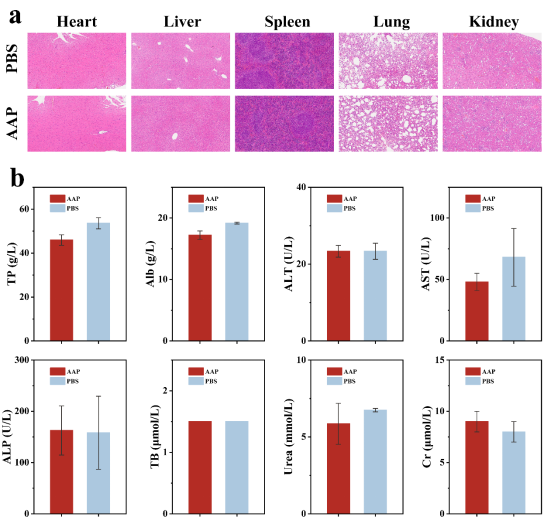
图8. AAP Janus纳米粒子的生物相容性。(a) 分别注射AAP Janus纳米粒子和PBS后14天收集的主要器官的H&E染色。(b) 分别注射AAP Janus纳米粒子和PBS后14 天小鼠血液生化指标。
以上结果表明,AAP Janus探针作为一种单组分诊断治疗剂,其可以实现可激活NIR-II生物成像指导下高效的PTT/CDT肿瘤协同治疗,具有很大的应用潜力,这为提高肿瘤治疗效果和减少副作用提供了一条有希望的途径。
相关工作得到了国家自然科学基金的大力支持。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202316646
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Janus纳米粒子# #近红外二区# #肿瘤协同治疗#
49