全球CAR-细胞疗法获批上市,一个新时代的到来?
2017-09-07 应志涛 朱军 (北京大学肿瘤医院) 中国医学论坛报
2017年8月30日,美国食品与药物管理局(FDA)批准嵌合抗原受体T细胞(CAR-T)疗法tisagenlecleucel上市,用于治疗难治或至少接受二线方案治疗后复发的B细胞急性淋巴细胞白血病(ALL)。这是全球首个获得批准的CAR-T 疗法,也是美国市场的第一个基因治疗产品,具有里程碑式的意义。来自北京大学肿瘤医院的应志涛医生、朱军教授针对此次审批的意义,以及对我国的影响进行解读。
2017年8月30日,美国食品与药物管理局(FDA)批准嵌合抗原受体T细胞(CAR-T)疗法tisagenlecleucel上市,用于治疗难治或至少接受二线方案治疗后复发的B细胞急性淋巴细胞白血病(ALL)。这是全球首个获得批准的CAR-T 疗法,也是美国市场的第一个基因治疗产品,具有里程碑式的意义。来自北京大学肿瘤医院的应志涛医生、朱军教授针对此次审批的意义,以及对我国的影响进行解读。
Tisagenlecleucel获批背后的故事
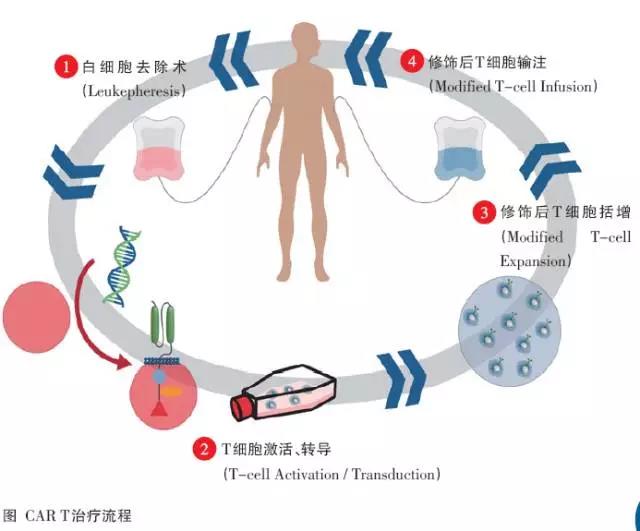
CAR-T是一种细胞免疫治疗方法,在体外对来自患者的T细胞进行改造,使其表达能够特异识别肿瘤细胞表面靶点的受体——嵌合抗原受体(CAR),然后再回输到患者体内发挥抗肿瘤作用(图)。
Tisagenlecleucel的获批是基于诺华公司的一项多中心的临床研究。研究中63例儿童和年轻B细胞ALL患者接受CAR-T细胞治疗,3个月内总缓解率为83%,其中40例患者获完全缓解。经过6个月随访,75%患者仍然维持有效。12个月随访时仍由64%的患者维持疗效。
实际上,诺华并非美国市场唯一专注研发CAR-T细胞的公司。其主要竞争对手朱诺(Juno)和凯德药业(Kite)[已被吉利德公司(Gilead)收购 ] 也布局CAR-T疗法。
就在上个月,FDA完成了对Kite公司的CAR-T产品KTE-C19的生产基地和治疗中心的审查。预计KTE-C19可能会在未来的1~2个月内获得FDA批准用于治疗复发难治B细胞淋巴瘤。
而Juno公司的产品JCAR 015在复发难治B细胞ALL中也取得过不错成绩。但由于在研究中有多例患者死于脑水肿,最终Juno宣布放弃JCAR 015的研发,目前专注研发JCAR 017和JCAR 014。
亟待解决的问题
目前CAR-T细胞在血液肿瘤领域的临床应用尚存在很多问题亟待解决。
【问题1】如何实现规模批量生产
CAR-T细胞治疗是一种个体化治疗方法,与传统药物存在很大不同。如何实现规模批量生产是扩大临床应用面临的主要问题。
尚无标准的规范化生产及质量控制标准 质量控制贯穿于整个细胞培养过程,目前尚没有标准用于CAR-T细胞规范化生产与质量控制。而在临床应用过程中也不能采用传统药物研发的标准评估药代,药效,药理及毒理特点。
【问题2】治疗需要等待时间较长,而可缩短等待的“桥接化疗”却不能控制病情
不同公司的细胞培养时间不同,从采集细胞到CAR-T回输到患者体内大概需要2~4周的时间。而细胞输注后又不能马上起效,所以从细胞采集到产生疗效的时间会更长。考虑到目前接受CAR-T细胞治疗的患者多数为晚期,病情进展迅速,部分患者不能等待如此长的时间。
多数试验中考虑到这一点,患者可以在细胞培养时接受“桥接化疗”控制肿瘤。但由于这些患者在接受细胞治疗前已经接受过多线方案化疗,“桥接化疗”可能并不能控制病情。
【问题3】CAR-T导致毒副反应的预防和处理
临床使用过程中,CAR-T导致的毒副反应的预防和处理也是关注的重点。FDA批准tisagenlecleucel上市的同时,也特别强调需要警惕CAR-T治疗过程中可能发生的危及生命的副作用,包括细胞因子释放综合征(CRS)以及神经系统毒性。为了处理这些副作用,FDA还扩大批准了妥珠单抗(IL-6R单抗)的适应证,用于治疗应用CAR-T细胞后产生的CRS。
【问题4】需要强大的细胞冷链物流
接受CAR-T细胞治疗的患者,需要将采集到的外周血细胞冷链运输到指定实验室,培养成功后,再通过冷链运输到医疗机构回输到患者体内。期间不仅要保证细胞质量,还要预防细胞污染。因此,强大的细胞冷链物流显得极为重要。
【问题5】CAR-T疗法在实体瘤领域进展缓慢
相对于CAR-T在血液肿瘤里取得的骄人的成绩,其在实体瘤领域进展缓慢。治疗中或者疗效不满意,或者毒副反应不能控制。这可能与实体瘤特有的免疫抑制微环境,以及所选择靶点不够特异有关。如何在实体肿瘤治疗中有所突破,是未来的重要方向。
【问题6】价格昂贵
以此次获批的tisagenlecleucel为例,一次治疗费用为47.5万美元,价格昂贵。未来需要考虑如何能够降低细胞治疗的成本,使更多患者受益于该治疗。
CAR-疗法在我国的发展
首个针对复发难治B细胞淋巴瘤的CAR-T项目即将启动
中国国内本土企业也在CAR-T领域开展了很多临床研究,数量近百项,仅次于美国。今年4月上海复星与Kite成立合资公司复兴凯特,拟在中国市场引进Kite公司产品KTE-C19。Juno与药明康德在中国成立合资公司药明巨诺,计划在中国开展其细胞疗法的研发。预计10月份将在北京大学肿瘤医院启动第一个针对复发难治B细胞淋巴瘤的CAR-T项目。
北京大学肿瘤医院淋巴瘤科自2013年开始采用CAR-T细胞治疗复发难治淋巴瘤患者,现已完成40多例患者的治疗,相关临床研究正在顺利进行中。
CAR-T在中国面临的挑战
中国科研团队、企业以及临床机构要想在嵌合抗原受体T细胞(CAR-T)技术领域有所突破,需要关注并解决以下几个问题。
避免盲目跟风 国内的研发团队和相关企业不应该盲目跟风追随,而需要在CAR-T研发中有所创新,以设计出更多更有效更安全的CAR-T细胞。
中国市场的价格敏感性将促使企业提供质优价廉的细胞治疗产品,最大限度提高治疗可及性。
保证研究设计和实施的高水平 临床试验应设计高水平的研究方案,在实施过程中严格遵守方案,以获得真实可靠的临床数据,经得起监管部门的监督和审核。
出台CAR-T细胞研发、监管及审批的相关的政策法规 不同于传统药物,CAR-T细胞因其特殊性质如何监管也是一大难点。随着美国批准第一个CAR-T细胞产品上市,国内监管部门也做出积极响应,会尽快在CAR-T细胞的研发、监管及审批环节出台相关政策法规。
朱军教授
本次获得批准的CAR-T细胞疗法的适应证为复发难治B细胞急性淋巴细胞白血病(ALL),但具有划时代意义,为后续CAR-T细胞在淋巴瘤,骨髓瘤以及其他实体肿瘤中获批探明了道路。
随着CAR-T技术的不断成熟,未来有望逐步走向血液肿瘤的一线治疗。而CAR-T细胞疗法可能会改变血液肿瘤甚至整个肿瘤领域的治疗模式。
正如美国FDA局长Scott Gottlieb博士所说,“基因和细胞疗法等创新科技具有变革医学的潜能,也让我们在棘手疾病的治疗上迎来转折点,让我们有望治疗,甚至治愈这些疾病。”
我们有理由相信,血液肿瘤将再次引领整个肿瘤治疗的方向。
撰写:应志涛 朱军 (北京大学肿瘤医院)
来源:中国医学论坛报
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#获批上市#
57
#CAR-#
56
#新时代#
65