Nature子刊:体外重建人血脑屏障揭示APOE4在周细胞中的致病机制
2023-02-14 brainnew神内神外 brainnew神内神外 发表于安徽省
在阿尔茨海默病中,淀粉样蛋白沿着大脑血管沉积会导致大脑淀粉样血管病(CAA),这种疾病会损害血脑屏障(BBB)功能,加速认知和记忆功能的退化。
在阿尔茨海默病中,淀粉样蛋白沿着大脑血管沉积会导致大脑淀粉样血管病(CAA),这种疾病会损害血脑屏障(BBB)功能,加速认知和记忆功能的退化。载脂蛋白(APOE4)是CAA最强的危险因素,但其遗传易感性的机制尚不清楚。2021年2月,麻省理工学院学习与记忆研究所的Li-Huei Tsai课题组在《Nature Medicine》发表文章,揭示了周细胞在APOE4介导的CAA中的作用,并强调钙调神经磷酸酶-活化T细胞核因子(NFAT)信号作为CAA和阿尔茨海默病的潜在治疗靶点。
 血脑屏障对正常的神经元功能至关重要,它保护大脑免受病原体的侵害,并严格控制脑脊液的成分。神经元的健康与血脑屏障提供能量、清除废物和保护周围病原体的能力直接相关。因此,脑血管病变是老年人认知能力下降的危险因素。
血脑屏障对正常的神经元功能至关重要,它保护大脑免受病原体的侵害,并严格控制脑脊液的成分。神经元的健康与血脑屏障提供能量、清除废物和保护周围病原体的能力直接相关。因此,脑血管病变是老年人认知能力下降的危险因素。
大多数阿尔茨海默病(AD)患者脑血管系统有淀粉样沉积,这种病理情况称为CAA。APOE4是CAA和散发性AD最强的遗传危险因子。然而,潜在的分子和细胞机制尚不清楚,目前还没有治疗或干预方法。为了解决这些局限性并研究携带APOE4基因易患CAA的机制,作者在体外重建人类血脑屏障模型。
1.人血脑屏障解剖生理特性的体外重建
人类血脑屏障是通过脑内皮细胞(BECs)、人诱导多能干细胞(iPSCs)、壁细胞(MCs)和星形胶质细胞(Astrocytes)三种细胞类型的相互作用形成的。作者首先优化了将iPSCs分化为BECs、MCs和星形胶质细胞,并对每种细胞类型的形态和标记表达特征进行分析(图1a)。
BECs、iMCs(i-,人胚胎干细胞诱导而来的细胞或组织,下同)和星形胶质细胞随后被包裹在Matrigel中, 2周后BECs被组装成巨大的毛细血管样连接通的CD144阳性的细胞网络(图1b) 。2周后,iMCs重组,占据BEC血管近端位置。sm22阳性和ng2阳性的细胞排列在大小内皮血管上、反映MCs的体内覆盖范围,(图1c,d),大量星形胶质细胞包围着每条血管,延伸的胶质纤维酸性蛋白(GFAP)阳性突起进入血管周围空间(图1e)。在体内星形细胞的末端足作用于毛细血管,运输分子如水通道蛋白4 (AQP4)被定位。为了检测iBBB的生理特性,作者建立了一个转换系统,该系统由BECs在渗透膜上的汇合单层组成,IMC和星形胶质细胞在顶部分层(图1i、j)。
跨内皮电阻(TEER)是一种敏感可靠的通透性指标。外周内皮细胞,具有相对较高的通透性,因此表现出较低的TEER。结果显示,BECs与星形胶质细胞和IMC共同培养时没有显著变化(图1k)。单独培养的BECs的 TEER明显更高(图1k),但有可变性。数据说明iBBB具有较高的TEER,降低了分子渗透率和射流泵的极化,这是BBB在体内的关键功能特性。
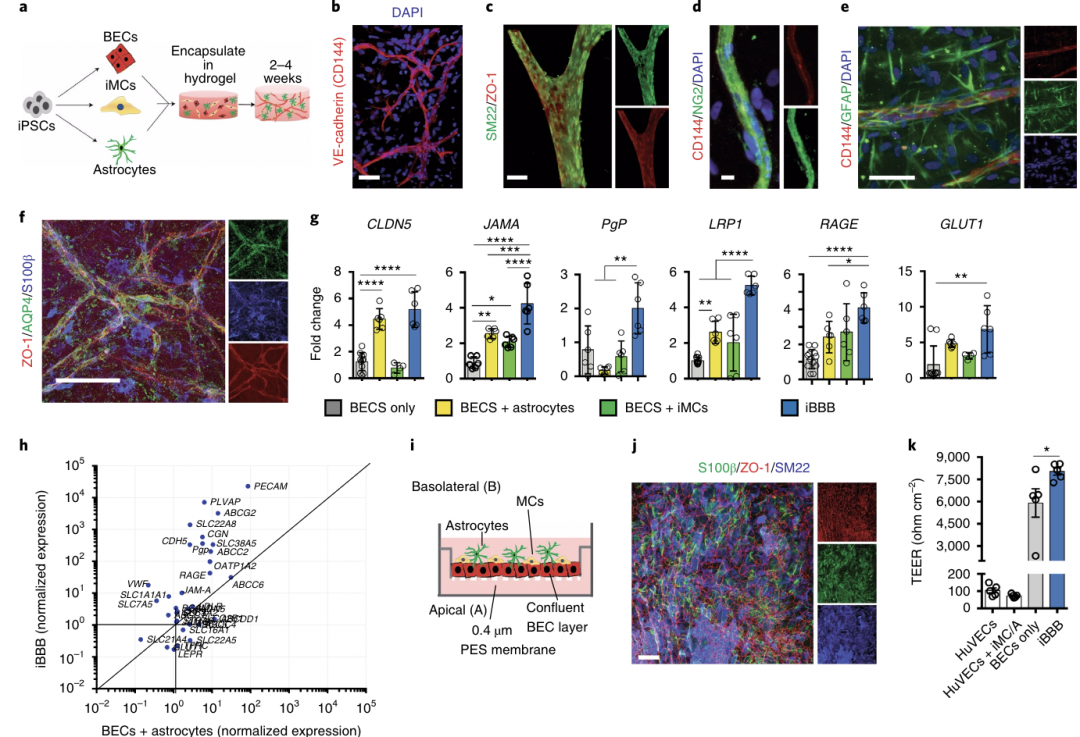 图1 iBBB生理特性重建
图1 iBBB生理特性重建
2、APOE4增加了iBBB中Aβ的积累
接下来,作者研究了iBBB是否可以模拟AD中的血管病变。在体内,BBB不是淀粉样蛋白的最大来源,而神经元才是。因此,使用了来自对照组和家族性AD(fAD)患者的富含Aβ的条件培养基,暴露在非AD条件培养基中的iBBBs表现出极少的淀粉样蛋白积累(图2a、b)。相比之下,暴露于fAD条件培养基的iBBB有明显的淀粉样蛋白积累,这表明iBBB可以模拟体内观察到的血管淀粉样蛋白沉积(图2b)。
为了检验iBBB淀粉样蛋白的积累是否受APOE基因型的影响,作者从含有等位基因的APOE3/3和APOE4/4的 iPSCs中衍生出iBBB。暴露于fAD条件培养基的环境中,含有等位基因APOE4/4的iBBBs相比于含有等位基因APOE3/3的iBBBs表现出显著更大的淀粉样蛋白累积(图2c, d)。与APOE3/3 iBBB相比,APOE4/4 iBBB培养液中可溶性单体Aβ减少,进一步表明APOE4 iBBB比APOE3 iBBB积累更多的淀粉样蛋白(图2h)。
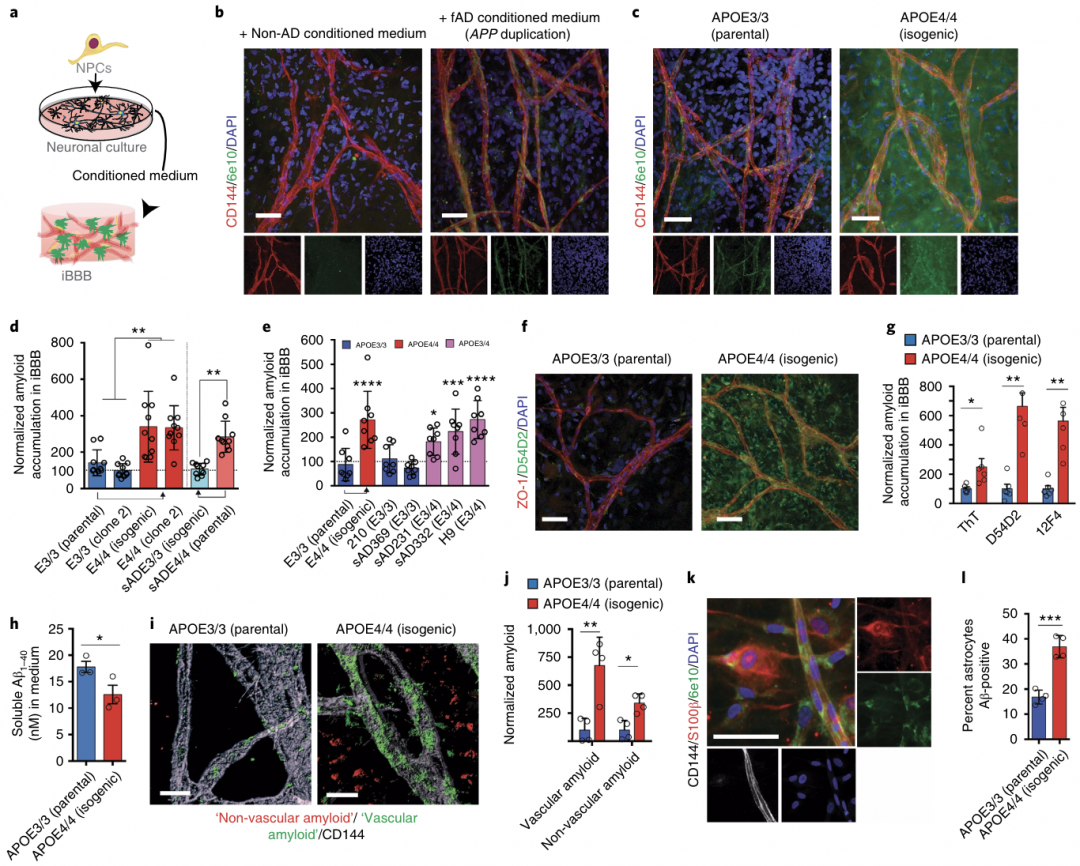
图2 APOE4增加了iBBB中Aβ的积累
3、APOE4周细胞中APOE和钙调磷酸酶信号上调
作者通过qRT-PCR,分别证实了iMCs和星形胶质细胞中APOE的差异上调和下调(图3b)。接下来,作者分析了APOE4携带者和非携带者海马区的snRNA-seq数据。APOE4携带者在海马周细胞中的APOE表达显著高于非携带者(图3f),而在内皮细胞中无差异,并且局限于周细胞中。小鼠研究表明,APOE是CAA病理和APOE3/4单倍体剂量不足时大脑淀粉样蛋白积累所必须的。
为了测试APOE是否与淀粉样蛋白积累增加有关,作者在iMC条件培养基中免疫APOE,然后将APOE3 iBBBs暴露于Aβ环境中。APOE4/4 iMC条件培养基中APOE的免疫缺失显著减少了淀粉样蛋白的积累(图3i)。同样,将APOE增加到APOE4 iBBB中观察到的浓度足以增加APOE3 / 3 iBBB中淀粉样蛋白的积累。这说明APOE蛋白丰度影响淀粉样蛋白的积累,提示在APOE4 iMC中减少APOE蛋白可以减少淀粉样蛋白的积累。非活性的NFAT存在于细胞质中并于此被活化,激活后钙调神经磷酸酶使NFAT去磷酸化,允许其转位到细胞核并与基因调控元件相互作用。免疫染色和WB显示,APOE4 iMCs的细胞质和核NFATc1蛋白显著升高(图3k)。
此外,编码钙调磷酸酶、PPP3CA和PPP3CC催化亚基的基因在APOE4 iMCs中显著上调。这些结果表明,APOE4 iMCs存在与APOE4升高相一致的双向改变。抑制钙调磷酸酶降低APOE表达,可以改善Aβ沉积。使用钙调磷酸酶抑制剂抑制iMCs中的钙调磷酸酶信号通路。2周后,通过qRT - PCR检测,显著降低了APOE4/4 iMCs中APOE的表达(图5a)。APOE3/4杂合子iMCs在使用三种钙调磷酸酶抑制剂时也显示出APOE mRNA表达的显著降低。最后作者验证表明钙调神经磷酸酶- NFAT抑制剂可降低体内周细胞APOE4水平和血管内淀粉样蛋白的积累,可以用于减轻疾病病理进程。
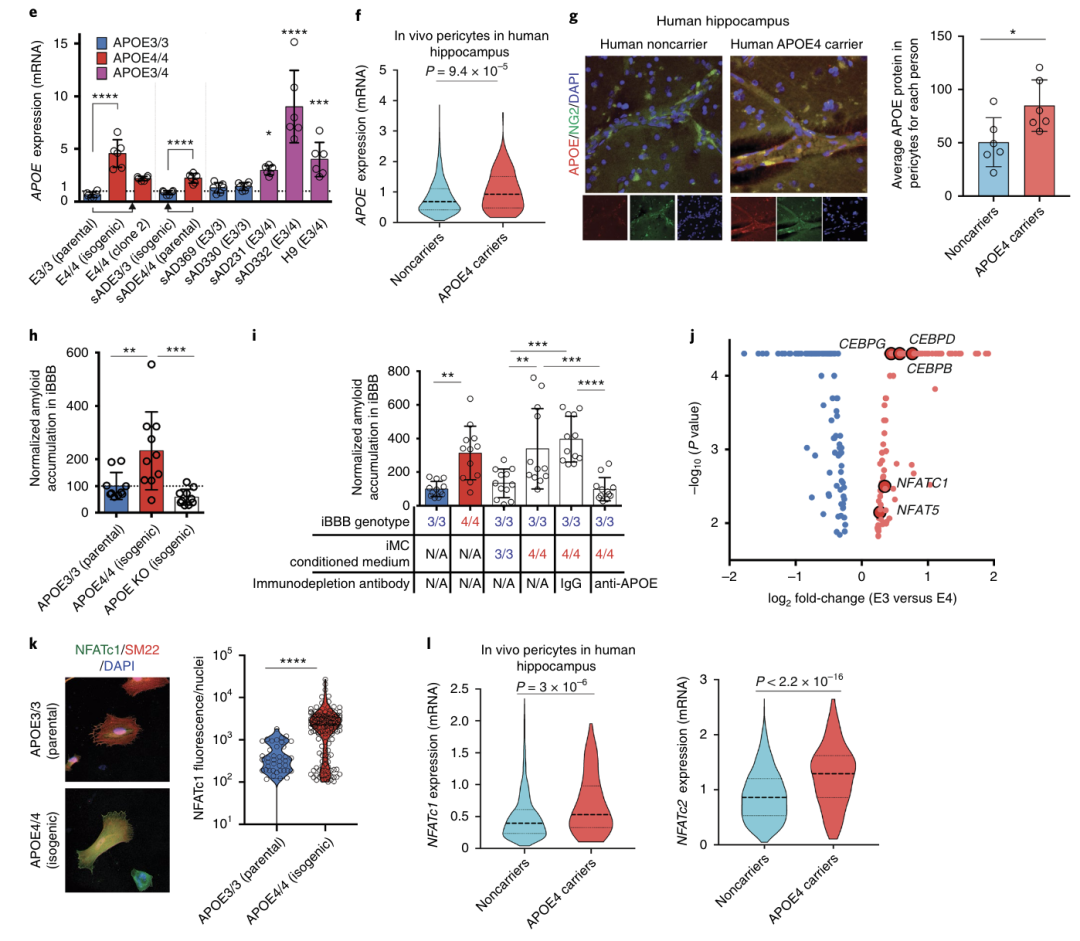
图3 APOE4周细胞中APOE和钙调磷酸酶信号上调
讨 论
作者开发并验证了一个血脑屏障的体外模型,并且iBBB概括了许多分子层面上和体内血脑屏障生理特征有明显的差异,这将有助于未来对于阿尔茨海默病、CAA等神经退行性疾病等病理研究,并提高诱导性多能干细胞来源的血管细胞的保真度。本研究揭示了NFAT介导的人周细胞APOE的上调可能是APOE4在CAA中的致病作用。
作者发现APOE4携带者和大脑海马区周细胞的APOE以及NFAT的异常调节,并且证实对APOE4 iMCs钙调磷酸酶的化学抑制降低了APOE的mRNA表达和蛋白的表达,导致血管淀粉样蛋白积累减少。APOE4 表型AD小鼠体内钙调磷酸酶/ NFAT抑制剂也能显著降低APOE表达和血管淀粉样蛋白对积累。作者的研究结果为这些观察提供了新的见解,并且强调APOE4介导的CAA和AD的潜在靶点是APOE和钙调磷酸酶- NFAT信号通路。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






