Science:Wnt家族蛋白结构的解析为开发新抗癌药物提供希望
2012-06-09 T.Shen 生物谷
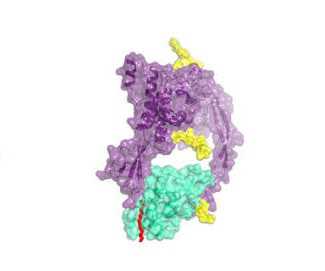
研究者提出了一种三维成型技术,可以清楚了解Wnt蛋白的功能,并且能够清楚地阐明蛋白的卷曲受体(Frizzled receptor),以便我们可以设计出抗Wnt蛋白疗法来治疗癌症和其它疾病。(Credit: Image: K. Christopher Garcia) Wnt家族20种蛋白质是控制机体发育和生长所必须的重要蛋白质,但是近30年来,科学家并不知道这些蛋白质的“真面目”。这些蛋白质可以逃

研究者提出了一种三维成型技术,可以清楚了解Wnt蛋白的功能,并且能够清楚地阐明蛋白的卷曲受体(Frizzled receptor),以便我们可以设计出抗Wnt蛋白疗法来治疗癌症和其它疾病。(Credit: Image: K. Christopher Garcia)
Wnt家族20种蛋白质是控制机体发育和生长所必须的重要蛋白质,但是近30年来,科学家并不知道这些蛋白质的“真面目”。这些蛋白质可以逃避标准的可视化技术,因为它们不溶于以水溶液中。近日,来自斯坦福大学的研究者开发出了一种新的方法可以首次清楚地解析Wnt家族蛋白质的结构。相关研究成果刊登在了5月31日出版的国际杂志Science上。研究者在文章中提出了一种三维成型技术,可以清楚了解Wnt蛋白的功能,并且能够清楚地阐明蛋白的卷曲受体(Frizzled receptor),以便我们可以设计出抗Wnt蛋白疗法来治疗癌症和其它疾病。
研究者Garcia表示,这将为我们在生化手段上用分子解剖的方法了解Wnt蛋白开辟了新的路径。研究者Harold Varmus在30年前发现了Wnt蛋白,他们发现Wnt蛋白的基因wnt1在小鼠的乳腺癌细胞中异常活跃。过去的十年里,研究者揭示了Wnt蛋白在胚胎干细胞的发育、组织再生、骨骼发育、干细胞分化以及人类的许多癌症中都扮演着至关重要的角色。Wnt蛋白可以给予细胞身份,并且告诉其该进行什么样的行为。
在人类和无脊椎动物体中,配体受体系统是一个非常重要的系统,Wnt几乎遍布所有系统领域。很多科学家试图去在实验室对该蛋白质进行表达并且研究其结构。2003年,Nusse小组解释了为什么很多科学家分离Wnt蛋白的困难,因为Wnt蛋白包含了很多脂质分子,可以使得蛋白质不溶于水溶液中。科学家意识到必须通过含有洗涤剂的混合剂将蛋白质固定起来,这样才能够更好地研究其生化特征并且分离出Wnt蛋白。但是含有洗涤剂的混合制剂在固定Wnt蛋白上仍然有一定的困难。
研究者Garcia和Janda表示,如果细胞中可以表达出Wnt蛋白,那么其受体也会在相同的细胞中,这样受体就有可能保护Wnt蛋白暴露于脂类中,这样Wnt蛋白就可以溶解在脂质中。基于此,研究者发明了一种技术,他们可以使得Wnt8结合至卷曲受体8上(Frizzled-8)。
使用此项技术,研究者成功地观测到了Wnt蛋白的结构,研究者表示,这就好像螃蟹随着它的两个大钳子向前,然后抓着卷曲受体,而且Wnt蛋白的结构和之前的其它蛋白结构并无关系。然而这样研究者就可以开始进行Wnt蛋白折叠的起源进化研究。研究者后续将继续深入研究Wnt蛋白的结构,他们希望其它的Wnt蛋白和Wnt8具有一定的相似性。如今研究者Garcia正在解决为什么Wnt蛋白如此难表达,他表示,因为Wnt蛋白暴露于脂质中;因此探究者希望对蛋白进行改良,在不影响其功能的情况下解决其表达问题。
Wnt长期以来被认为是潜在的癌症药物靶点,目前有很多药物开发公司正在研发抗Wnt以及抗卷曲受体抗体的药物,但是苦于并不了解Wnt的结构,因此研发一直停滞不前。因此这项研究将帮助药物公司更好地去开发以Wnt为靶点的药物。(生物谷Bioon.com)
编译自:New Molecular Structure Offers First Picture of a Protein Family Vital to Human Health
编译者:T.Shen

doi:10.1126/science.1222879
PMC:
PMID:
Structural Basis of Wnt Recognition by Frizzled
Claudia Y. Janda1,2, Deepa Waghray1,2, Aron M. Levin1,2, Christoph Thomas1,2, K. Christopher Garcia1,2,*
Wnts are lipid-modified morphogens that play critical roles in development principally through engagement of Frizzled receptors. The 3.25 Å structure of Xenopus Wnt8 (XWnt8) in complex with mouse Frizzled-8 cysteine-rich domain (CRD) reveals an unusual two-domain Wnt structure, not obviously related to known protein folds, resembling a “hand” with “thumb” and “index” fingers extended to grasp the Fz8-CRD at two distinct binding sites. One site is dominated by a palmitoleic acid lipid group projecting from Serine 187 at the tip of Wnt’s thumb into a deep groove in the Fz8-CRD. In the second binding site, the conserved tip of Wnt’s "index finger" forms hydrophobic amino acid contacts with a depression on the opposite side of the Fz8-CRD. The conservation of amino acids in both interfaces appears to facilitate ligand-receptor cross-reactivity, which has important implications for understanding Wnt’s functional pleiotropy and for developing Wnt-based drugs for cancer and regenerative medicine.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#解析#
74
#抗癌药物#
82
#抗癌药#
88
#SCIE#
60
#WNT#
86