Cell:驱动癌症的旁路途径
2013-01-09 Cell 互联网 何嫱
结肠癌是美国癌症相关死亡的主要原因之一。这一疾病的风险因子多种多样,包括老年和饮食等因素。科学家们希望找到大多数病例共有的一些至关重要的特征,利用它们来开辟新的治疗。在几乎所有病例中,结肠肿瘤的DNA均发生了与某一关键性的细胞内信号途径相关的突变,从而导致了某些蛋白质累积,驱动细胞失控性生长。 由于在结肠癌和其他癌症中普遍存在Wnt/β-Catenin信号异常,它代表了开发治疗的一个有前景的靶点
结肠癌是美国癌症相关死亡的主要原因之一。这一疾病的风险因子多种多样,包括老年和饮食等因素。科学家们希望找到大多数病例共有的一些至关重要的特征,利用它们来开辟新的治疗。在几乎所有病例中,结肠肿瘤的DNA均发生了与某一关键性的细胞内信号途径相关的突变,从而导致了某些蛋白质累积,驱动细胞失控性生长。
由于在结肠癌和其他癌症中普遍存在Wnt/β-Catenin信号异常,它代表了开发治疗的一个有前景的靶点。然而到目前为止,科学家们还未能成功靶向这一信号通路。Broad研究所研究员、Dana–Farber癌症研究所和哈佛大学医学院副教授William Hahn认为其原因在于研究人员将自己“困在了只有一个出口的房间里”。科学家们过去认为β-Catenin只有一个伙伴蛋白(partner protein)即转录因子TCF4,β-Catenin通过TCF4来发挥作用触发及驱动癌症。没有办法靶向TCF4,它就好像通往潜在新治疗的一扇仍然紧锁的门。
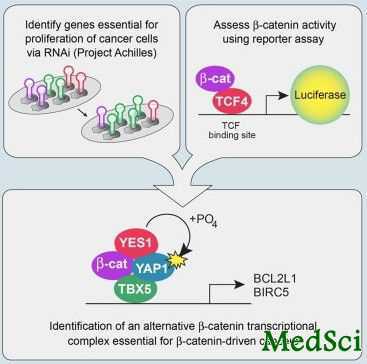
在Broad研究所和Dana-Farber癌症研究所研究人员雄心勃勃的努力下,现在一扇新门有可能被开启。借助于Broad研究所的大规模RNA干扰及细胞系资源,Hahn领导研究小组揭示了β-Catenin驱动癌症的一条替代途径,其可能更适合于靶向治疗。这些发表在12月13日《细胞》(Cell)杂志上的研究发现,揭示了β-Catenin蛋白的扩展作用,表明它们有可能在细胞中不止具有一条通路,在癌症中不止发挥一种作用。
渴望新的治疗靶点,以及深入了解细胞中β-Catenin作用机制的需求,均成为开展这项新研究的动力。近期的基因组测序研究揭示:β-Catenin的传统伙伴蛋白TCF4确实在超过四分之一的结肠癌病例中存在缺失或失活。缺乏这一关键的伙伴表明β-Catenin具有其他的伙伴蛋白,它通过潜藏的信号通路发挥作用来引起癌症。
为了寻找新的信号通路,研究小组开始找寻了由β-Catenin驱动的、对癌症生存至关重要的基因,指出细胞中β-Catenin的潜在伙伴。他们根据β-Catenin的激活情况首次将来自Broad-Novartis癌细胞系百科全书的85种细胞系进行了分类。同时,他们分析了来自一项RNA干扰筛查的这些细胞系的数据。这项筛查是癌症项目阿基里斯计划(Cancer Program's Project Achilles)的一部分,该计划旨在发现对于癌细胞生存至关重要的基因,即所谓的癌症“阿基里斯之踵”。
研究结果指向了调控YAP1蛋白的基因,YAP1可以控制其他基因的活性。通过在细胞和动物模型中开展广泛的追踪研究,研究人员发现一种新蛋白质复合物与β-Catenin协同作用,调控了癌症驱动基因的转录。进一步,他们发现新复合物受到YES1的调控。YES1是一个蛋白质激酶家族中的成员,研究证实相比于转录因子这一蛋白激酶家族更适合于靶向治疗。研究小组甚至能够用一种小分子来抑制YES1,阻断这一复合物的活性,阻止癌细胞生长。
“这是有一点让人感到惊讶的发现,因为大多数人都认为β-Catenin只有一个伙伴,那就是TCF4,TCF4负责了它在癌症中的所有作用,” Hahn说。新研究结果帮助解释了在没有起作用的TCF4蛋白的情况下,癌细胞是如何仍然能够癌变的。“发现β-Catenin可能具有另一组伙伴,有助于解释这些研究结果,它或许能够让我们了解在肿瘤形成的不同阶段这些复合物发挥不同作用的机制。
这些研究结果揭示了Wnt/β-Catenin信号一个新的分支,其有可能在发育和癌症中起重要作用。如果开发出一种安全有效的靶向治疗,通过YES1激酶靶向这一信号或许能够成功阻止很大一部分患者的肿瘤生长。研究小组当前正在开展进一步的研究,寻找获得FDA批准的用于治疗其他疾病以及靶向YES1的现有药物。找到一条途径来靶向这一信号有可能对这一疾病的治疗产生重大的影响,因为它在相当大比例的病例中发生了改变。如Rosenbluh所说的:“找到一条途径来靶向β-Catenin,将使得我们能够靶向所有的结肠癌。”

DOI:10.1016/j.cell.2012.11.026
PMC:
PMID:
β-Catenin-Driven Cancers Require a YAP1 Transcriptional Complex for Survival and Tumorigenesis
Joseph Rosenbluh1, 3, 5, Deepak Nijhawan1, 3, 5, Andrew G. Cox3, 4, 6, Xingnan Li7, James T. Neal7, Eric J. Schafer1, 3, 5, Travis I. Zack2, 5, 8, Xiaoxing Wang1, 3, 5, Aviad Tsherniak5, Anna C. Schinzel1, 3, 5, Diane D. Shao1, 3, 5, Steven E. Schumacher2, 5, Barbara A. Weir1, 5, Francisca Vazquez1, 5, Glenn S. Cowley5, David E. Root5, Jill P. Mesirov5, Rameen Beroukhim2, 3, 5, Calvin J. Kuo7, Wolfram Goessling1, 3, 4, 6, William C. Hahn1, 2, 3, 5, ,
Wnt/β-catenin signaling plays a key role in the pathogenesis of colon and other cancers; emerging evidence indicates that oncogenic β-catenin regulates several biological processes essential for cancer initiation and progression. To decipher the role of β-catenin in transformation, we classified β-catenin activity in 85 cancer cell lines in which we performed genome-scale loss-of-function screens and found that β-catenin active cancers are dependent on a signaling pathway involving the transcriptional regulator YAP1. Specifically, we found that YAP1 and the transcription factor TBX5 form a complex with β-catenin. Phosphorylation of YAP1 by the tyrosine kinase YES1 leads to localization of this complex to the promoters of antiapoptotic genes, including BCL2L1 and BIRC5. A small-molecule inhibitor of YES1 impeded the proliferation of β-catenin-dependent cancers in both cell lines and animal models. These observations define a β-catenin-YAP1-TBX5 complex essential to the transformation and survival of β-catenin-driven cancers.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#CEL#
39
#Cell#
43