FDA批准弗里德里希共济失调新药omaveloxolone上市
2023-03-13 MedSci原创 MedSci原创 发表于上海
2月28日宣布,美国食品药品监督管理局(FDA)已批准其药物SKYCLARYS(omaveloxolone),用于治疗成人和16岁及以上青少年弗里德里希共济失调(Friedreich共济失调)。该公司
2月28日宣布,美国食品药品监督管理局(FDA)已批准其药物SKYCLARYS(omaveloxolone),用于治疗成人和16岁及以上青少年弗里德里希共济失调(Friedreich's Ataxia)。该公司表示,Skyclarys是第一种也是唯一一种适用于弗里德里希共济失调患者的药物。该药物已获得美国FDA的孤儿药、快速通道和罕见儿科疾病称号,以及欧洲委员会(EC)的孤儿药称号。此外,欧洲药品管理局(EMA)目前正在审查该药物的上市授权申请。
Reata旨在通过恢复线粒体功能来治疗弗里德里希共济失调。其药物omaveloxolone是一种靶向并激活一种转录因子Nrf2的小分子,该公司表示它在缓解炎症中起关键作用。omaveloxolone旨在稳定Nrf2并增加其活性。
FDA对SKYCLARYS的批准基于关键、安慰剂对照、双盲2期MOXIe研究(研究1;NCT02255435),以及非盲MOXIe延展研究的事后倾向匹配分析的疗效和安全性数据。
研究1招募了103名弗里德里希共济失调患者,他们接受安慰剂(52名)或Skyclarys 150毫克(51名)48周。在研究参与者中,53%为男性,97%为白人,研究开始时的平均年龄为24岁。9名(18%)患者年龄小于18岁。
主要终点是评估第48周时与安慰剂相比,改良弗里德里希共济失调评定量表(mFARS)评分的变化。mFARS是一种衡量疾病进展的临床评估,即吞咽和言语(延髓)、上肢协调性、下肢协调性和直立稳定性。
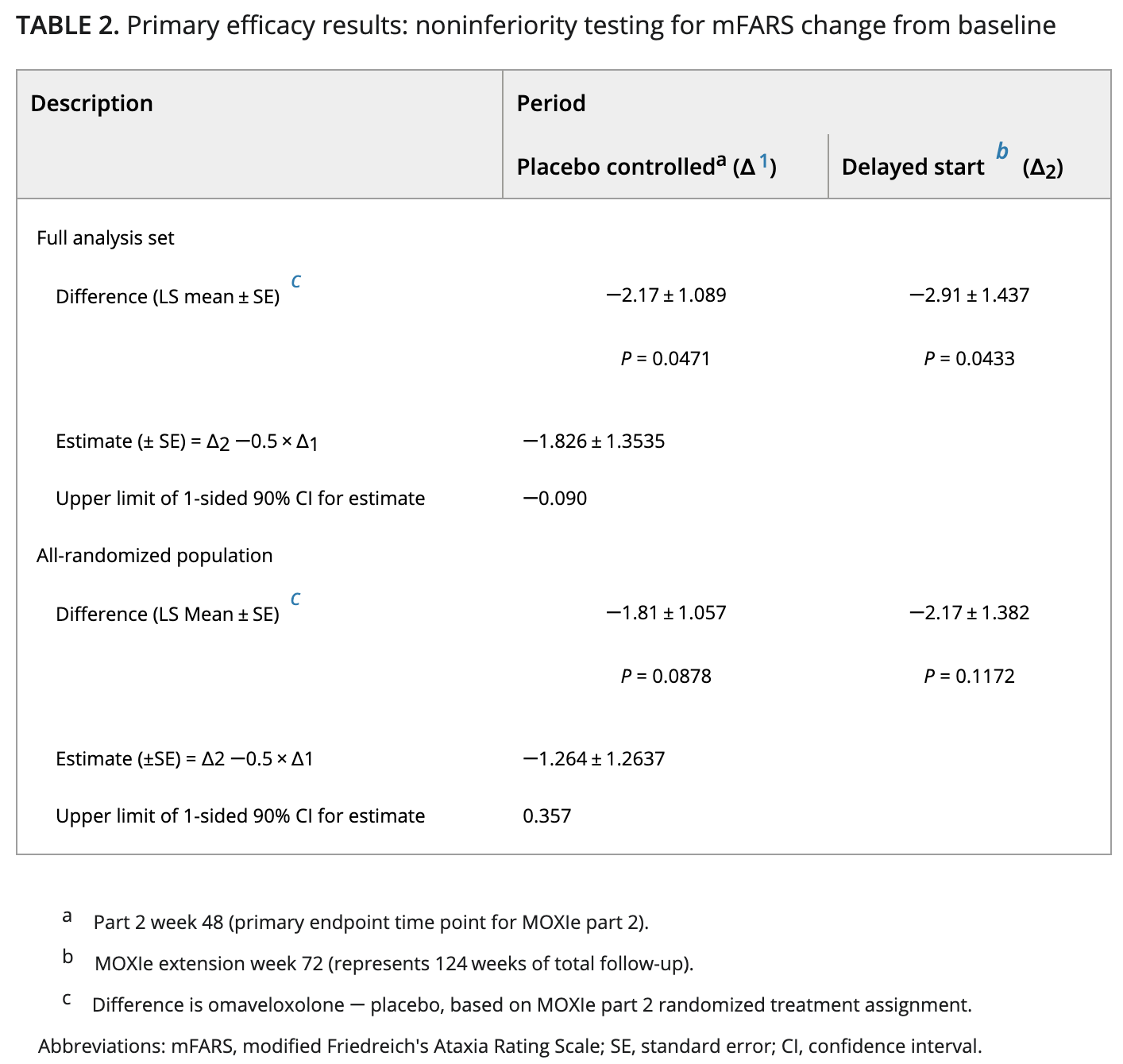
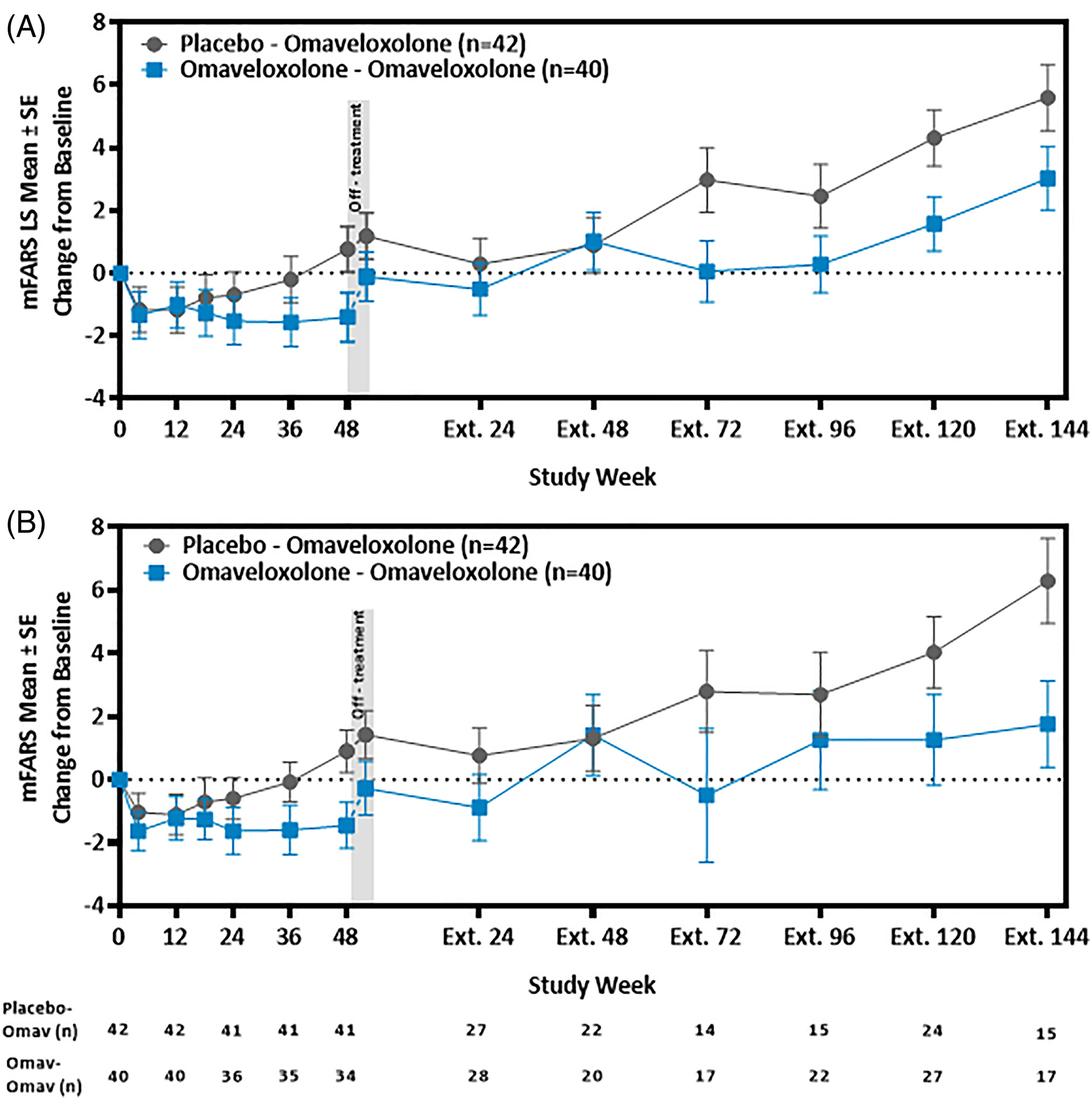
Reata报告的结果显示,与初始测量相比,评分平均有统计学意义的显着改善,而安慰剂组患者的评分则有所下降。
此外,对继续参加非盲研究长达三年的患者数据进行的事后分析显示,与未接受治疗患者的自然病史相比,mFARS评分更好。
临床试验中,常见的不良反应包括肝酶升高,这可能是药物毒性的信号。报告的其他副作用有头痛、恶心、腹痛、疲劳、腹泻和肌肉疼痛。该药物的标签上没有黑框警告,但它建议临床医生在开始治疗患者之前获取肝酶水平,并在治疗期间监测这些水平。
Skyclarys的批准附带有上市后要求。Reata制药必须进行额外的检测,以评估对心脏的风险以及潜在的药物相互作用。该公司还必须进行哺乳研究,以评估对母乳的影响,尽管Skyclarys的标签上注明,没有数据表明母乳中存在该药物或其成分。此外,该公司表示将进行一项长期的真实世界研究,以进一步评估Skyclarys的安全性。
什么是弗里德里希共济失调?
弗里德里希共济失调是一种极其罕见的神经肌肉疾病,比杜氏肌营养不良症或脊髓性肌萎缩症更罕见,是一种遗传性疾病,由编码共济蛋白(frataxin蛋白)的FXN基因突变引起。
这种蛋白质对线粒体的功能很重要,线粒体是细胞的能量来源。弗里德里希共济失调主要影响神经系统,低共济蛋白水平会导致脊髓和周围神经中的神经纤维变性。症状可能包括平衡和协调问题、肌肉无力以及手臂和腿部感觉丧失。
该疾病发作通常发生在儿童期或青春期,但在极少数情况下,症状可能要到成年才出现。患者患心肌病的风险增加,心肌病是一种心肌变弱和扩大的疾病。患者还可能出现视力和听力问题、脊柱侧凸和糖尿病。
这种疾病以常染色体隐性方式遗传,意味着一个人必须继承2个突变基因拷贝,每个父母各1个,才能患上该疾病。建议受弗里德里希共济失调影响的家庭进行遗传咨询,以了解该病的遗传模式。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






