Mol Cancer:四川大学朱玲玲/周清华/罗凤鸣合作发表microRNA在胃癌肿瘤微环境中的作用的综述
2024-08-30 iNature iNature 发表于上海
该综述旨在通过总结微小RNA(miRNA)调节肿瘤微环境(TME)的过程并强调其在TME中的关键作用,为改善GC患者的预后提供新的见解。
胃癌(GC)是最致命的恶性肿瘤之一,其发病机制不明。由于其治疗耐药性、高复发率以及缺乏可靠的早期检测技术,大多数患者预后不良。因此,确定新的肿瘤生物标志物和治疗靶点至关重要。
2024年8月20日,四川大学朱玲玲、周清华、罗凤鸣共同通讯在Molecular cancer 在线发表题为“The role of microRNAs in the gastric cancer tumor microenvironment”的综述文章。该综述旨在通过总结微小RNA(miRNA)调节肿瘤微环境(TME)的过程并强调其在TME中的关键作用,为改善GC患者的预后提供新的见解。
通过关注GCTME内肿瘤细胞、细胞外基质、血管、癌症相关成纤维细胞和免疫细胞之间的相互作用进行了全面的文献综述。特别研究了非编码RNA(称为miRNA)在通过各种信号通路、细胞因子、生长因子和外泌体调节TME中的作用。GC中的肿瘤形成、转移和治疗受到TME内相互作用的显着影响。miRNA通过多种信号通路、细胞因子、生长因子和外泌体调节这些相互作用,从而调节肿瘤进展。miRNA失调会影响关键细胞过程,如细胞增殖、分化、血管生成、转移和治疗耐药性,从而导致GC的发病机制。miRNA在调节GCTME方面发挥着至关重要的作用,影响肿瘤进展和患者预后。通过了解miRNA控制TME的机制,可以确定潜在的生物标志物和治疗靶点,以改善GC患者的预后。

胃癌(GC)是全球第四大癌症死亡原因,也是全球第五大患病疾病。由于通常没有早期准确的诊断方法或特定的临床症状,该疾病通常在晚期转移时才被诊断出来。因此,GC的5年生存率仅为32%左右。在实体瘤发展过程中会出现明显的结缔组织增生过程,包括在GC中观察到的增生过程。该过程与免疫细胞以及肿瘤微环境(TME)中的其他类型的间充质基质细胞密切相关。TME包括成纤维细胞、细胞外基质(ECM)、血管、内皮细胞、免疫细胞和非细胞元素,如细胞因子和外泌体。
因此,TME在癌症进展中起着重要作用(图1)。在此背景下,肿瘤细胞所处的内外部环境对肿瘤的发生、发展和转移有相当大的影响,它们既相互依赖又相互竞争。TME中的生长因子增强了肿瘤细胞的活力,减少了化疗药物的摄取或使其失活。此外,TME还产生免疫抑制因子,从而促进对免疫治疗的抵抗。因此,了解GCTME是如何调控的,并将这些见解应用于临床治疗,对于改善GC患者的不良预后至关重要。
1993年,Ambros等人在线虫中发现了第一个微小RNA(miRNA)。这一发现揭示了非编码基因组中的一个重要部分,它在转录后基因调控中起着关键作用。miRNA失调已在多种人类疾病中得到证实,包括心脏病、糖尿病、癌症和精神分裂症。癌症中miRNA表达水平的失调与人类癌症发展的一系列生物学特征有关,包括在增强肿瘤细胞增殖、凋亡、迁移、上皮-间质转化(EMT)、转移、血管生成、自噬以及恶性细胞与TME之间的相互作用方面发挥重要作用。正常细胞中的miRNA表达谱与癌症组织中的表达谱非常不同,并且可以根据特定miRNA的表达来识别不同的肿瘤类型和阶段,包括肿瘤发展、进展和转移。miRNA表达的调节与致癌miRNA的抑制和肿瘤抑制miRNA的替代有关。因此,miRNA是癌症研究的一个特别重要的领域,与癌症预后、发病机制、诊断和治疗有关,被认为是改善癌症治疗的完美工具。
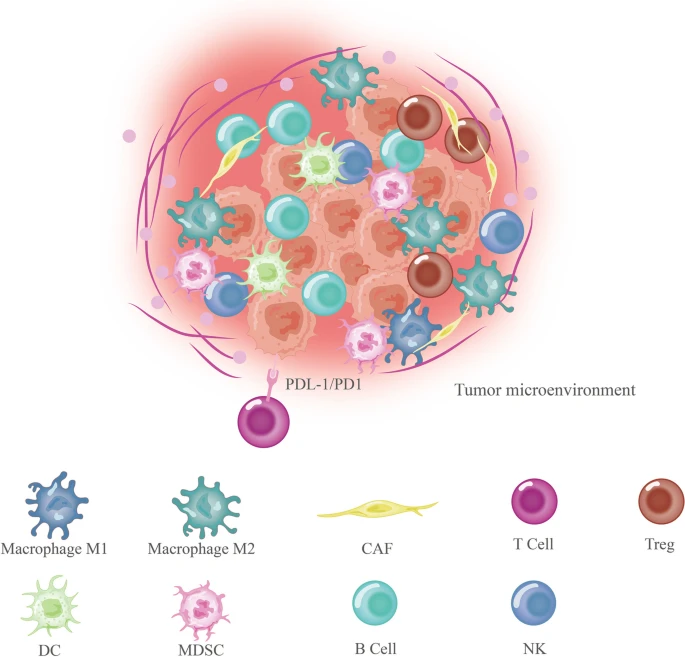
胃癌中的TME组成(图源自Molecular cancer )
失调的miRNA促进癌症相关成纤维细胞(CAF)活化、抑制髓系抑制细胞(MDSC)、抑制T细胞分化并促进血管生成,最终重塑TME。特别是,肿瘤细胞衍生的miRNA与免疫抑制性TME的产生、效应细胞的丧失和肿瘤免疫原性的降低密切相关;此外,它们是癌症免疫结果的关键决定因素。此外,癌细胞会分泌含有肿瘤抑制miRNA的外泌体,这些外泌体将改变的miRNA组传播到TME内的不同细胞区室。miRNA可能是免疫介导的肿瘤清除的关键,因为miRNA可以微妙地抑制基因并优先抑制剂量敏感的靶点。
最近,miRNA被认为是胃病理学的重要潜在生物标志物,因为它们在胃组织中的癌前病变(如幽门螺杆菌感染、慢性胃炎、萎缩性胃炎和肠上皮化生)以及早期发育不良和侵袭性癌症中经常失调。同时,越来越多的证据表明miRNA可以被视为新的生物标志物;值得注意的是,许多研究人员已经分析了GC血清和组织样本中的miRNA谱,以评估其预后和诊断潜力(表1)。如前所述,miRNA调节间充质相互作用、免疫侵袭和肿瘤血管生成,导致GC的恶性表型,如肿瘤生长、转移、血管生成和耐药性。GC细胞释放富含miR-1290的细胞外囊泡(EV)。该miRNA通过靶向grainyhead-like 2并激活锌指E-box结合同源框1/程序性细胞死亡配体1(PD-L1)轴,增强GC细胞对T细胞活化的抑制作用,促进GC细胞免疫逃逸。耐药性是GC治疗面临的主要挑战之一,而操纵miRNA表达已被证明可以缓解这一治疗障碍。因此,与现有疗法相比,以miRNA为靶向的GC疗法具有增强免疫疗法的巨大潜力。对GC中microRNA的研究已进入临床环境。
因此,全面了解miRNA在胃癌TME中促进的生物学机制可能为未来鉴定抗肿瘤药物和推进靶向癌症治疗提供宝贵的视角。本综述强调了miRNA在TME中发挥的关键作用,并重点介绍了miRNA对TME的控制如何影响胃癌的发展。加深对这些过程的了解可能有助于开发新的胃癌患者治疗方法,并鉴定新的生物标志物,从而改善胃癌患者的管理和随访策略。
参考消息:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02084-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













前沿知识学习了
67
科学合理,实用
72
#胃癌# #microRNA# #肿瘤微环境#
97