Cell Reports:禁食再上神坛!剑桥大学最新研究:与其研究抗炎饮食,不如直接禁食!揭秘禁食抗炎新机制
2024-05-09 梅斯学术 MedSci原创 发表于上海
该研究揭开了“禁食有助于预防炎症”的机制——禁食能够提高血液中的花生四烯酸的水平,而花生四烯酸则可以降低NLRP3炎症小体的活性,从而抑制炎症。
高热量饮食常与慢性代谢性炎症综合征有关,这是许多非传染性疾病(例如心脏病、肥胖和二型糖尿病)的共同基础。而IL-1β水平升高、NLRP3炎性体活性和全身炎症等等,则是慢性代谢性炎症综合征的特征,但其机理基础尚不清楚。
有研究发现,炎症小体与脂质代谢有一定关联。为了搞清其中关系,剑桥大学的研究人员在Cell子刊Cell Reports上发表了研究成果,揭开了“禁食有助于预防炎症”的机制——禁食能够提高血液中的花生四烯酸的水平,而花生四烯酸则可以降低NLRP3炎症小体的活性,从而抑制炎症。

一、研究内容与思路
1、在禁食后,参与者体内花生四烯酸水平升高
作者采集了参与者三个过程的血清样本,分别是禁食前进食、禁食24h后以及禁食后补充进食3h后。
结果发现,这些志愿者的外周血单核细胞(PBMC)中,禁食后补充进食3h后IL-1β水平升高,而花生四烯酸(AA)水平在禁食过程中升高,但在禁食后补充进食3h后降低。
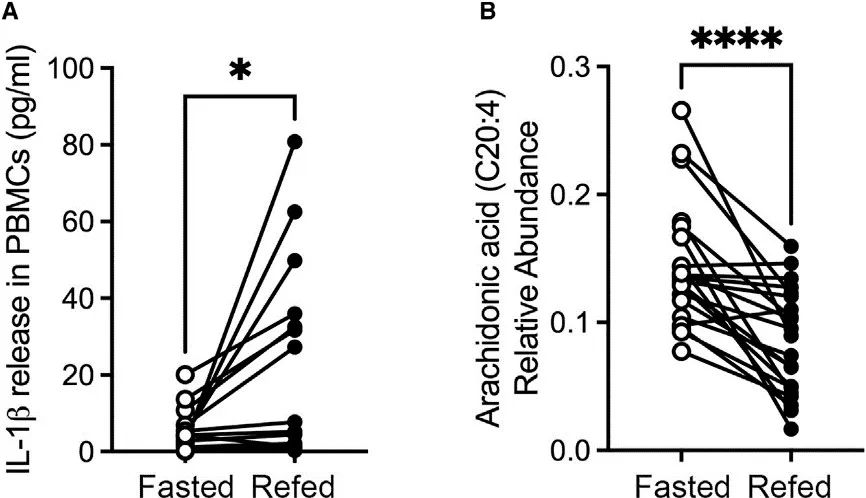
研究思路1:高热量饮食会导致慢性代谢性炎症综合征发生,对此产生疑问:进食前后、禁食过程中,炎症指标和脂质代谢会发生什么变化呢,并基于此开展了研究。结果发现,禁食会降低NLRP3炎症小体相关因子IL-1β的产生,但在此过程中AA表达会升高。
2、NLRP3炎症小体激活导致花生四烯酸产生
接下来,研究了AA及其类花生酸代谢物在巨噬细胞中对炎症小体NLRP3生成的影响。野生型(WT)和NLRP3沉默骨髓来源的巨噬细胞(BMDM)用LPS预处理,并用NLRP3激活剂尼日利亚菌素刺激,结果发现只有用尼日利亚菌素处理的WT BMDM中出现IL-1β的产生。
进一步发现一系列环氧代谢物(COX),包括PGD2和11-羟基二十碳四烯酸(11-HETE),在NLRP3激活后更为普遍。定量分析发现,在NLRP3刺激下,这些COX代谢物显著增加,包括PGF2α、PGE2、PGD2、8isoPGF2α、11-HETE、15-HETE和AA。
这些结果表明,NLRP3炎症小体激活与脂质代谢的改变之间存在重要联系,特别是在AA和各种环氧代谢物的产生方面。
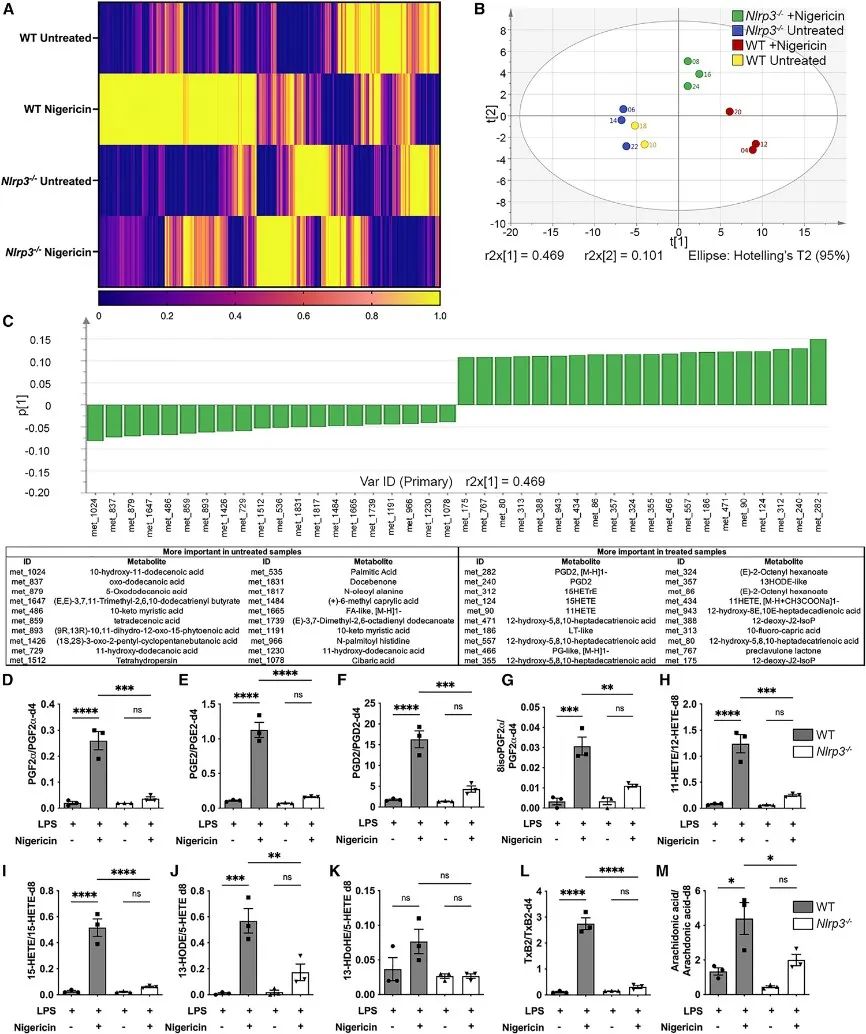
研究思路2:在禁食人群中,AA的生成量增加,同时IL-1β的生成量受到抑制。那么,AA与NLRP3之间存在着什么联系?
3、花生四烯酸抑制NLRP3炎症小体
研究者比较了AA和一些类二十酸对NLRP3活化的影响后发现,无论是在LPS预处理加尼日利亚菌素刺激,还是单纯的尼日利亚菌素刺激的BMDM中,AA的存在均抑制了NLRP3诱导的IL-1β的产生,且不影响细胞死亡。
此外,作者还采用了另一种细胞“人类THP-1单核细胞/巨噬细胞”来进行验证。结果发现,AA抑制了用尼日利亚菌素或棕榈酸(PA)激活NLRP3时的IL-1β分泌、炎症适配蛋白ASC斑点形成和细胞死亡,尤其是当PA作为NLRP3触发因子时更为明显。这表明,AA在调节脂质驱动的炎症中可能起着重要作用。
然后,探讨了AA代谢产物与NLRP3炎症小体产生的关系。实验发现,在LPS预处理加尼日利亚菌素刺激,还是单纯的尼日利亚菌素刺激的WT和NLRP3沉默 BMDM中,单独的环氧代谢物如PGE2、PGF2α及其类似物均未诱导炎症小体激活或IL-1β产生。
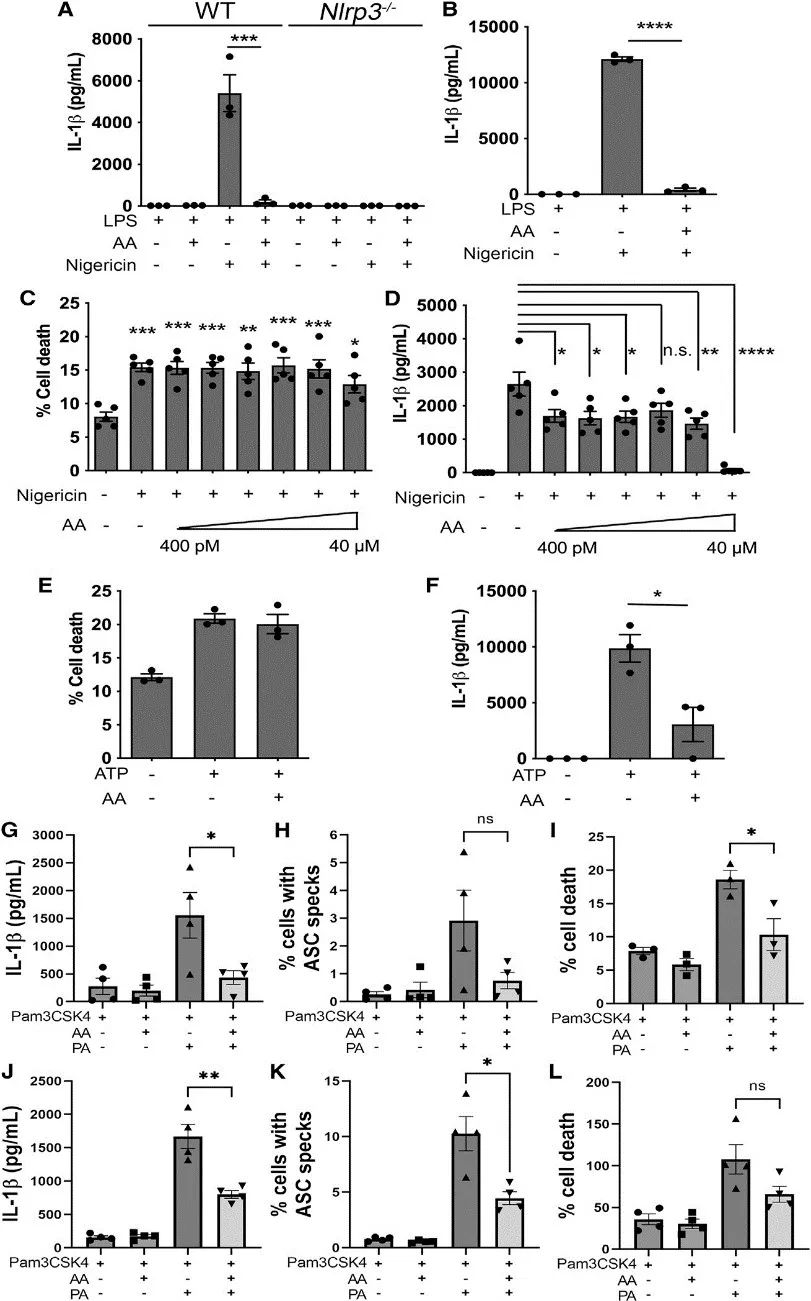
研究思路3:继续探讨AA及其环氧代谢物与NLRP3之间的关系,探明AA对NLRP3炎症小体的影响。
4、环氧合酶(COX)调节NLRP3但不调节NLRC4
AA需要COX来进行代谢,而非甾体抗炎药(NSAID)可以抑制COX活性。对此,作者探讨了NSAID通过COX对AA代谢的抑制对NLRP3炎症小体的影响。脂质分析发现,COX-2抑制剂塞来昔布减少了BMDM对尼日利亚菌素刺激反应中的环氧代谢物(如PGF2α、PGE2、PGD2、11-HETE、15-HETE、TxB2)的产生,但对AA的释放没有影响。
进一步,作者给予LPS预处理的野生型(WT)和Nlrp3沉默BMDM COX抑制剂处理以及尼日利亚菌素刺激。结果发现,COX抑制剂本身并未诱导NLRP3炎症小体活性,但与NLRP3刺激剂尼日利亚菌素共存时,COX抑制剂显著抑制了IL-1β和IL-18的产生,说明COX抑制剂可以抑制NLRP3。
此外,作者还评估了COX抑制对NLRC4炎症小体的影响,发现COX抑制阻断了PGE2的产生,但它并没有影响NLRC4炎症小体活性。
综上所述,COX抑制剂主要通过AA的作用抑制NLRP3诱导的炎症小体活性,而不影响NLRC4炎症小体活性。
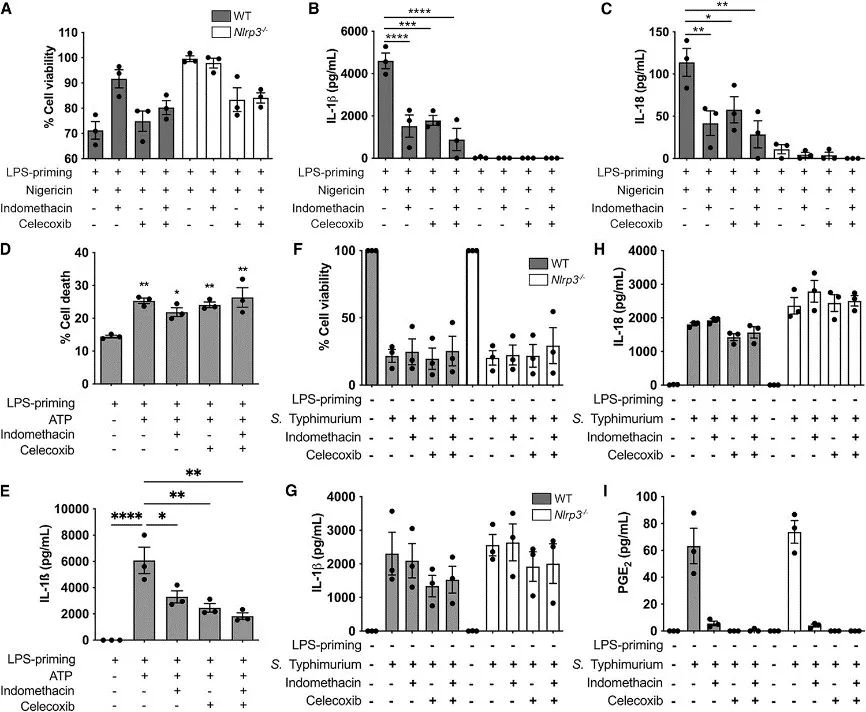
研究思路4:明确了AA抑制NLRP3后,进一步探讨AA如何发挥抑制作用。因AA代谢需要COX参与,而NSAID可以抑制COX活性,于是,作者探讨了COX抑制剂在AA及NLRP3过程中所发挥的作用,验证了抑制COX活性抑制NLRP3的表达,侧面证实AA是通过COX来发挥作用的。
5、花生四烯酸抑制PLC活性并抑制下游蛋白激酶(PK)
NLRP3受翻译后修饰(PTM)的高度调控,包括磷酸化和泛素化等。PLC活性可通过JNK1诱导的磷酸化调控NLRP3 PTM。对此,作者探讨了PLA2和PLC在NLRP3激活中的作用。实验发现,PLA2抑制剂对NLRP3诱导的IL-1β产生没有影响,表明PLA2没有参与调节NLRP3对尼日利亚菌素的活化。然而,使用U-73122抑制磷脂酶C(PLC)导致IL-1β产生呈剂量依赖性减少,表明PLC参与了NLRP3激活,紧接着又证明了AA可能通过产物抑制减少了尼日利亚菌素刺激下的PLC活性。
已有研究发现,PLC可刺激PKC、PKD和JNK1等PK的活化,进而上调NLRP3的活化。对此,作者发现AA抑制了这些蛋白激酶(PKC、PKD、JNK)的激活。此外,研究还比较了AA与胆酸(LCA)的效果,LCA是一种已知能抑制NLRP3炎症小体激活的胆汁盐。虽然LCA没有影响激酶的磷酸化,但AA却有,这表明它们的机制不同。
这些发现表明,AA通过可能涉及抑制PLC活性和随后的下游激酶激活的负反馈循环,对NLRP3产生影响。
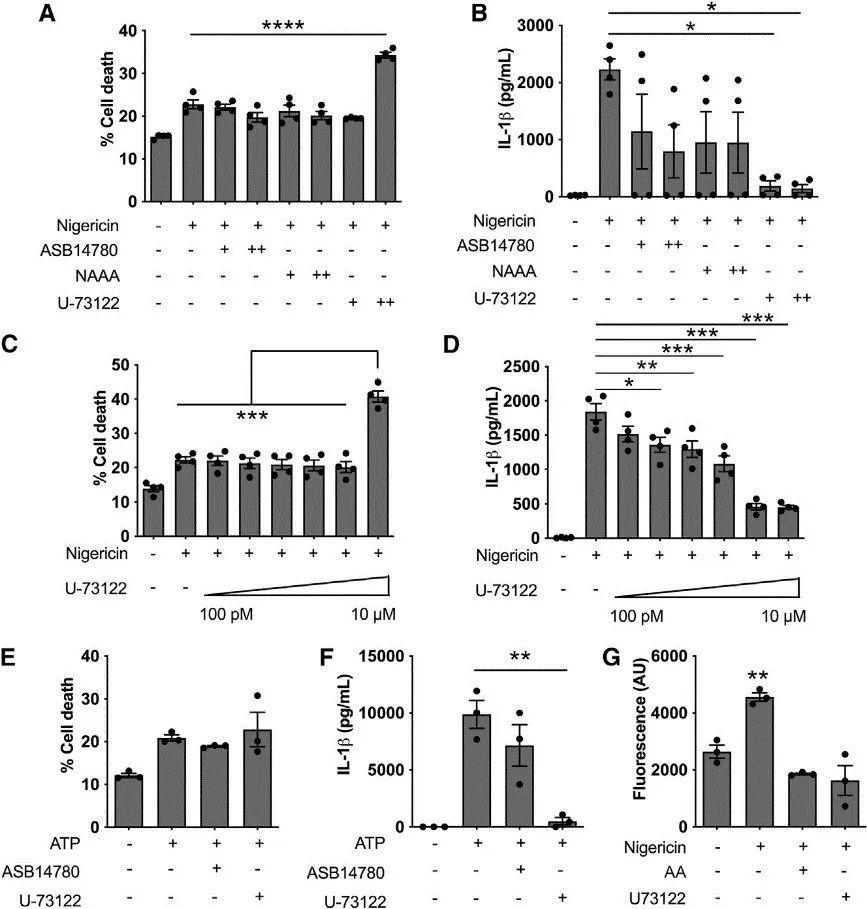
研究思路5:AA通过COX影响NLRP3,而NLRP3又受到PTM调控,那AA与PTM之间是否存在负反馈调节的作用?对此,作者假设AA或COX抑制剂的存在可能会触发由PLC的经典产物抑制驱动的负反馈回路,从而调节NLRP3,并开展验证。
二、小结
综上所述,首先,作者发现,在禁食人群中AA升高且IL-1β减少,而这一效应在进食后被逆转。虽然这一研究没有直接的体内证据表明AA可以直接抑制IL-1β生成,但是作者采用不同的细胞系证,AA本身能够抑制NLRP3炎症小体的激活,而非其代谢物。此外,COX抑制剂还可以起到与AA类似的作用,更进一步表明NLRP3抑制作用来源于AA。最后,验证了AA是如何来影响NLRP3的,使得整个体外实验完整。
虽未开展体内实验,仅采用两种细胞系进行验证,且所有数据多以柱状图形式展现,最终发表cell子刊,其研究创新性值得肯定。
参考文献:
[1] Pereira, M., Liang, J., Edwards-Hicks, J., Meadows, A. M., Hinz, C., Liggi, S., Hepprich, M., Mudry, J. M., Han, K., Griffin, J. L., Fraser, I., Sack, M. N., Hess, C., & Bryant, C. E. (2024). Arachidonic acid inhibition of the NLRP3 inflammasome is a mechanism to explain the anti-inflammatory effects of fasting. Cell reports, 43(2), 113700.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#禁食# #NLRP3炎症小体# #花生四烯酸#
42