Eur Heart J:CAR-T后的严重心血管事件影响生存结局(IF=35.855)
2023-03-24 聊聊血液 网络 发表于上海
CD19 CAR-T 后的严重心血管事件(心力衰竭、心源性休克和心梗)不仅独立增加总死亡率的风险,而且也独立增加 NRM 的风险。
CAR-T细胞疗法在复发性或难治性淋巴瘤和白血病患者中具有令人鼓舞的结局,可诱导持久的完全缓解,部分患者的重编程 T 淋巴细胞甚至在十年后仍持续存在。预计到2024年CAR-T的使用有望增加一倍,部分原因是其应用扩展到其他癌症亚型和进入早期治疗线。
CAR-T的主要安全性问题包括CRS和ICANS,而最近的研究表明,高达1/4的CAR-T治疗患者会发生心血管 (CV) 事件,包括心肌病 (10%)、临床心力衰竭 (6%) 和心肌梗死 (MI)(5%),然而目前尚不清楚 CV 事件的发生是否会影响接受 CAR-T 患者的死亡率。了解 CV 事件与死亡率之间的相关性对于进一步推进 CAR-T 患者的 CV 监测指南非常重要,且预防和早期治疗心脏毒性也可进一步改善患者的生存结局。
纪念斯隆-凯特琳癌症中心Syed S. Mahmood教授牵头开展了一项纳入202例 CAR-T 患者的多中心登记研究,以确定严重 CV 事件 (SCE) 的发生率,并评估这些事件是否与死亡率增加相关。结果发现,CAR-T输注后的SCE确实与整体死亡和非复发死亡(NRM)相关,并且SCE与IL-6、CRP、铁蛋白和肌钙蛋白高峰值相关。文章近日发表于欧洲心脏病学会的官方期刊《European Heart Journal》(IF= 35.855)。
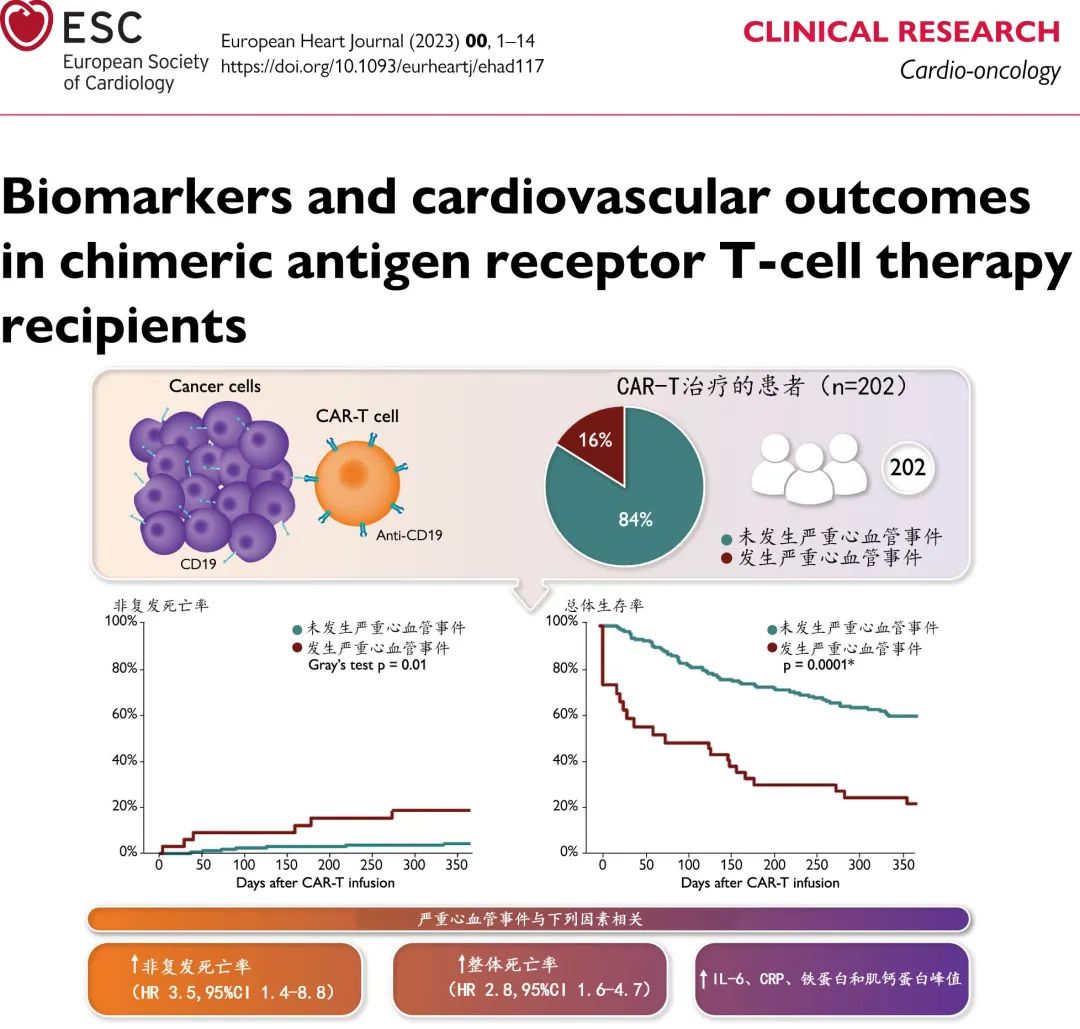

该研究是在纪念斯隆-凯特琳癌症中心、芝加哥大学、加州大学洛杉矶分校和马萨诸塞州总医院开展的多中心队列登记研究,纳入2010年2月至2021年2月期间接受治疗的CD19靶向CAR-T的连续成人患者,回顾性分析纳入了接受市售 CAR-T 的患者和入组两项临床试验的患者。
严重 CV 事件定义为临床心力衰竭、心源性休克和心肌梗死 (MI)的复合终点。临床心力衰竭定义为利钠肽高于正常值上限(ULN)、左心室射血分数 (LVEF) < 53%或利钠肽升高或LVEF < 53%,并满足以下4个标准中的至少1个:(i) 心力衰竭症状(呼吸短促,劳力性呼吸困难、端坐呼吸和夜间阵发性呼吸困难),(ii) 符合心力衰竭的体格检查结果(肺部啰音、颈静脉扩张和下肢水肿),(iii) 符合心力衰竭的影像学结果(肺水肿、胸腔积液和心脏肥大), (iv) 开始心力衰竭的新治疗 [利尿剂(不包括氢氯噻嗪)、正性肌力药或机械支持]。对于符合临床心力衰竭标准的患者,心源性休克定义为需要米力农、多巴酚丁胺、肾上腺素或去甲肾上腺素治疗的低血压,合并器官灌注受损体征,如混合静脉血氧或中心静脉血氧减少或乳酸升高 (≥2 mmol/L),排除其他原因后,肝功能检查(≥1.5倍ULN)或血清肌酐(≥2倍基线或需要肾脏替代治疗)。通过每个机构肌钙蛋白升高>正常范围的第99百分位数以及缺血性 ECG 变化或心肌缺血症状的临床证据(胸部、上肢、下颌或上腹部不适)或缺血等效物(如呼吸困难或疲乏)确定心肌梗死。研究第一部分将 SCE 作为结局变量来描述发生 SCE 的患者,其余部分将 SCE 作为预测变量来确定与死亡率的相关性。
总死亡定义为从 CAR-T 输注至全因死亡,死亡进一步分类为:(i) 非复发死亡 (NRM),定义为 CAR-T 输注后无复发或进展的死亡,(ii) 癌症复发或进展后发生的死亡。对于NRM,癌症复发/进展被视为竞争风险,而删失在末次随访时存活且之前从未发生复发/进展的任何患者。NRM 患者分为以下原因:(i) 感染(如果没有其他主要原因可归因),(ii)CAR-T 相关非心脏毒性(即重度 CRS 或免疫效应细胞相关神经毒性综合征,未发现其他原因),(iii)CV死亡(即心源性休克、心力衰竭或 MI 导致的死亡,如果未发现其他死亡原因),或 (iv) 其他原因(如果上述类别均不匹配)。

基线特征
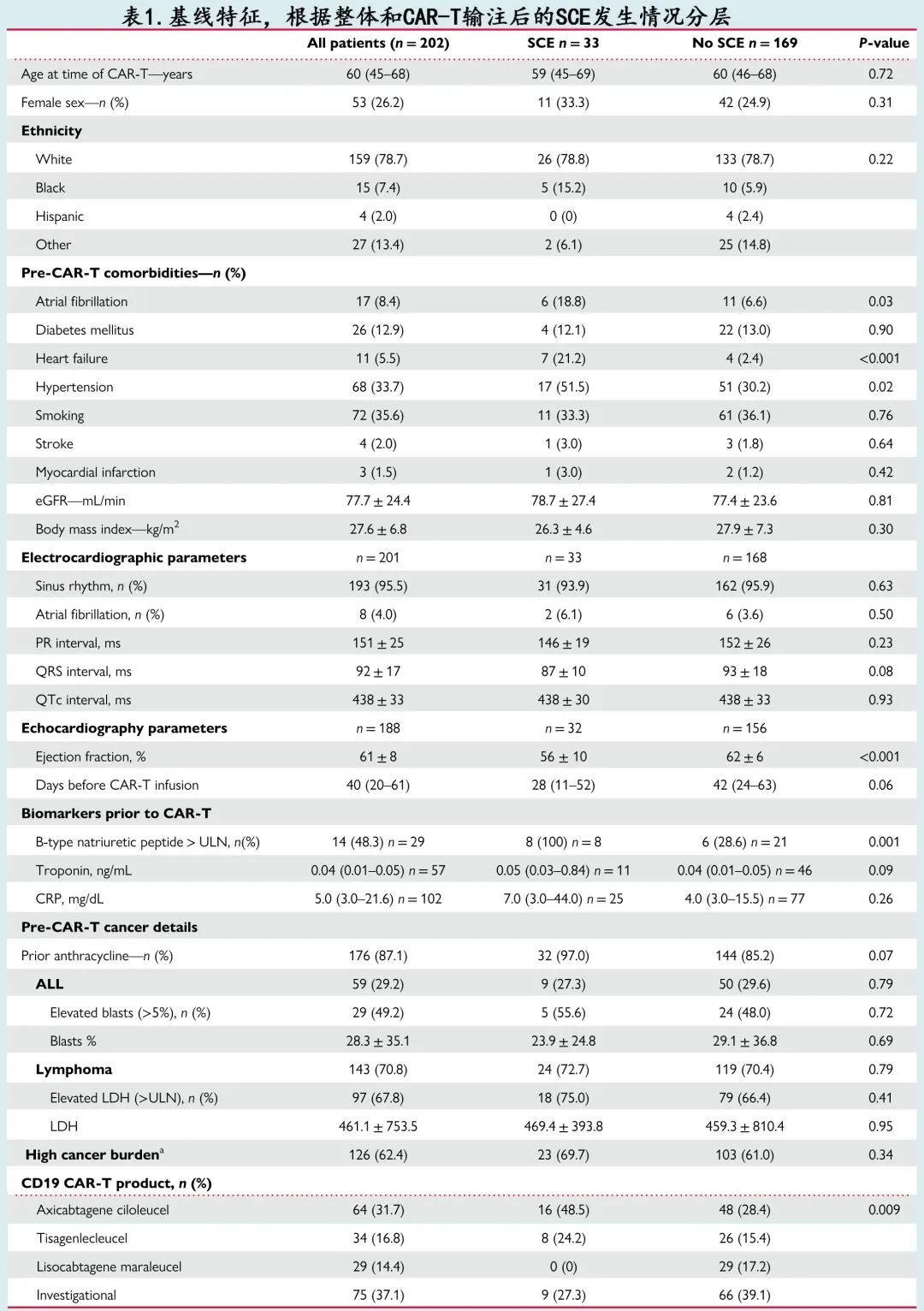
202例 CAR-T 受者的中位年龄为 60岁,26%为女性,79%为白人,7%为非裔美国人(表1)。有吸烟史占36%,高血压史占34%,糖尿病史占13%,原有房颤史占8%,1.5%的患者有MI史,2%的患者有卒中史,5.5%的患者有心力衰竭史。CAR-T细胞治疗适应症包括 B 细胞淋巴瘤 (71%) 和急性淋巴细胞白血病 (ALL,29%)。37%的患者使用试验性CD19 CAR-T,其次是axicabtagene ciloleucel (32%)、tisagenlecleucel (17%) 和lisocabtagene maraleucel (14%)。大多数患者 (87%) 既往接受过蒽环类药物基础的化疗。在清淋预处理之前,62%的患者肿瘤负荷高,包括49%的 ALL 患者和68%的淋巴瘤患者。在 CAR-T 之前的最近 ECG 中 [201例 (99.5%) 患者可用],4%存在房颤。CAR-T前超声心动图 [188例 (93%) 患者可用] 显示平均 LVEF 为61%±8%。
发生严重心血管事件的CAR-T患者特征
33例 (16%) 患者在 CAR-T 细胞输注后中位12天发生SCE,包括26例 (13%) 心力衰竭事件(其中5例[2%]心源性休克)和11例 (5%)MI 患者;采用米力农 (1)、多巴酚丁胺 (1)、肾上腺素 (2) 和去甲肾上腺素 (1) 治疗心源性休克。
发生和未发生 SCE 患者的基线特征比较见表1。发生 SCE 的患者既存 CV 风险因素的负荷更高,包括高血压 (52% vs. 30%,P=0.02) 和房颤史(19% vs. 7%,P=0.03)或心力衰竭史 (21% vs. 2%,P<0.001)。既存 CV 风险因素的患者第100天 SCE 的 Kaplan–Meier (KM) 估计值较高:高血压(19% vs. 9%,P=0.01)、房颤(24% vs. 12%,P=0.01)和心力衰竭 (67% vs. 10%,P<0.0001)。与未发生 SCE 的患者相比,发生 SCE 的患者 CAR-T 前平均 LVEF 较低 (56±10 vs. 62±6%,P<0.001)。发生和未发生 SCE 的患者在 CAR-T 之前的肿瘤负荷相似。
在首次CAR-T 输注期间检查 CAR-T 后超声心动图的55例 (25%) 患者中,SCE患者的平均 LVEF 较低(45±12 vs. 57±12%,P=0.001;表2),与 CAR-T 前相比LVEF下降比例高2倍 (-11±12 vs.-5±9%)但差异无统计学显著性 (P=0.09)。67例 (33%) 患者在首次 CAR-T 输注后进行随访超声心动图检查,SCE患者的平均 LVEF 较低 (51±10 vs. 60±8%,P=0.001)。
SCE的炎症和生物标志物特征
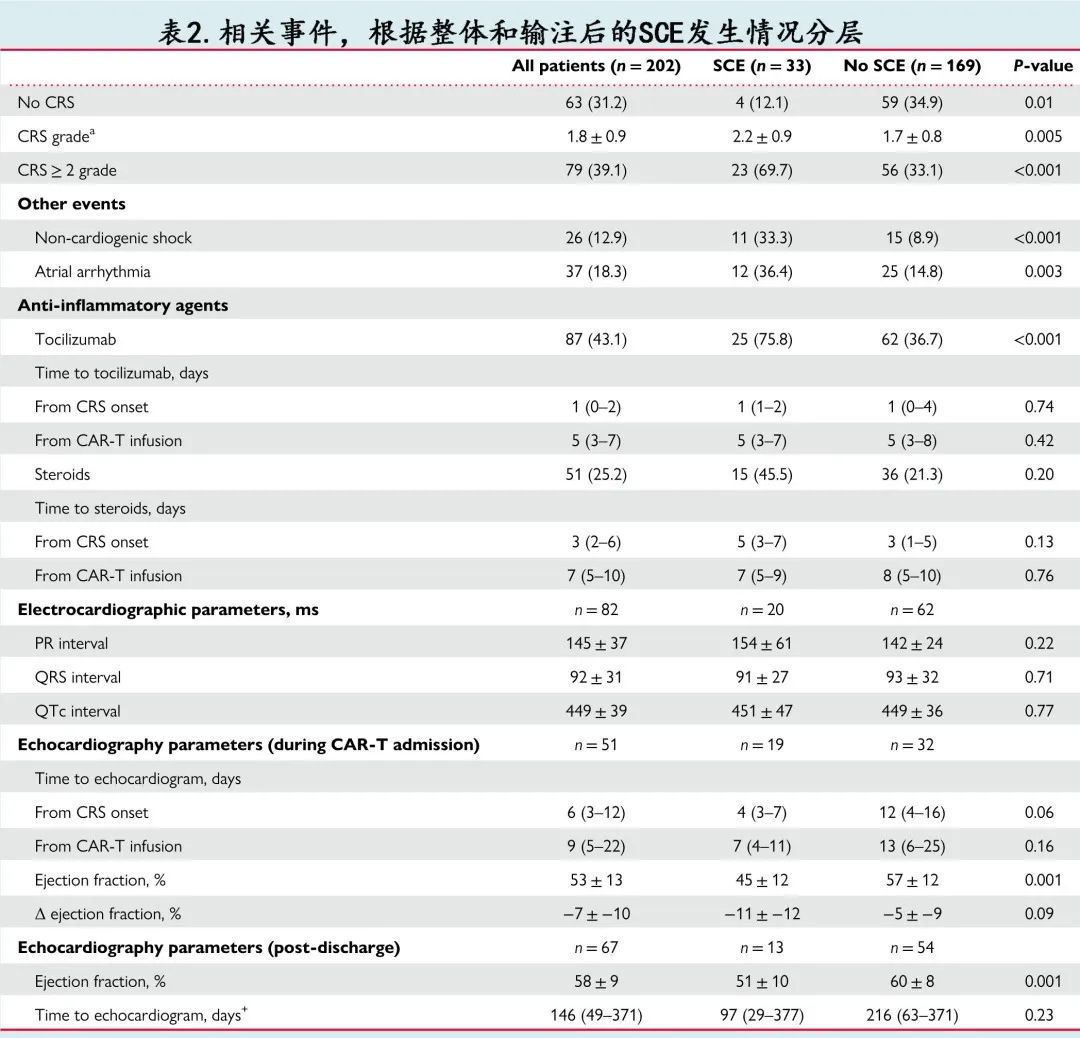
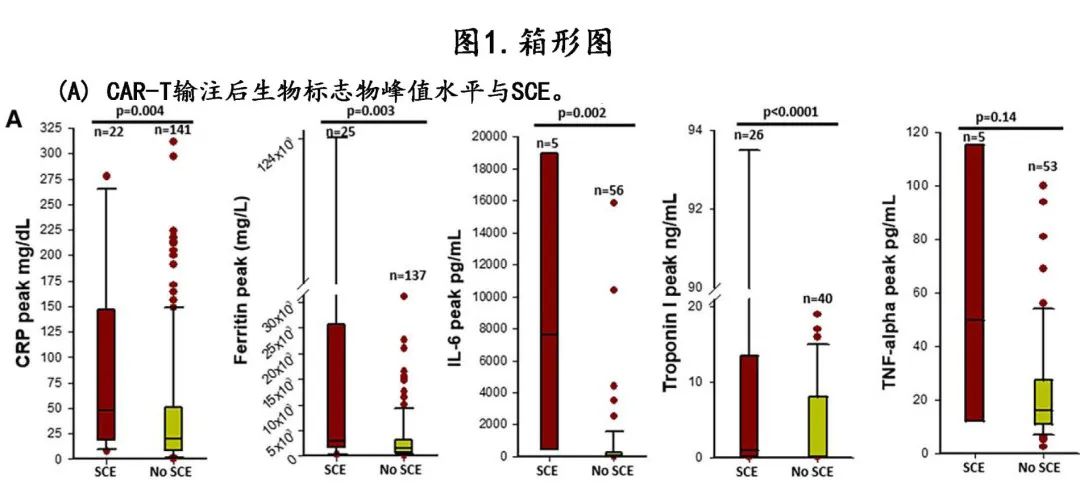
CAR-T 输注前的基线生物标志物检测患者数:CRP 102例 (51%)、肌钙蛋白57例 (28%) 和利钠肽29例 (14%);从 CAR-T 前生物标志物测量至 CAR-T 输注的中位时间为 CRP 5天、肌钙蛋白 8天和利钠肽195天。基线利钠肽水平高于ULN 的患者发生严重 CV 事件的比例更高 (100% vs. 29%,P=0.001),而发生或未发生SCE 的患者在中位基线肌钙蛋白和 CRP 水平相似(表1)。发生和未发生 SCE 患者的 CAR-T 输注后炎症参数比较见表2。发生 SCE 的患者的高级别 (≥2级) CRS发生率高2倍以上 (70% vs. 33%,P<0.001),CRS平均分级也较高 (2.2±0.9 vs. 1.7±0.8,P=0.005),而未发生任何 CRS 的发生率低近3倍 (12% vs. 35%,P=0.01)。发生 SCE 者非心源性休克(33% vs. 9%,P<0.001)和房性心律失常(36% vs. 15%,P=0.003)的发生率也较高。
在 CAR-T 输注后的前2周多次采集炎症生物标志物,可获得峰值的患者数如下:CRP 163例 (81%)、铁蛋白162例 (80%)、IL-6 61例 (30%) 和TNF-α58例 (29%);从 CAR-T 输注至炎症生物标志物的中位时间为 CRP 5天、铁蛋白 5天、IL-6 4天和TNF-α 5天。此外66例 (33%) 可获得肌钙蛋白、55例 (27%) 可获得利钠肽,从 CAR-T 输注至肌钙蛋白和利钠肽检测的中位时间均为10天。CAR-T 后肌钙蛋白从 CAR-T 前升至峰值水平的中位变化为0.04 ng/mL,而发生 SCE 的患者肌钙蛋白峰值较基线的中位升高值更大:0.51 vs. 0.01 ng/mL (P=0.02)。CRP 从 CAR-T 前水平至 CAR-T 后峰值水平的中位变化为36 mg/dL,发生和未发生 SCE 的患者 CRP 的中位变化相似:46 vs. 33 mg/dL (P=0.40)。
CAR-T 输注后,SCE与较高的炎症和心脏生物标志物水平峰值相关(图1A),包括中位 CRP 较高 [48.3 vs. 19.9 mg/dL,P=0.004]、中位铁蛋白较高 [2905 vs. 1408 mg/L,P=0.003] 和中位 IL-6 水平较高 [7580 vs. 63.5 pg/mL,P=0.002]。发生和未发生 SCE 的患者的中位TNF-α水平相当(50 vs. 16 pg/mL,P=0.14)。此外严重 CV 事件还与利钠肽高于ULN(30 vs. 11,P<0.001)和中位肌钙蛋白水平升高(0.9 vs. 0.05 ng/mL,P<0.001)相关。托珠单抗在 SCE 患者中的使用频率高2倍以上 (76% vs. 37%,P<0.001),而皮质类固醇的使用率相似。
死亡原因
中位随访 297天发生108例 (53%) 死亡,包括86例肿瘤复发或进展后死亡和22例NRM。第100天总死亡率的Kaplan–Meier估计值为18%,1年时为43%。第100天的非复发死亡率累积发生率为3.5%,1年时为6.7%;NRM 的原因包括感染(9例[4.5%])、CAR-T 相关非心脏毒性(3例[1%], 即CRS 或免疫效应细胞相关神经毒性综合征)、CV(1例[0.5%])和其他原因(9例 [4.5%])。
CAR-T后死亡患者的特征
死亡和存活患者之间的变量对比见表3。死亡与清淋前高肿瘤负荷 (42% vs. 17%,P<0.001) 和 ALL 诊断 (36% vs. 21%,P=0.02)相关,而给予的 CAR-T 产品或既往蒽环类药物暴露未观察到差异。死亡者中合并高血压者较多(42% vs. 25%,P=0.01)。此外在死亡和存活患者之间,既存心力衰竭、基线 LVEF 和 ECG 特征(节律和PR、QRS和 QTc 间期)无差异。具有以下风险因素的患者的 KM 第100天生存估计值较低:高肿瘤负荷(74% vs. 94%,P<0.0001)、高血压(78% vs. 84%,P=0.006),但是/否为ALL的患者相似 (84% vs. 81%,P=0.52)。

死亡患者的炎症和生物标志物特征
死亡和存活患者CAR-T 前的肌钙蛋白和CRP中位水平相当,利钠肽>ULN也相当(表3)。CAR-T 输注后,死亡和存活患者的炎症参数对比见表4。死亡患者的高级别 (≥2级) CRS发生率、平均 CRS 级别以及托珠单抗和皮质类固醇使用率和使用时间均相当。死亡患者的非心源性休克发生率高近2倍 (17% vs. 9%),但趋势无统计学显著性 (P=0.08)。CAR-T 输注后,死亡和存活患者之间 CAR-T 前的中位肌钙蛋白变化无显著差异(0.04 vs. 0.47 ng/mL,P=0.96),中位CRP 变化也无差异(21 vs. 40 mg/dL,P=0.20)。
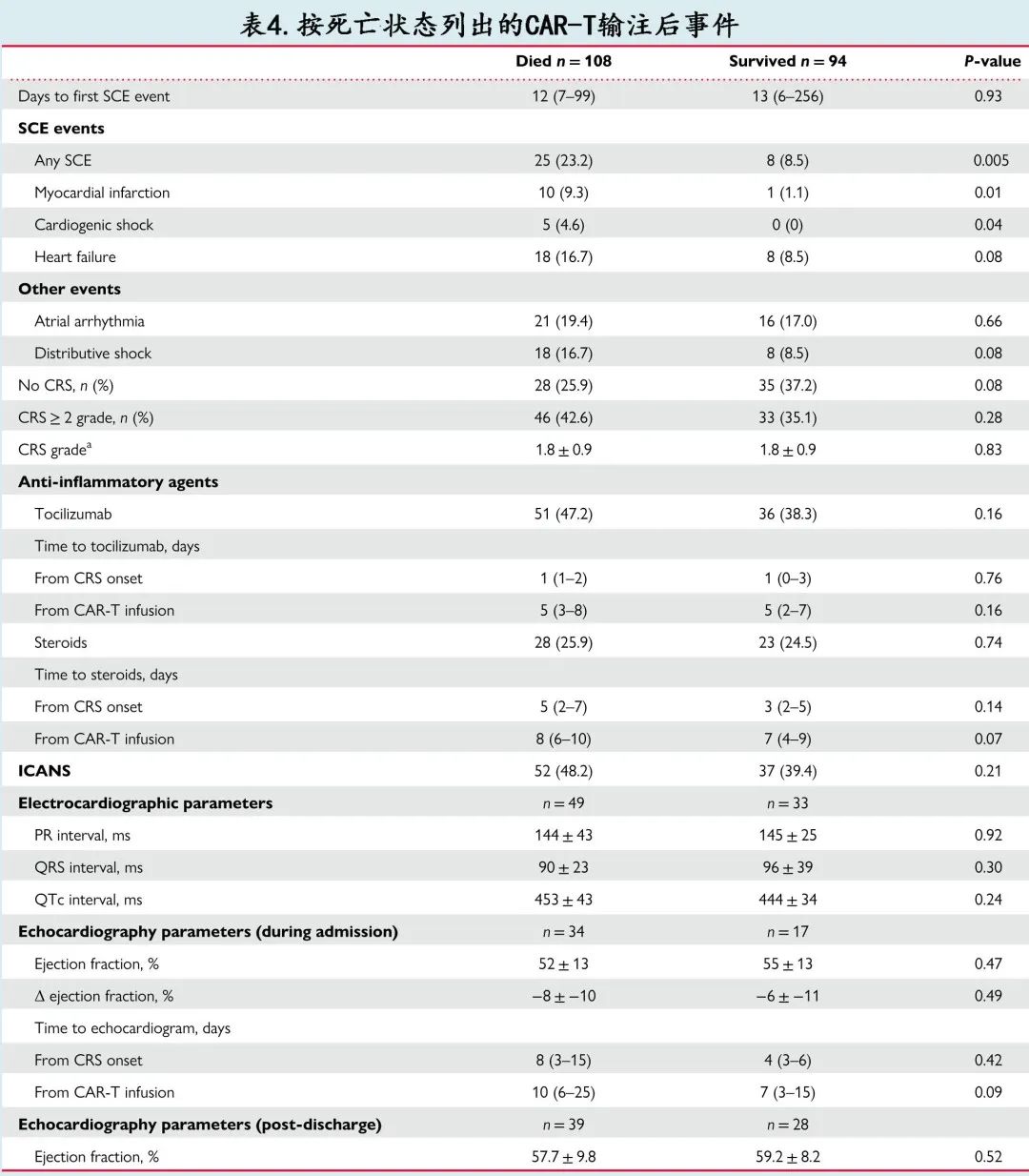
作者比较了死亡和存活患者CAR-T 输注后的生物标志物,见图 1B 。死亡患者的 IL-6 峰值(163 vs. 34 pg/mL,P=0.02)和铁蛋白峰值(2057 vs. 996 mg/L,P=0.0001)的中位水平较高。单变量 logistic 回归证实了死亡与 IL-6 或铁蛋白之间的相关性。在死亡患者中,TNF-α峰值(18.5 vs. 13.5 pg/mL,P=0.09)和 CRP 峰值(22.7 vs. 21 mg/dL,P=0.71)呈非显著性升高趋势。此外死亡和存活患者的中位肌钙蛋白峰值水平(0.08 vs. 0.05 ng/mL,P=0.21)和利钠肽升高>ULN 的比例 (81% vs. 63%,P=0.16) 相似。
CAR-T后死亡患者的心血管事件
表4比较了 CAR-T 输注后死亡和存活患者的心血管事件。严重CV事件在死亡患者中更常见 (23% vs. 9%,P=0.005),包括MI (9% vs. 1%,P=0.01) 和心源性休克 (5% vs. 0%,P=0.04) 的发生率更高,而临床心力衰竭有发生率较高趋势但不显著 (17% vs. 9%;P = 0.08)。死亡和存活者在至 SCE 时间无差异。SCE 后死亡的中位时间为20天。房性心律失常(未纳入SCE的定义)在死亡和存活患者之间的发生率相似。在 CAR-T 后接受心脏检测的患者中,死亡和存活患者的 LVEF 和 ECG 参数(PR、QRS和 QTc 间期)均相当。
死亡相关的变量
发生SCE 者的死亡率较高:25例 (76%) vs. 83例 (49%),P=0.005。图 2A为从 CAR-T 输注开始的总生存期,绘制为按时间依赖性变量 SCE 分层的Simon–Makuch曲线 (P=0.0001)。

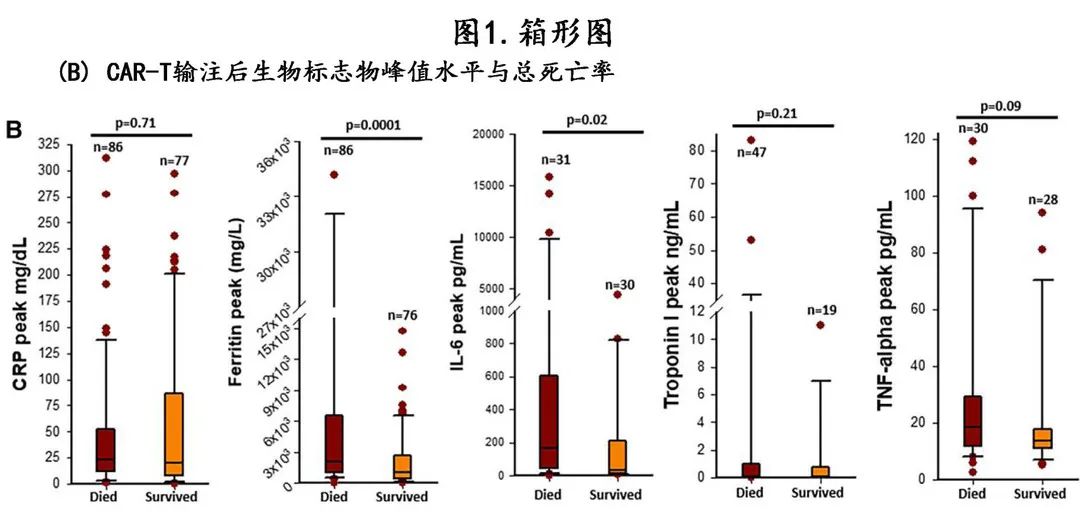
单变量 Cox 比例风险回归分析中,与总死亡率相关的变量为SCE、高肿瘤负荷、高血压和既往蒽环类药物使用(图3)。
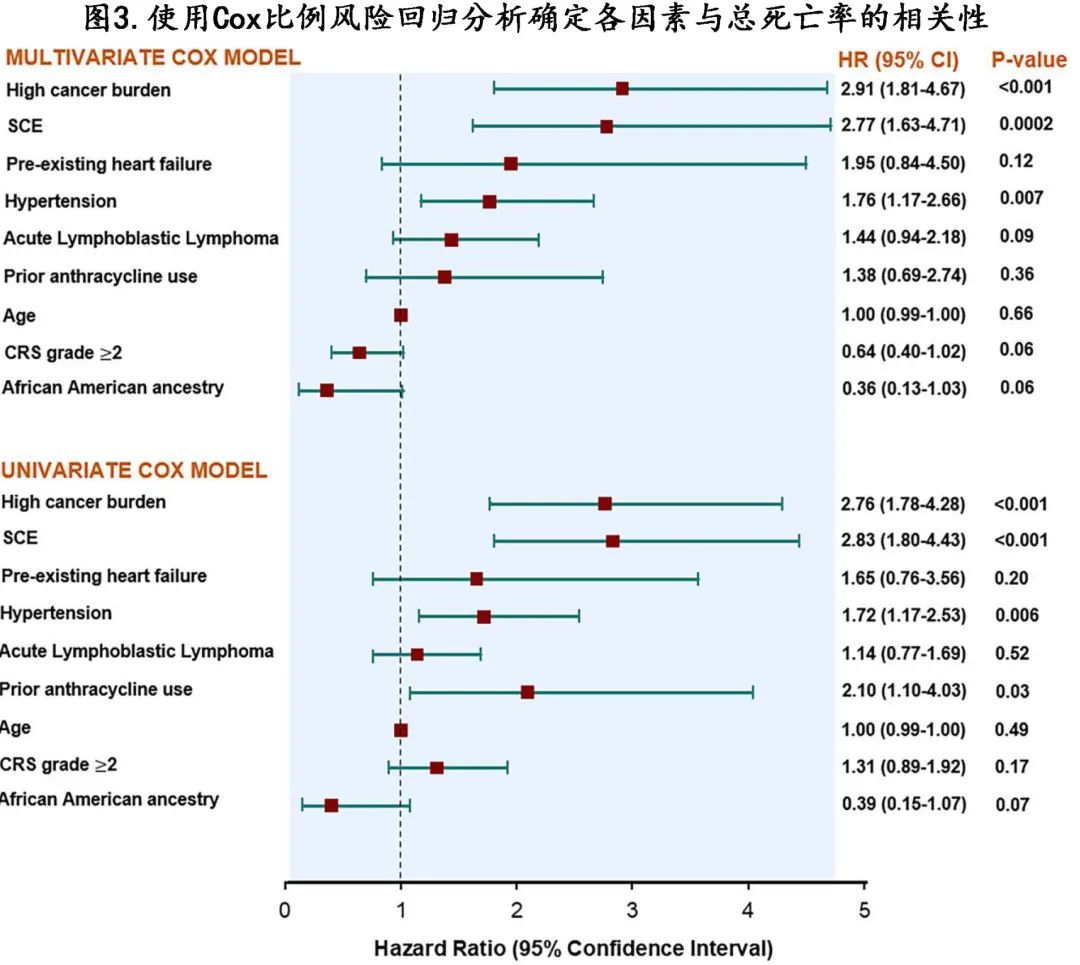
对于多变量模型,CAR-T后 SCE 的发生与总死亡率风险增加独立相关(校正的HR[aHR]=2.8)。同样,CAR-T前的高肿瘤负荷 (aHR=2.9) 和既存高血压 (aHR =1.8) 也与总死亡率独立相关。图 2B 显示了按 SCE 分层的从 CAR-T 输注开始计算的 NRM 累积发生率曲线(Gray检验P=0.01);此外在校正高肿瘤负荷的多变量模型中,CAR-T后 SCE 与 NRM 风险增加独立相关(aHR =3.5)。

作者首次证明,CD19 CAR-T 后的严重心血管事件(心力衰竭、心源性休克和心梗)不仅独立增加总死亡率的风险,而且也独立增加 NRM 的风险;即使调整 CAR-T 前肿瘤负荷、预先存在的心血管事件风险因素和既往使用过心脏毒性蒽环类药物后,这种相关性仍然存在。作者还发现严重心血管事件与较高的IL-6、CRP、铁蛋白和肌钙蛋白峰值水平相关。
考虑到CD19 CAR-T后严重心血管事件的频繁发生,本研究的发现很重要,对严重心血管事件高危人群生物标志物特征的理解,以及严重心血管事件早期治疗的持续进步,可能使 CAR-T 患者生存率进一步改善。
其他肿瘤治疗(如 ICI 和蒽环类药物)中重度心脏毒性、炎症和生存期之间也存在联系,随着对于该联系的认知加深,已经开发用于早期心脏毒性检测的标准化心血管监测方案,包括系列超声心动图、基线生物标志物和ECG,但CAR-T后的心血管最佳监测策略尚不清楚。未来的研究工作可能包括进一步研究炎症生物标志物作为重度心脏毒性的可能预测因素,还需要探索减轻 CAR-T 心脏毒性的治疗选择,例如早期使用托珠单抗减轻高级别 CRS 和可能的心血管事件。此外尚不清楚传统心脏保护治疗(例如他汀类药物、β受体阻滞剂和血管紧张素通路抑制剂)是否可降低心血管风险。
参考文献
Syed S Mahmood ,et al. Biomarkers and cardiovascular outcomes in chimeric antigen receptor T-cell therapy recipients.Eur Heart J . 2023 Mar 20;ehad117. doi: 10.1093/eurheartj/ehad117.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













学习了
82