Nat Cell Biol:热休克伴侣蛋白HSPB1调节细胞质TDP-43相分离和聚集的机制
2022-11-30 brainnew神内神外 brainnew神内神外 发表于安徽省
研究确定了HSPB1以及HSP70伴侣活性,是维持细胞质中相分离TDP-43液滴的液态所必需的。
 TDP-43是一种具有朊病毒样结构域的主要核RNA/DNA结合蛋白,在几乎所有(97%)肌萎缩侧索硬化症(ALS)患者中错误定位并聚集在运动神经元的细胞质中。据报道,它在其他神经退行性疾病中类似地在细胞质中积累,包括额颞叶变性、阿尔茨海默病和TDP-43脑病。
TDP-43是一种具有朊病毒样结构域的主要核RNA/DNA结合蛋白,在几乎所有(97%)肌萎缩侧索硬化症(ALS)患者中错误定位并聚集在运动神经元的细胞质中。据报道,它在其他神经退行性疾病中类似地在细胞质中积累,包括额颞叶变性、阿尔茨海默病和TDP-43脑病。
在正常细胞中,这些RNA结合蛋白的相分离似乎受到严格控制,每种蛋白的一部分在核质或细胞质内混合成液滴。尽管翻译后乙酰化可以将核内相分离驱动为由TDP-43的液体外壳和HSP70家族伴侣的液体中心组成的复杂液滴,但尚未确定介导细胞质相分离的机制。
2022年9月8日,美国加州大学圣迭戈分校的Don W. Cleveland课题组在Nat Cell Biol上发表了题为“Heat-shock chaperone HSPB1 regulates cytoplasmic TDP-43 phase separation and liquid-to-gel transition”的研究文章,该研究使用同位素标记质谱法鉴定相分离的细胞质TDP-43与小热休克蛋白HSPB1结合,结果表明HSPB1是细胞质TDP-43相分离和聚集的调节剂。 研究结果
研究结果
1.应激诱导的蛋白毒性TDP-43液滴/凝胶
由于衰老过程中核转运下降并且TDP-43的RNA结合可以通过其每个RNA结合基序(RRM)中赖氨酸的翻译后乙酰化来调节,作者测试了细胞质TDP-43受蛋白质组压力的影响,伴随着蛋白酶体或HSP70-伴侣活性的年龄依赖性降低。诱导RNA结合能力的细胞质TDP-43(图1a)产生浓度依赖性相分离成许多不同直径的圆形液滴(图1b)。通过蛋白酶体活性的瞬时降低(通过添加抑制剂MG132)诱导较低水平的最初扩散定位的RNA结合能力TDP-43相分离成许多小的圆形细胞质颗粒(图1c),HSP70活性的抑制也有效地诱导了去混合,但仅限于未与RNA结合的细胞质TDP-43(图1d),亚砷酸盐暴露诱导阶段将有RNA结合能力和无能力TDP-43相分离(图1e)。
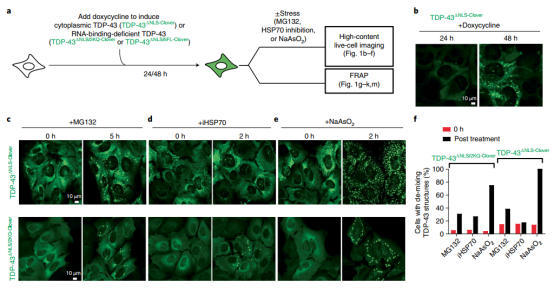 图1:氧化应激和蛋白酶体活性降低诱导细胞质TDP-43相分离和液体到凝胶/固体的转变。
图1:氧化应激和蛋白酶体活性降低诱导细胞质TDP-43相分离和液体到凝胶/固体的转变。
2.细胞质TDP-43液滴消耗核TDP-43
接下来作者测试了持续的细胞质TDP-43分离是否足以隔离核TDP-43从而导致核TDP-43功能丧失。使用荧光标记的野生型TDP-43取代内源性TDP-43的细胞,细胞周期停滞在G0/G1(通过血清减少和添加Cdk4和Cdk6抑制剂palbociclib),然后诱导表达细胞质TDP-43(TDP-43ΔNLS-Clover;图2a)。增加的细胞质TDP-43推动了液体TDP-43液滴的浓度依赖性形成,这些液滴在24小时内隔离了一部分核TDP-43,在40小时内几乎完全清除了核TDP-43(图2b)。在最后4或8小时内连续添加低水平的亚砷酸钠会加剧核TDP-43的消耗和分离的细胞质TDP-43转化为更大的凝胶/固体液滴(图2c)。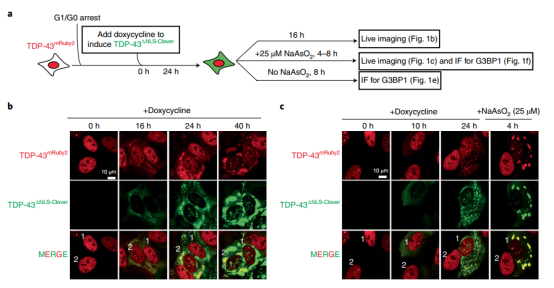 图2:通过细胞质TDP-43相分离,核TDP-43的缓慢损耗被应力诱导的液体到凝胶/固体的转变所增强。
图2:通过细胞质TDP-43相分离,核TDP-43的缓慢损耗被应力诱导的液体到凝胶/固体的转变所增强。
3.HSPB1与细胞质TDP-43结合并相分离
作者使用邻近标记和定量质谱法鉴定了分离的细胞质TDP-43的成分,产生了仅表达荧光APEX2标记的细胞质TDP-43(TDP-43ΔNLS-Clover-APEX2)和荧光细胞质APEX2(APEX2Clover-NES)的细胞系。通过添加亚砷酸钠或蛋白酶体抑制剂MG132诱导细胞质RNA结合能力TDP-43相分离。为了进行直接比较,对六组进行了邻近标记:具有弥漫性细胞质TDP-43(TDP-43ΔNLS-Clover-APEX2)或细胞质APEX2(APEX2Clover-NES)的细胞,主要具有分离的细胞质TDP-43的细胞(TDP-43ΔNLS-Clover-APEX2)或APEX2暴露于亚砷酸钠和细胞与部分分离的细胞质TDP-43(TDP-43ΔNLS-Clover-APEX2)或暴露于MG132后的APEX2(图3a)。
使用六重串联质量标签(TMT)标记和定量质谱(基于MS3)鉴定每种条件下TDP-43的结合蛋白。在比较表达TDP-43ΔNLS-Clover-APEX2或APEX2NES-Clover的细胞中属于每种蛋白质的所有肽的组合强度,27种蛋白质被APEX-可重复标记的细胞质TDP-43下没有应激,细胞暴露于亚砷酸钠后的19种蛋白质和蛋白酶体抑制后的53种蛋白质(图3b)。尽管在无应力组和亚砷酸钠组中都发现了15种蛋白质(图3b),但亚砷酸盐诱导的TDP-43相分离显着增加了接近标记的三倍以上,仅一种蛋白质-小的热休克蛋白折叠伴侣HSPB1(图3c)。内源性HSPB1的免疫染色和mCherry标记的HSPB1的直接检测(图3d)证实HSPB1被招募到富含细胞质TDP-43液滴中。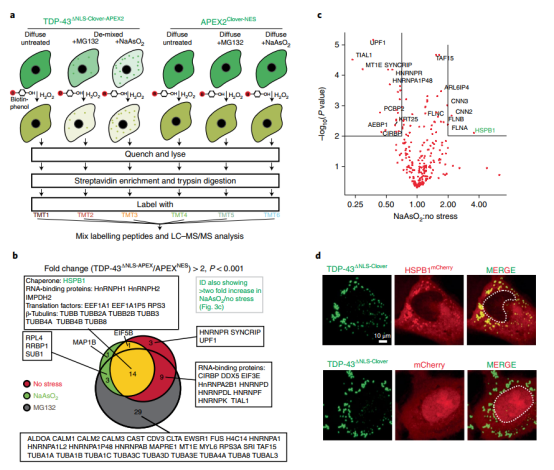 图3:结合APeX近距离标记、使用同位素标记tmt的定量质谱、共表达和免疫荧光识别小热休克蛋白HSPB1,在亚砷酸盐胁迫后与细胞质TDP-43结合,并与其分解成液滴/凝胶。
图3:结合APeX近距离标记、使用同位素标记tmt的定量质谱、共表达和免疫荧光识别小热休克蛋白HSPB1,在亚砷酸盐胁迫后与细胞质TDP-43结合,并与其分解成液滴/凝胶。
4.HSPB1在具有TDP-43病理的运动神经元中减少
最后,作者研究了ALS患者中HSPB1的量或亚细胞定位是否在具有TDP-43病理学的运动神经元中发生变化(图4d,e)。对三名散发性ALS患者和一名家族性ALS患者的脊髓切片进行检查,结果显示显示绝大多数的剩余运动神经元具有细胞质TDP-43病理学,其中许多(44-78%)显示出明显的核TDP-43丢失,最值得注意的是,ALS患者存活的运动神经元中HSPB1的水平显着且可重复地降低(图4f)。
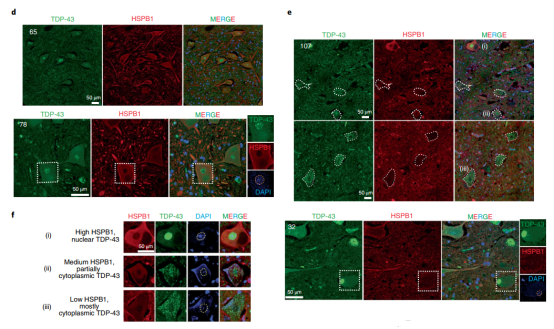 图4:在肌萎缩侧索硬化症患者的正常运动神经元中HSPB1表达量较高,但在TDP-43病理的脊髓运动神经元中HSPB1的积累量急剧下降。
图4:在肌萎缩侧索硬化症患者的正常运动神经元中HSPB1表达量较高,但在TDP-43病理的脊髓运动神经元中HSPB1的积累量急剧下降。
综上所述,本研究确定了HSPB1以及HSP70伴侣活性,是维持细胞质中相分离TDP-43液滴的液态所必需的。HSPB1的结合是直接的,通过TDP-43的RNA结合和LCD介导,HSPB1分裂成TDP-43液滴并抑制液滴老化和TDP-43组装成原纤维,并且HSPB1与HSP70伴侣机制一起调节TDP-43的相分离状态,因此提高热休克伴侣和蛋白质质量控制机制的其他成分水平的方法可以为治疗带来希望。这些发现为确定细胞质TDP-43是否影响微管蛋白折叠/再折叠中的HSPB1功能提出了一个未来方向。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






