Nature最新研究表明:“果糖”摄入太多,会促进肿瘤生长!
2024-12-06 BioMed科技 BioMed科技 发表于陕西省
华盛顿大学团队发现,在动物肿瘤模型中,果糖补充剂可促肿瘤生长。癌细胞难直接利用果糖,但肝细胞能转化果糖为营养物,通过脂质转移间接促肿瘤生长。
在过去的50年里,由于高果糖玉米糖浆作为甜味剂的广泛使用,果糖的消耗量大幅增加。越来越多的证据表明,膳食果糖促进多种肿瘤类型的生长。与此推理一致,一些恶性人体组织过度表达果糖转运蛋白GLUT2和GLUT59。此外,在某些条件下,一些研究已经证明,培养的许多癌细胞可以利用果糖来产生能量和生物质。然而,要使癌细胞直接使用果糖作为主要的燃料来源,果糖必须能够被肿瘤组织所获取。饮食中的大多数果糖由小肠和肝脏代谢,即使是高果糖饮食,也只有相对少量的果糖进入体循环。这就提出了一个问题,即在果糖可用性有限的组织中,肿瘤是否仍然可以通过直接使用膳食果糖来促进生长。
果糖促进肿瘤生长
在这项研究中,华盛顿大学Gary J. Patt团队研究表明,在黑色素瘤、乳腺癌和宫颈癌的动物模型中,果糖补充剂可以促进肿瘤生长,而不会导致体重增加或胰岛素抵抗。癌细胞本身不能很容易地利用果糖作为营养物质,因为它们不表达酮己糖激酶c (KHK-C)。原代肝细胞表达KHK-C,导致果糖分解和多种脂类的分泌,包括溶血磷脂酰胆碱(LPCs)。在共培养实验中,肝细胞来源的LPCs被癌细胞消耗并用于生成磷脂酰胆碱,这是细胞膜的主要磷脂。在体内,补充高果糖玉米糖浆使血清中的几种LPC增加了7倍以上,给小鼠注射LPCs足以促进肿瘤生长。酮己糖激酶的药理抑制对癌细胞没有直接影响,但它可以降低循环中的LPC水平,并在体内阻止果糖介导的肿瘤生长。这些发现表明,补充果糖可以增加循环营养素,如LPCs,这可以通过细胞非自主机制促进肿瘤生长。相关工作以“Dietary fructose enhances tumour growth indirectly via interorgan lipid transfer”为题发表在Nature。

【文章要点】
一、饮食中的果糖促进肿瘤生长
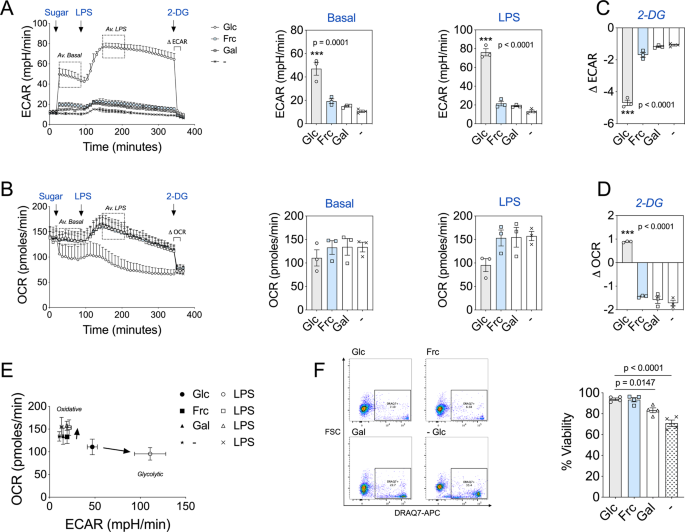
作者探讨了膳食果糖对肿瘤生长的影响,使用斑马鱼黑色素瘤模型,发现饮用含果糖水可促进肿瘤生长。在小鼠体内建立的多种肿瘤模型(黑色素瘤、乳腺癌、宫颈癌等),给予高果糖玉米糖浆(HFCS)溶液也能加速肿瘤生长。单独给予10%果糖水或富含果糖的饲料同样可促进肿瘤的生长。上述果糖诱导的肿瘤生长加速,不是由于果糖导致的肥胖或胰岛素抵抗,即不是通过全身代谢变化的二级效应。这些结果表明,膳食果糖本身就可以直接促进肿瘤的生长,这可能成为膳食因素影响肿瘤进展的一个重要机制。
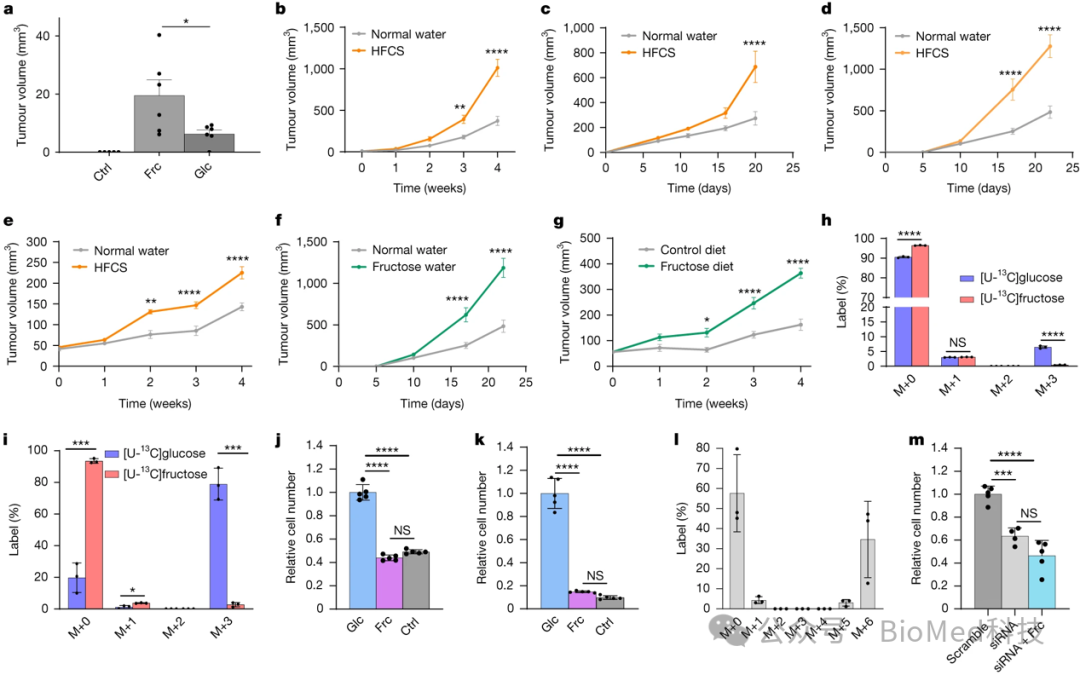
图1 饮食中的果糖促进肿瘤生长
二、转化后的细胞表达KHK-A而不表达KHK-C
本研究通过对不同来源的肿瘤细胞进行同位素示踪实验,以及细胞培养实验,探讨了肿瘤细胞对果糖的代谢和利用情况。作者将多种肿瘤细胞培养在含13C标记的果糖或葡萄糖培养基中,发现肿瘤细胞能大量利用葡萄糖代谢,但很少代谢果糖。即使用高达10 mM的果糖作为唯一糖源,大多数肿瘤细胞的增殖速度也显著低于葡萄糖。这说明肿瘤细胞并不能有效利用果糖作为能量来源。进一步机制分析发现,肿瘤细胞普遍缺乏果糖代谢的关键酶KHK-C的表达,只表达代谢能力较弱的KHK-A亚型。同时这些肿瘤细胞也缺乏将果糖1-磷酸输送入糖酵解的另一个关键酶-aldolase B。因此,尽管肿瘤细胞能够代谢少量的果糖,但整体来看,果糖在肿瘤细胞的代谢中贡献很小,不能为肿瘤生长提供足够的能量。总之,该研究表明,尽管高糖饮食可促进肿瘤生长,但这主要是由于葡萄糖的代谢,而非果糖。
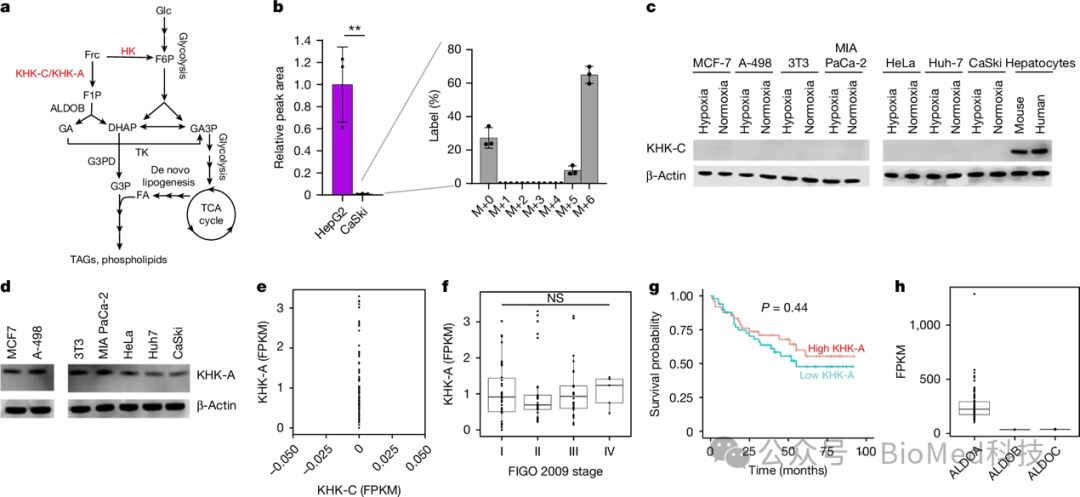
图2 转化后的细胞表达KHK-A而不表达KHK-C
三、肝细胞将果糖转化为营养物质
作者进一步探讨了肝脏在果糖代谢过程中如何为远端肿瘤细胞提供营养支持,从而促进肿瘤生长的机制。原代小鼠肝细胞能够高效代谢果糖,并产生大量的13C标记乳酸。作者将不能有效利用果糖的CaSki肿瘤细胞与原代肝细胞共培养,发现肝细胞可以显著促进CaSki细胞的增殖。这种促进作用受到KHK抑制剂的抑制,说明依赖于肝细胞的果糖代谢。通过代谢组学分析发现,肝细胞在果糖条件下会大量释放溶血性磷脂酰胆碱(LPC)脂质代谢物,而这些LPC被CaSki细胞所吸收利用。使用同位素标记的果糖,作者进一步证实肝细胞代谢果糖可以合成并分泌这些富含13C的LPC代谢物。这些LPC代谢物可能为远端缺乏有效果糖代谢能力的肿瘤细胞提供所需的营养,从而促进它们的增殖。
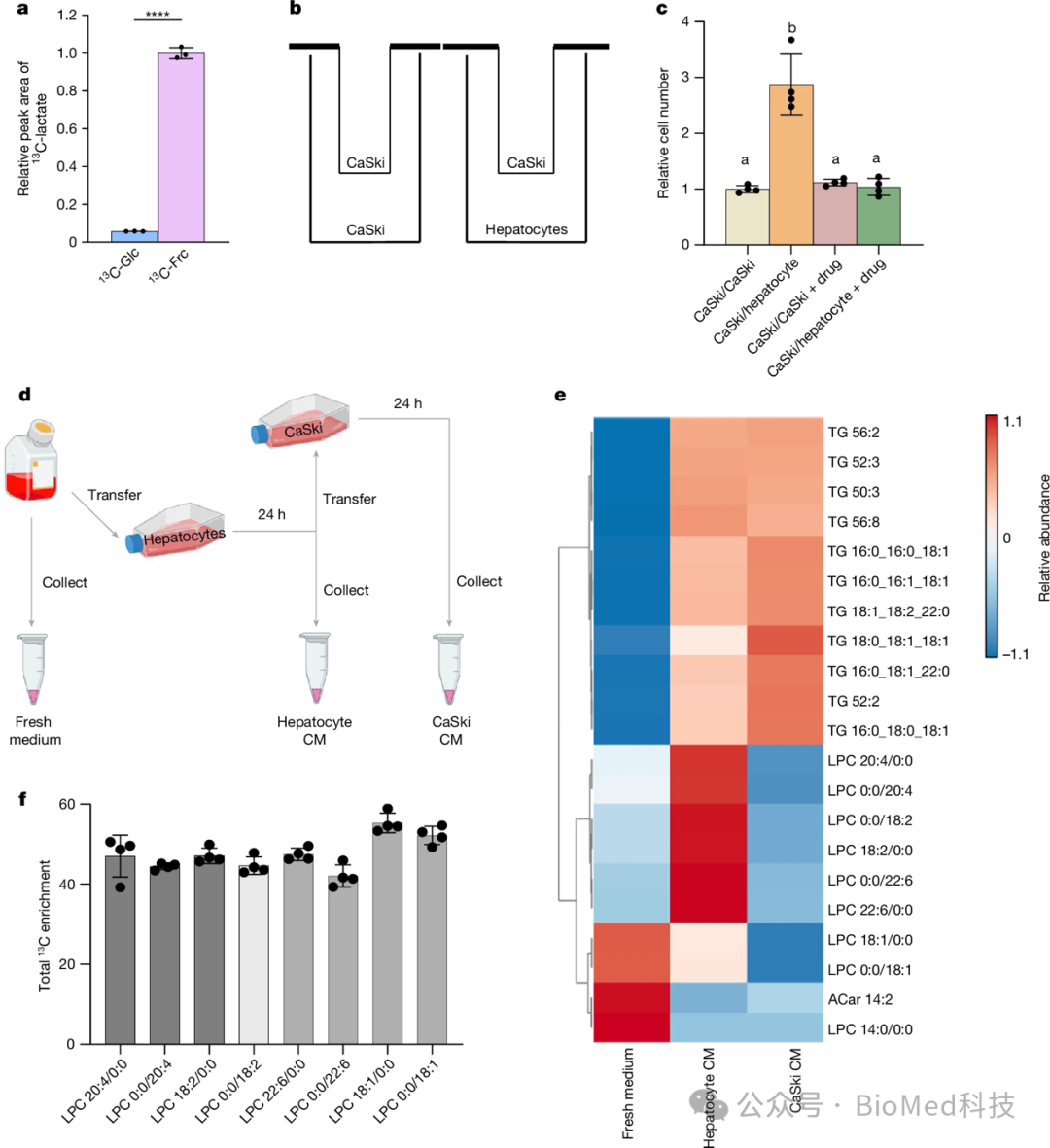
图3 肝细胞将果糖转化为营养物质
四、果糖的有机体代谢驱动肿瘤生长
作者通过一系列实验研究了果糖代谢在肿瘤生长中的作用,发现果糖并未直接被肿瘤利用,而是通过表达KHK-C和醛缩酶B的果糖代谢组织转化为其他营养物质供肿瘤利用。实验采用标记葡萄糖和果糖的示踪剂,作者发现直接将果糖注射到肿瘤中几乎没有代谢利用,而经口给予果糖则显著增强了肿瘤代谢标记物的标记水平。KHK-C抑制剂PF-06835919能够显著提高血清果糖水平,但在正常饮食条件下对肿瘤生长无影响。然而,在高果糖或高果糖玉米糖浆(HFCS)饮食下,该抑制剂显著抑制了肿瘤生长,表明果糖通过KHK-C依赖的代谢途径间接促进肿瘤发展。此外,作者发现LPCs(溶血磷脂酰胆碱),特别是LPC 18:1,是果糖代谢产生的关键营养物质,能够促进肿瘤生长。果糖碳骨架被证明能参与LPC的甘油骨架和脂肪酰链合成。综上,果糖通过间接代谢途径促进肿瘤生长,KHK-C抑制剂在高果糖饮食下对肿瘤生长具有抑制作用。
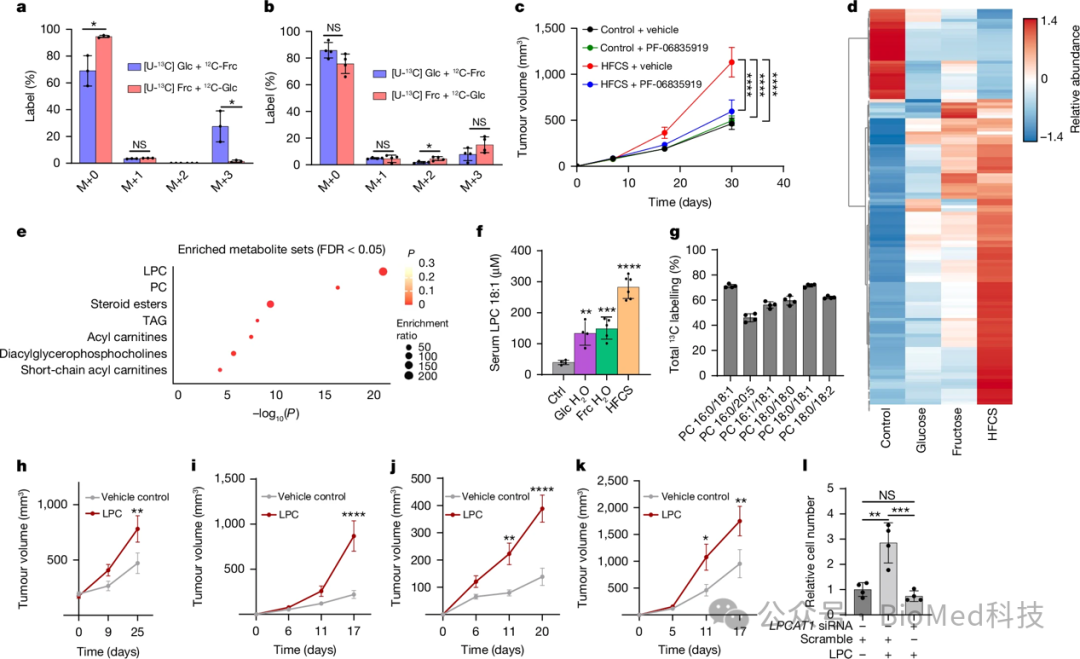
图4 果糖的有机体代谢驱动肿瘤生长
【结论与展望】
研究发现,在单一培养的条件下,即使给予极高浓度的果糖,肿瘤细胞也无法高效代谢果糖,因为它们缺乏关键果糖代谢酶(KHK-C和醛缩酶B)。尽管肿瘤细胞无法直接利用果糖,果糖仍能通过代谢途径间接促进肿瘤生长。高果糖饮食会显著增加循环中的脂质(特别是溶血磷脂酰胆碱,LPC)的水平,LPC被肿瘤用作膜合成的原料,从而促进肿瘤的生长。高果糖饮食导致小鼠血清中的LPC 18:1水平显著升高,而肿瘤承载小鼠的肿瘤间质液(TIF)中LPC 18:1水平降低,表明肿瘤消耗了这些LPC。此外,既往研究显示某些人类癌症患者中LPC水平降低,进一步验证了这一代谢负担。总之,高果糖饮食间接为肿瘤提供了重要的营养来源(LPC),而非通过直接代谢途径。未来的研究应进一步探索LPC在肿瘤生长中的作用,并将其作为潜在的治疗靶点。
原文链接:
https://www.nature.com/articles/s41586-024-08258-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#果糖#
21