JTO子刊:非小细胞肺癌中EGFR突变亚型不仅影响一线奥希替尼的疗效,还影响进展模式
2024-03-24 苏州绘真医学 苏州绘真医学 发表于上海
本研究结果阐明了与一线OSI治疗结果相关的转移模式和EGFR突变类型,并提示依赖于EGFR突变类型的不同进展模式可能对确定EGFR突变NSCLC患者的治疗策略很重要。

奥希替尼(OSI)是第三代EGFR酪氨酸激酶抑制剂,是初治EGFR突变NSCLC患者的标准治疗。然而,关于OSI治疗失败后突变亚型如何影响疾病进展的信息很少。本研究回顾性分析2015年4月至2021年12月接受OSI一线治疗的EGFR突变NSCLC患者。
研究纳入229例患者。客观缓解率为71%,颅内和颅外缓解率分别为71%和90%。中位无进展生存期为23.3个月(95 CI:19.6-26.7),中位总生存期为33.7个月(95%CI:31.3-58.6)。多变量分析显示,EGFR外显子21 L858R点突变(L858R)(HR=1.56,95%CI:1.04-2.34,p=0.0328)和肝转移(HR=1.56,95%CI:1.04-2.34,p=0.0328)是OSI治疗中无进展生存的显著预测因素。涉及中枢神经系统转移灶的伴随疾病进展在L858R患者中更为常见(p=0.048),而涉及原发灶的伴随疾病进展在外显子19缺失突变患者中更为常见(p=0.01)。此外,在中枢神经系统转移患者中,L858R突变患者随着时间的推移发生疾病进展概率高于外显子19缺失突变患者(对数秩检验,p=0.027)。
突变亚型不仅影响EGFR突变NSCLC患者一线OSI治疗的临床疗效,而且影响OSI治疗后的进展模式。
研究背景
EGFR突变是NSCLC患者中最常见的靶向突变。EGFR酪氨酸激酶抑制剂(TKIs)彻底改变了携带EGFR突变NSCLC患者的治疗,尤其是EGFR敏感突变,如外显子19缺失(19del)和外显子21 L858R点突变(L858R)。这些常见的体细胞突变约占EGFR基因变异的85%。对于携带EGFR敏感突变的初治NSCLC患者,多种EGFR TKIs已被确立为标准治疗。
奥希替尼(OSI)是第三代EGFR TKI,在第一代和第二代EGFR TKI治疗失败后,被开发用于治疗EGFR第20号外显子T790M突变阳性NSCLC患者。FLAURA试验发现,对于携带EGFR突变的初治晚期NSCLC患者,与第一代EGFR TKIs厄洛替尼和吉非替尼相比,OSI作为初始治疗显著延长了无进展生存期(PFS)和总生存期(OS),并降低了中枢神经系统(CNS)转移的发生率。虽然研究发现OSI具有显著的治疗效果,但几乎所有接受OSI治疗的患者在约15-20个月后均出现疾病进展。
一些研究提示,基线时的突变亚型和转移部位是EGFR TKIs疗效的预测因素。相比之下,根据突变亚型,OSI治疗失败后的疾病进展模式的信息很少。在本研究中,研究者基于突变类型评估了OSI治疗初治EGFR突变NSCLC的疗效预测因素和进展模式的差异。
研究结果
患者特征:
基线患者特征见表1。共229例EGFR突变的晚期NSCLC患者接受了OSI治疗,中位年龄为67岁(范围:28-87岁),女性154例(68%)。超过一半的患者不吸烟(68%),大多数患者患腺癌(97%)。ECOG评分≥2分者27例(12%)。最常见的EGFR突变为19del(n=125,55%),其次为L858R(n=88,38%)。EGFR罕见突变包括L861Q(n=8)、S7681I(n=3)、G719X(n=2)、G719A(n=1)、G719C+E709A(n=1)和G719X+S768I(n=1)。OSI治疗开始时,73例(32%)患者出现CNS转移。在这些患者中,26例既往接受过脑部局部治疗,11例接受了全脑放疗,12例接受了立体定向放疗。数据截止时,118例患者仍在接受OSI治疗。
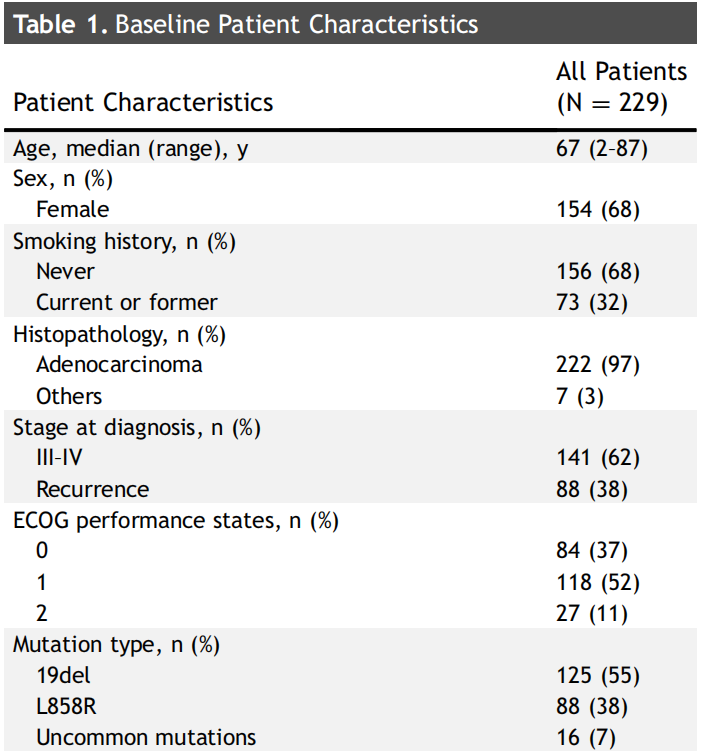
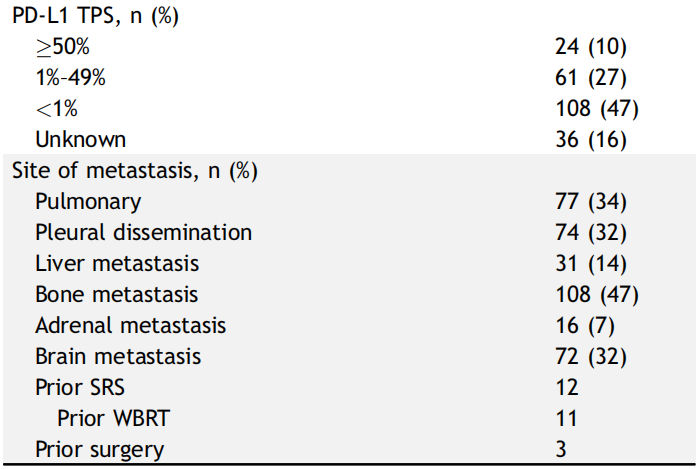
表1
晚期NSCLC患者接受OSI治疗的临床结局:
中位随访时间为19.7个月(四分位距:13.8-27.5)。在所有接受OSI治疗的患者中,客观缓解率(ORR)为71%(95%CI:64.1-75.8),疾病控制率为89%(95% CI:84.4–92.5),颅内(IC)ORR为90%(95%CI:80.2-95.4)。OSI治疗的IC和颅外(EC)反应之间的总体一致性为89%。在基线时有CNS转移的患者中,51例(84%)同时有IC和EC反应,3例(5%)两者均无反应。19del患者的缓解率显著高于L858R患者(79% vs 60%,p=0.003)。19del组IC ORR为97%,L858R组IC ORR为79%(p=0.03)。在19del中,42%的患者表现出IC完全缓解,而在L858R中,只有25%的患者表现出IC完全缓解。
中位PFS和OS分别为23.3个月(95%CI: 19.3-26.7)和33.7个月(95%CI: 19.3-26.7)(图1A和B)。19del、L858R和罕见突变的中位PFS分别为24.0个月(95%CI: 22.3-29.8)、16.7个月(95%CI: 12.8-26.9)和9.4个月(95%CI: 3.7-未评估)(图1C)。19del、L858R和罕见突变的中位OS分别为46.4个月(95%CI: 46.4-58.6)、30.7个月(95%CI: 29.5-33.7)和未达到(95%CI: 29.5-33.7)(图1D)。

图1
根据转移部位和EGFR突变亚型的OSI活性:
按转移部位分组,肝、骨、肾上腺转移患者的中位PFS明显短于无转移者,而脑转移与无脑转移患者的中位PFS差异无统计学意义(19.6个月 vs 24.1个月;HR=1.380;95%CI:0.94-2.04,p=0.1015)。在胸腔积液中也观察到了类似的结果(图2A-F)。多变量分析显示,L858R患者的PFS显著短于19del患者(HR=1.56,95%CI:1.04-2.34,p=0.0328),肝转移患者也表现出更短的PFS(HR=2.63,95%CI:1.53-4.49,p=0.0004)(表2)。
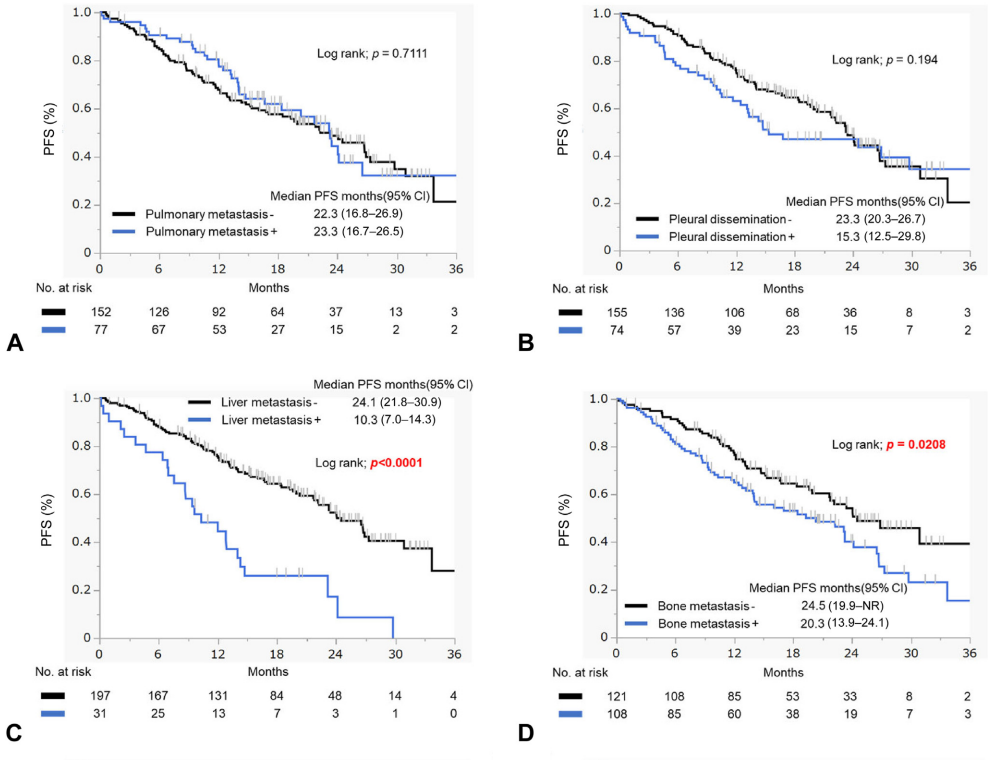
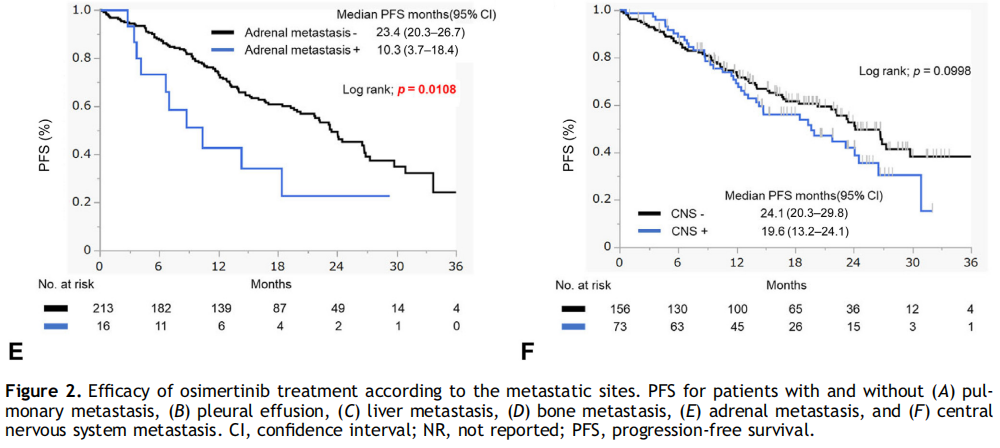
图2
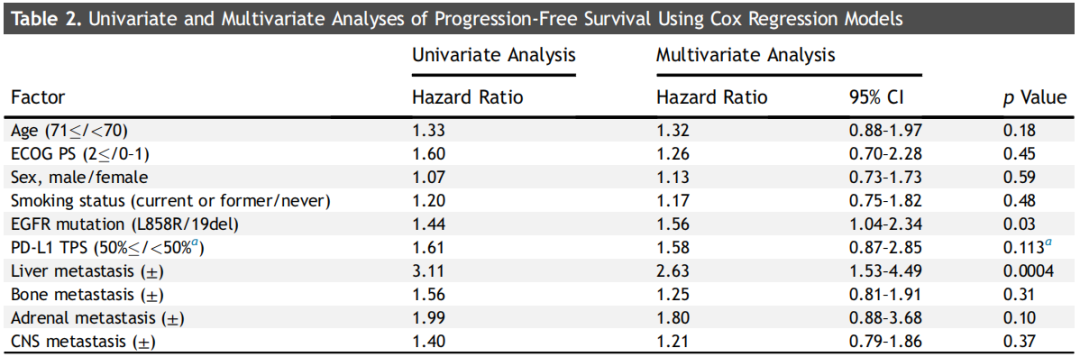
表2
此外,研究者根据基线时的转移扩散情况评估了EGFR突变亚型(19del vs. L858R)对PFS的影响。值得注意的是,在基线时无脑转移的患者中,19del和L858R患者的PFS无差异(24.0个月vs 26.7个月;HR=1.26,95%CI:0.77-2.07,p=0.3479),而在脑转移患者中,L858R患者的PFS显著短于19del患者(12.8个月vs 24.1个月;HR=2.13,95%CI:1.10-4.12,p=0.0251)。
OSI治疗期间根据EGFR突变亚型的不同进展模式:
进展模式总结于图3A至C。在治疗过程中,107例患者出现疾病进展,其中67例(63%)接受了后续治疗。常见的疾病进展部位包括胸内病变(60%)、胸外病变(43%)和CNS(21%)。涉及CNS转移灶的伴随疾病进展在L858R患者中显著更常见(p=0.048),而涉及原发病灶的伴随疾病进展在19del患者中显著更常见(p=0.01)。在治疗开始时有CNS转移的患者比没有CNS转移的患者表现出更频繁的CNS转移进展(40% vs 6%,p<0.0001)。在基线时有CNS转移的患者中(无论是否接受过放疗),与19del相比,L858R的患者随着时间的推移发生CNS转移的概率更高(对数秩检验;p=0.027)(图3D)。相比之下,在基线时无CNS转移的患者中,19del和L858R患者的CNS转移进展概率无显著差异(对数秩检验;p=0.15)(图3E)。
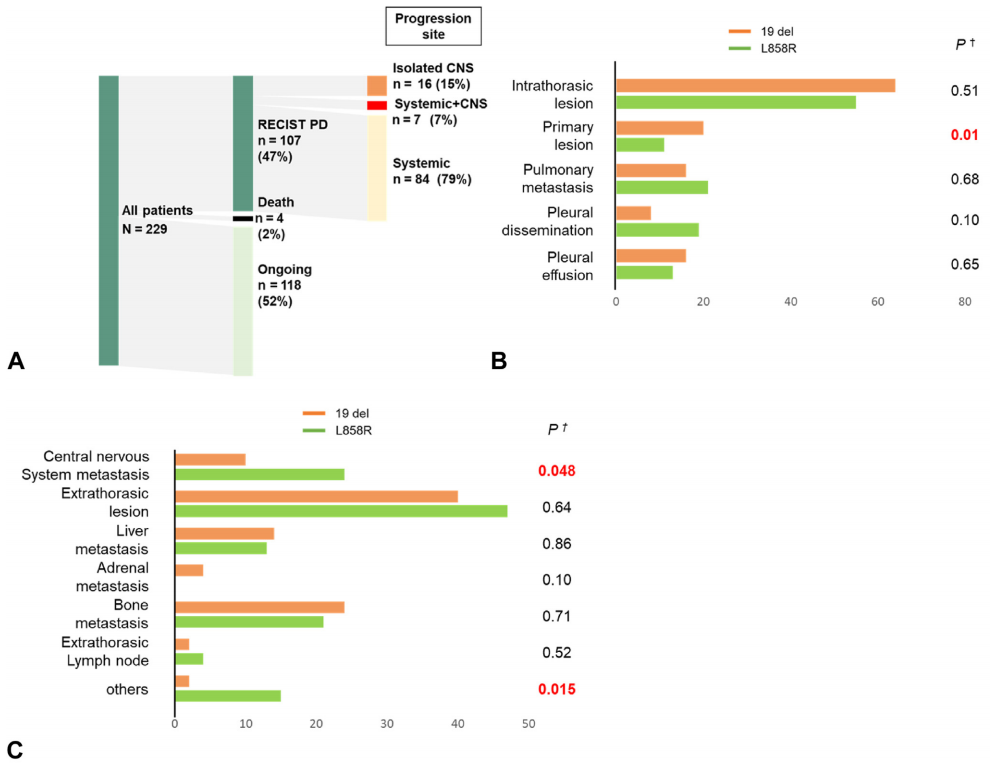
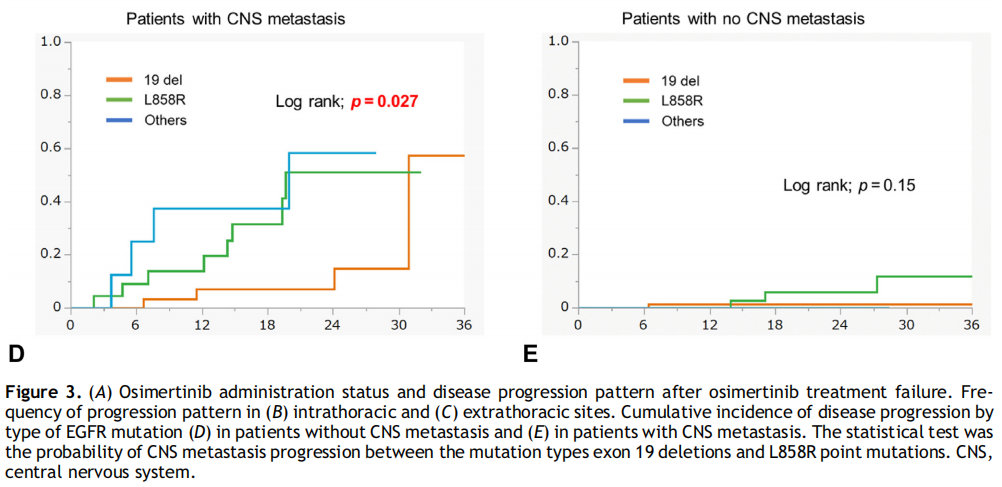
图3
讨 论
研究者评估了OSI治疗在携带EGFR突变的未经治疗NSCLC患者中的临床结局,并确定了影响OSI治疗临床结局的转移状态和突变亚型。此外,研究者观察到在OSI治疗期间,与19del患者相比,L858R患者伴随中枢神经系统转移进展更为常见。本研究数据提示,应根据突变亚型和转移扩散制定治疗策略。
本研究数据显示,一线接受OSI治疗的患者中位PFS和OS分别为23.3个月和33.7个月,其中L858R和罕见突变患者的PFS明显短于19del患者。这些结果与FLAURA研究(19del:21.4个月;L858R:14.4个月)和其他研究的结果一致。总体而言,EGFR TKIs(包括OSI)对19del患者的疗效优于对L858R患者。EGFR TKIs对19del和L858R的疗效存在差异的原因之一是L858R的位置与ATP结合位点有一定距离,而19del是酪氨酸激酶结构域α螺旋中一个必需残基缺失导致的结构变化。其次,尽管由于致癌活性,激酶结构域内缺乏配体的二聚化常见,但L858R的活性依赖二聚化,而19del的活性不依赖二聚化。第三,19del和L858R中的二聚化后自磷酸化位点不同,后续下游信号通路也不同。
关于罕见突变,临床前数据表明,除外显子20插入突变外,OSI对大多数罕见突变均有活性。罕见突变在第18-21号外显子中有异质性分子变异,OSI的临床疗效差异取决于罕见突变的类型。最近的一项详细研究发现,基于结构和功能的方法可预测EGFR突变(包括罕见突变)患者的临床结局和药物敏感性。研究者对罕见突变的研究结果与之前两项研究的结果一致(中位PFS:8.2个月和9.5个月)。
研究者还评估了基线转移部位和进展部位如何影响初始EGFR突变NSCLC患者一线OSI治疗的临床结局。与其他转移部位相比,存在肝转移对OSI治疗效果的影响最大,这与既往报道一致。据报道,EGFR突变NSCLC伴肝转移患者的临床结局不良,不仅见于接受OSI治疗的患者,也见于接受其他第一代和第二代EGFR TKIs治疗的患者。之前的报告已经揭示,肝转移的肿瘤微环境中血管内皮生长因子的表达增加,并且在EGFR突变的NSCLC中,活化的EGFR信号通路以非缺氧的方式驱动血管内皮生长因子的表达。这些因素导致了伴肝转移的EGFR突变NSCLC对EGFR TKIs耐药。
携带EGFR突变的晚期NSCLC患者在EGFR TKI治疗期间的进展模式多种多样。重要的是,约有一半的EGFR突变NSCLC患者发生脑转移,而高达40%的患者在对EGFR TKI治疗产生初始反应后的病程中会发生CNS转移。因此,研究者根据突变类型评估了OSI治疗对CNS转移的疗效和不同的进展模式。值得注意的是,在CNS转移的患者中,OSI治疗L858R的疗效低于19del(12.8个月vs. 24.1个月,p=0.02)。相比之下,在无CNS转移的患者中,19del和L858R的OSI治疗效果无显著差异(24.0个月vs. 26.7个月,p=0.35)。此外,无论基线时是否存在CNS转移,与19del患者相比,L858R患者中CNS转移是明显更常见的进展部位。在基线时无CNS转移的患者中,19del和L858R患者的进展概率无显著差异。这些结果可能受到OSI治疗L858R NSCLC患者较19del患者PFS更短和IC反应更低的影响。在本研究中,与L858R患者相比,19del患者接受了更多的脑转移放疗(46% vs. 11%,p=0.0023),提示脑放疗和EGFR TKI的协同疗效是导致不同进展模式的另一个原因。与EGFR野生型患者相比,19del患者有更多的脑部病变和较小的脑水肿,这可能会导致放疗。放疗增强了药物对血脑屏障的穿透,从而提高了EGFR TKI的有效浓度。事实上,之前的报告显示,在伴脑转移的EGFR突变阳性NSCLC患者中,放疗和EGFR TKI联合治疗的结局优于TKI单独治疗。由于对转移的基因组成了解有限,19del和L858R之间CNS转移发生差异的生物学原理仍不清楚。耐药突变和共现突变的差异可能决定CNS转移进展的风险。事实上,虽然原发病灶和CNS转移灶之间在EGFR突变方面的关联已经得到证实,但CNS转移灶中出现EGFR外显子20 T790M耐药突变的情况相对少见。此外,在同时存在TP53突变的肿瘤中,EGFR外显子20 T790M耐药突变的发生率可能较低,并且其中一些伴随突变(包括TP53突变)会影响EGFR TKI治疗患者的较差临床结果。本研究数据为考虑基于EGFR突变亚型的其他治疗策略以预防或延缓CNS转移提供了理论依据。
本研究有几个局限性。首先,这是一项对日本人群的回顾性、单中心研究。其次,评估放射治疗应答的间隔期取决于治疗医师,因此存在潜在偏倚。尽管如此,所有患者均接受了计划的随访和影像学评估。第三,由于OSI治疗失败后难以收集组织,因此无法评估耐药突变和共发生突变。最后,研究者无法评估与OSI治疗疗效相关的初始耐药突变,也无法评估癌症耐药的生物学。
本研究结果阐明了与一线OSI治疗结果相关的转移模式和EGFR突变类型,并提示依赖于EGFR突变类型的不同进展模式可能对确定EGFR突变NSCLC患者的治疗策略很重要。
参考文献:
Takeyasu Y, Yoshida T, Masuda K, et al. Distinct Progression and Efficacy of First-Line Osimertinib Treatment According to Mutation Subtypes in Metastatic NSCLC Harboring EGFR Mutations. JTO Clin Res Rep. 2024;5(2):100636. Published 2024 Jan 18. doi:10.1016/j.jtocrr.2024.100636

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#非小细胞肺癌# #EGFR突变# #奥希替尼#
78