凌腾医药开展双特异性抗体用于胃癌全球临床3期试验
2020-07-15 药明康德 药明康德
7月15日,凌腾医药宣布其在研抗体药物分子卡妥索双抗(catumaxomab)已获得中国国家药品监督管理局(NMPA)颁发的药物临床试验许可,

据此,他设计出了三功能双特异性抗体,并且选择了腹腔肿瘤广泛表达的EpCAM表皮粘附因子。作为肿瘤靶点,该因子并非主要生长信号通路,单独抑制并不能阻止肿瘤细胞生长,因而在单抗开发领域频频受阻。而Catumaxomab不仅能够识别肿瘤表面靶点,而且其另一Fab臂能够识别T细胞上的特异性CD3分子靶点,并且通过利用工程化的Fc臂特异性地与免疫附属细胞的CD32A结合。
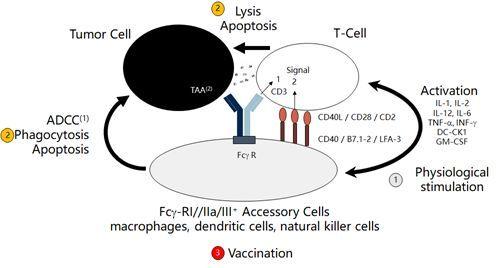
catumaxomab分子作用机制
通过这三方的协同作用,Catumaxomab得以一方面利用体液免疫,一方面激活细胞免疫,同时还能通过免疫附属细胞提供共同激活信号,三管齐下,清除顽固肿瘤细胞,并让人体免疫系统产生一定的免疫记忆,起到癌症疫苗的效果,抑制肿瘤的转移与复发,成为最早获批上市的对实体瘤治疗有效的双抗免疫疗法。
Catumaxomab抗体分子的发明获得了学术界及产业界的认可。乘胜追击,Lindhofer博士成立了Trion Pharma公司进行药物的临床前开发。他放弃了缺乏行业资源的财务投资人,也没有采纳对药物开发导向更为强势的跨国药企的投资提议,最终接受了来自欧洲医疗器械公司费森尤斯(Fresenius)的股权投资。双方共同负责产品的临床研究以及上市后的销售。该产品由于在科学设计上的超前以及选择的适应症独特,临床开发仅用了大约3年时间便已完成。Catumaxomab在2009年正式获得EMA批准在欧洲上市,成为全球第一个上市的双特异性抗体。
Heiss教授极具洞察力地指出Catumaxomab的免疫治疗对于EpCAM阳性肿瘤有显著效果,而且对部分免疫功能良好的患者延长总生存期亦有裨益。根据他主持进行的II/III期随机对照关键临床研究,共有258例卵巢癌、胃肠癌、乳腺癌转移以及胰腺癌晚期患者入组。他们的肿瘤都经过手术和化疗,而且出现了恶性腹水。但是经过Catumaxomab腹腔给药治疗之后,他们的无穿刺生存期从11天延长到了46天(HR=0.254, P13%的患者(正常人20%~30%)的总生存率,治疗组为131天,对照组仅41天(HR=0.518, P=0.0072)。[2]
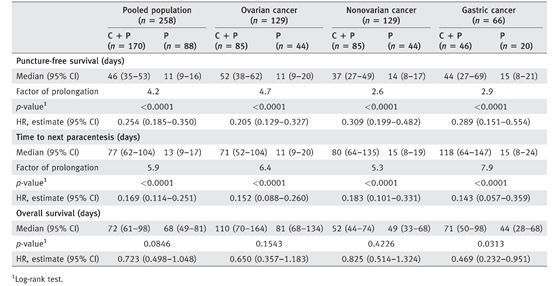
258例临床试验(肿瘤亚组)生存期情况
尽管接受Catumaxomab治疗的2000余名患者,未有一例出现药物相关性死亡,但研究者从一开始就保持着非常谨慎的态度。当时业界对肿瘤免疫的理解远不如今天,他们并不清楚哪些患者会从免疫疗法中获益。在临床应用中观察到,免疫系统被药物激活后,患者出现了包括发热、恶心、呕吐等副作用,一开始研究者认为这些副作用会影响临床治疗效果,后来回顾分析发现,有副作用(如发热)的病人反而治疗效果好。
又如HAMA反应(人抗鼠抗体反应,Catumaxomab是鼠源抗体),当时这个现象被当成了不良反应,甚至有人认为Catumaxomab就是因为这个不良反应以及细胞因子风暴而退市的。但从今天看来,病人之所以能产生抗鼠抗体,恰恰证明机体的免疫系统仍可运作,没有被多轮化疗所抑制,从而可以有效被Catumaxomab激活,参与到肿瘤的清除中。对关键研究的事后分析发现,HAMA阳性患者的预后明显好于阴性患者:无穿刺生存率64天v.s. 27天,(HR=0.33,P

HAMA反应对病人生存期影响
在2011年美国临床肿瘤学会(ASCO)年会上,Lindohfer博士也曾公布关于Catumaxomab(Removab)的两项研究成果。数据是两个独立的研究小组使用Catumaxomab治疗恶性腹水和胃癌获得的,显示Catumaxomab能够让患者产生长期免疫反应。按照他当时的计划,下一步研究要建立免疫反应与患者生存期之间的联系,遗憾的是,该计划却最终因为2013年产品停产而未能完成。
2)腹水适应症:被认为是辅助用药
Catumaxomab在适应症和治疗对象的选择上也走了一些弯路。早期试验观察到最明显的疗效之一,就是给药后病人腹水的消退。出于保证成功率的考量,研究团队选择此适应症进行上市申报。Heiss教授曾经很遗憾地表示,尽管当时知道,发生恶性腹水基本都伴发于原发肿瘤腹腔转移,换而言之,腹水很可能是腹腔转移癌的表现。而腹水消退其实是因为腹腔转移癌被免疫系统所清除,但考虑到预算和风险,他们还是选择了保守的申报策略,用最低成本、最快速度保证产品成功上市。
腹水消退和腹腔转移癌这两个适应症在临床医生看来是治标和治本的差别。腹水是癌症晚期病人的并发症之一,临床上经常对这部分病人直接进行简单插管引流,因为药物治疗已经很难有效。Catumaxomab的腹水适应症和免疫激活反应经常会让第一次接触它的医生误以为是一个副作用明显的辅助治疗药物。尽管EMA批复的适应症中并没有要求腹水的体积,大多数医生还是以为需要有大量腹水出现时考虑使用,而不是在腹腔肿瘤转移的早期使用。
3)销售策略:成也萧何败也萧何
Catumaxomab的发明人Lindhofer博士曾于90年代任职于Helmholtz Center Munich研究中心。在这里,他开始了双抗的开发及专利申请。1998年,Lindhofer博士创业,他带着之前的专利创立了Trion Pharma公司,继续开发双抗药物。随后与费森尤斯公司接触。当时费森尤斯公司希望拓展边际业务,将生物医药纳入自己的经营板块,因此双方一拍即合。费森尤斯公司成立了Fresenius Biotech入股Trion Pharma,支持其药品研发。
在合作之初,费森尤斯公司认为自己对生物医药领域并不熟悉,因而给了Lindhofer博士极大的研发自由,并在Trion Pharm保持小股东的身份。双方决定由 Lindhofer博士及其研发团队负责药物开发、生产及临床试验,费森尤斯公司负责提供资金支持和上市后的销售推广。双方早期的默契合作使得药物开发进展迅速,合作第6年,Catumaxomab即成功在欧洲获批上市。这一阶段Lindhofer博士及其团队功不可没。
但是,此时由于费森尤斯公司的战略转型,在Catumaxomab上市后,公司未为该项目建立专业的销售团队,也未对该创新性产品制定合理的价格和营销方案,更未充分将药物对延长病人生存期的疗效作为主要亮点推广,直接导致了此药在商业上的惨败。由于Catumaxomab销售额惨淡,在没有后续投资的情况下,该项目无力延续,最终费森尤斯公司和Lindhofer博士选择了“分手”。费森尤斯公司将Fresenius Biotech(更名为Neovii Biotech GmbH)整体出售给以色列公司Neopharm,退出游戏。而Lindhofer博士则成立了Lindis Biotech公司,将双抗药物平台及Catumaxomab产品相关的资产、专利与生产技术收回手中。
回顾Catumaxomab的研发上市过程,堪称一波三折。今天的创业公司常常把成功归结于时代造英雄,而一个公司或者产品的诞生,早一步,晚一步,或在策略上错一步,都可能面临失败的命运。曾经的Catumaxomab犹如一个早产儿,匆匆来到世界,然后又匆匆离开,还来不及证明自己存在的价值。
结语:老骥伏枥志在千里

Lindhofer博士在深圳
不久前,Lindhofer博士到访深圳,他在报告中详细阐述了Catumaxomab的研发过程,依然对Catumaxomab充满信心。“现在是免疫治疗的时代了,大家也终于意识到全面调动免疫系统的必要性。我们有了新的机会。”Heiss教授说:“应该把产品的适应症确定为腹腔转移癌,而不是恶性腹水;把患者的总生存期确定为临床观察终点,同时充分研究免疫作用机制在改善患者总生存期方面的作用,这样就能清晰地反映治疗的效果以及解释药物的作用机制。如果设计一个新的试验,Catumaxomab的使用应该在早期,甚至在紧接着手术切除之后。”业界对这点也十分看好,在去年刚公布的《胃癌腹膜转移防治专家共识》中,已经提及“Catumaxomab 作为‘未在中国上市的药物’,很有可能给患者带来获益。”[4]
由于Catumaxomab在晚期胃癌肠癌同样有着优异的表现,Lindhofer博士决定与中国的公司建立合作,让Catumaxomab登上更大的舞台。目前该产品于去年已在德国的CMO公司启动生产恢复,将于今年启动重新上市的申请以及新的适应症的开发。从药物研发的角度看,从失败中开发出来、销量领先的重磅药物不在少数,Catumaxomab是成是败还要看此后的临床研究,希望此药在不久的将来为更多患者带来福音。
参考文献:
1.The trifunctional antibody catumaxomab for the treatment of malignant ascites due to epithelial cancer results of a prospective randomized phase II/III trial. Int. J. Cancer: 127, 2209–2221 (2010)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#特异性#
68
双特异性抗体是热点,但是也不一定都有效!
76
#医药#
64
#特异性抗体#
68
#3期试验#
52
#胃癌#暂时无法评价这个药物可能对于胃癌的影响,从机制来说应该是有用的,但是事实上面还需要看临床的验证。
180