CDK4/6抑制剂在乳腺癌治疗中耐药机制和改进策略
2022-10-12 缪可研 同写意Biotech
乳腺癌是女性最常见的恶性肿瘤,约占全球所有恶性肿瘤的24.5%。乳腺癌根据雌激素受体(ER)、孕激素受体(PR)和HER2状态分为三个亚型:激素受体(HR)阳性、HER2阳性和三阴性亚型。其中,HR阳
乳腺癌是女性最常见的恶性肿瘤,约占全球所有恶性肿瘤的24.5%。乳腺癌根据雌激素受体(ER)、孕激素受体(PR)和HER2状态分为三个亚型:激素受体(HR)阳性、HER2阳性和三阴性亚型。其中,HR阳性乳腺癌约占60%–70%。目前,内分泌治疗被认为是HR阳性乳腺癌的主要治疗方法。尽管晚期疾病的治疗有显著改善,但很大一部分患者最终对内分泌治疗产生耐药。研究表明,导致内分泌耐药机制主要包括ER丢失或突变、ER通路的改变、细胞周期信号分子的失调和各种逃逸通路的激活等。由于内分泌治疗耐药的出现,使得研究人员急需寻找新的乳腺癌治疗靶点,例如细胞周期蛋白依赖性激酶 (CDK) 4/6抑制剂。
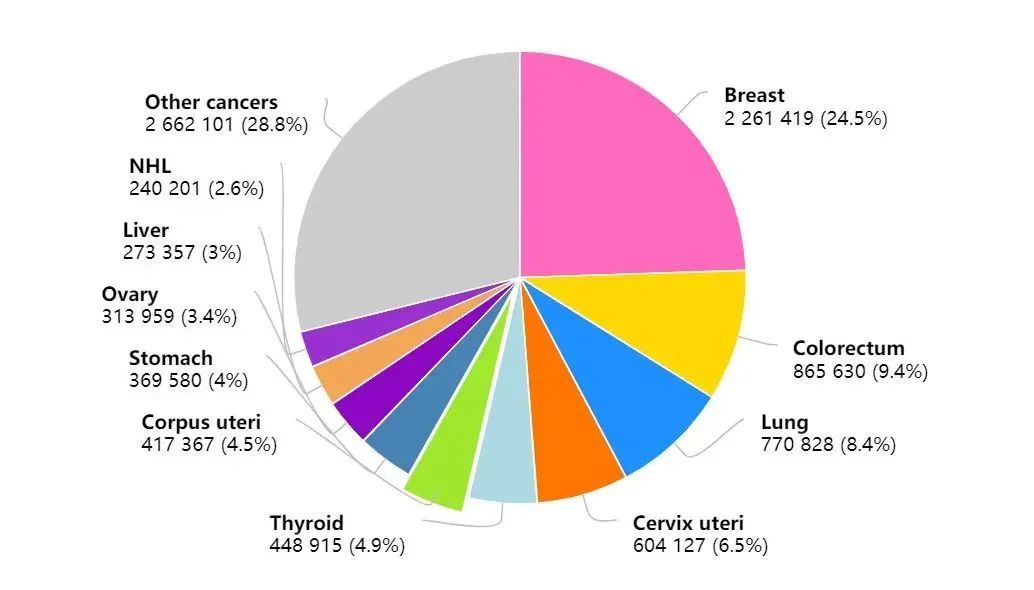
图1.2020年全球癌症发病率汇总
一、CDK4/6的生物学功能及致病机制
人类细胞周期蛋白依赖性激酶(CDK)家族包含20多种CDK和多达30种不同的细胞周期蛋白。周期蛋白依赖性蛋白激酶CDK是细胞周期调控中的重要因子,是一组丝氨酸/苏氨酸蛋白激酶,可以催化丝氨酸/苏氨酸蛋白磷酸化,同时与周期蛋白cyclin协同作用进而驱动细胞周期。CDK可以和cyclin结合形成异二聚体,其中CDK为催化亚基,cyclin为调节亚基,不同的cyclin—CDK复合物,通过CDK活性,催化不同底物磷酸化,而实现对细胞周期不同时相的推进和转化作用。此外,CDK4/6可以磷酸化视网膜母细胞瘤基因(RB),释放转录因子E2F,促进细胞周期相关基因的转录,促进细胞周期从G1有丝分裂期进入S期,导致DNA复制过程(图2)。

图2.CDK4/6的作用机制
研究表明,CDK4/6在癌症中的过度活跃,在许多肿瘤中的表达水平显着升高。过表达的 CDK4/6通过直接和间接(通过刺激 CDK2)磷酸化Rb促进G1/S转化,促进肿瘤的发生。此外,研究人员通过对乳腺癌的转录组分析发现CDK4可以调节炎症细胞因子信号传导过程。CDK6也可以诱导血管生成、干细胞活化、免疫反应等。研究表明,许多癌基因可以通过激活CDK4/6-Rb-E2F通路并诱导细胞恶性增殖导致癌症发生,主要包括JAK/STAT、PI3K/Akt/mTOR、RAS/RAF/MEK/ERK、BTK/NF-κB和Wnt/β-连环蛋白等途径。此外,p53等肿瘤抑制基因的突变也可以通过释放p21 CIP1抑制作用来激活CDK4/6-Rb-E2F通路。因此,CDK4/6可以充当肿瘤发生途径的中枢。此外,研究发现敲除CDK4/6基因可以抑制肿瘤细胞生长,而不会对正常细胞生长造成影响。因此,基于CDK4/6这些特性,使得CDK4/6成为极具临床潜力且安全的靶点。
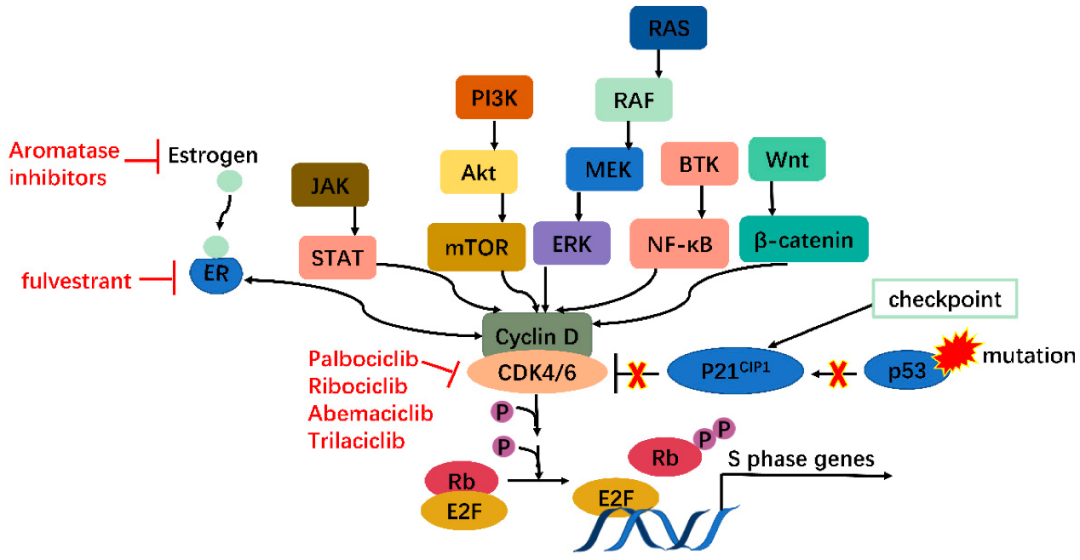
图3.CDK4/6介导的致病机制
二、CDK4/6抑制剂的耐药机制
尽管CDK4/6抑制剂极大改善了对HR阳性乳腺癌患者的疾病控制,但并非所有患者都对这些药物有效,而且大多数癌症患者在使用CDK4/6抑制剂后都会出现获得性耐药的现象。CDK4/6抑制剂的耐药机制可分为细胞周期特异性耐药和细胞周期非特异性耐药。研究表明CDK4/6抑制剂的耐药机制主要包括持续的G1-S期细胞周期蛋白表达和其他旁路信号介导的早期和晚期适应等。此外,还存在各种其他机制,这些机制也会导致对CDK4/6抑制剂的内在或获得性耐药。
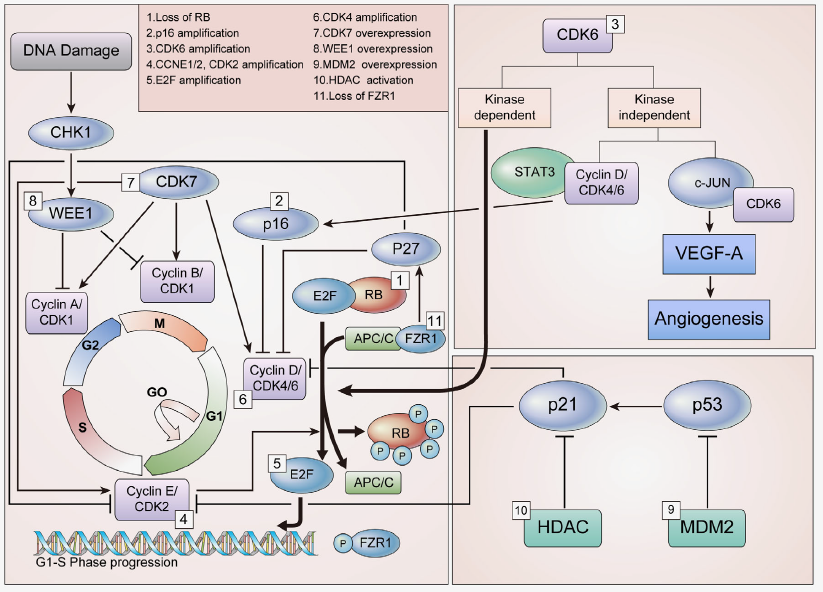
图4.CDK4/6抑制剂的耐药机制
1、RB缺失
肿瘤抑制因子RB是上述细胞周期中的关键检查点。作为CDK4/6抑制剂的主要靶点,RB被认为是治疗敏感性最重要的生物标志物之一。各项临床前研究 均表明RB的缺失是CDK4/6抑制剂产生耐药性的主要因素。此外,一些临床前和临床研究也报道了RB的突变是导致耐药性的原因。一项使用胶质母细胞瘤异种移植细胞的研究发现,RB (A193T) 外显子2中的错义突变导致对CDK4/6抑制剂耐药。
2、p16过表达
p16是INK4家族成员,是CDK4的天然抑制剂,是参与细胞周期调控的重要肿瘤抑制因子。p16在功能性RB存在下可作为肿瘤抑制因子起作用,因为 CDK4/6(p16的靶标)需要RB来发挥其自身的激酶活性。研究发现,p16的过表达发生在致癌应激期间。当在功能性RB存在下,p16过表达,通过抑制CDK4的表达而使得CDK4/6抑制剂产生耐药。
3、E2F过表达
E2F是RB的下游转录因子。RB-E2F复合物在调节细胞周期从G1期到S期的进程中起重要作用。细胞周期蛋白D-CDK4/6可以磷酸化RB,释放出E2F,从而导致细胞周期进程所需的蛋白的表达,包括细胞周期蛋白E。此外,细胞周期蛋白E-CDK2复合物也能使RB磷酸化,释放E2F并促进进入S期。RB的缺失与E2F的表达增加相关,导致其下游靶蛋白的组成型激活,进而导致耐药发生。
4、激活FGFR通路
成纤维细胞生长因子受体 (FGFR) 信号通路参与关键的生物学过程,如增殖、分化和细胞存活。FGFR通路经常在包括乳腺癌在内的多种癌症中被激活。据报道,在五种FGFR中,FGFR1-4在癌症进展中起重要作用。此外,FGFR1和 FGFR2似乎也与对CDK4/6 抑制剂的耐药性以及内分泌耐药性有关。机制研究表明,FGFR1扩增激活了内分泌耐药乳腺癌细胞中的PI3K/AKT和RAS/MEK/ERK信号通路。此外,FGFR通路主要通过FGF2扩增激活导致耐药,而非FGF3、FGF4和FGFR1。
5、激活PI3K/AKT/mTOR通路
PI3K/AKT/mTOR信号通路在大约30%–40%的乳腺癌中被激活,特别是在 HR阳性亚型中。已知该途径的异常是对内分泌治疗耐药的关键因素。此外,最近还报道了PIK3/AKT/mTOR通路与对CDK4/6抑制剂耐药的相关性。例如,在CDK4/6抑制剂耐药的乳腺癌细胞中,相比于ER信号,其生长更依赖 PI3K/AKT/mTOR信号。此外,在CDK4/6抑制剂耐药细胞系中也注意到磷酸化 RB和E2F的再激活可能通过CDK途径以外的途径发生,例如mTOR途径。因此,抑制mTORC1/2可以抑制CDK4/6抑制剂耐药细胞中的磷酸化RB和E2F的表达,从而恢复了对CDK4/6抑制剂的敏感性。
6、ER或PR表达缺失
乳腺癌细胞中cyclin D-CDK4/6活性的主要驱动因素是激素介导的ER激活。在耐阿贝西利的临床前模型中观察到ER/PR表达缺失。此外,在少数患者系列中,在CDK4/6抑制剂治疗前和疾病进展后,约有三分之七的患者出现了ER或 PR表达缺失的现象。这些数据表明,对CDK4/6抑制剂产生耐药性的一部分患者可能与ER/PR水平变化有关。
7、免疫机制
免疫相关途径与出现对各种抗癌药物的耐药性相关。据报道,在CDK4/6 抑制剂耐药的乳腺癌细胞中,发现IFN-α和IFN-β等干扰素因子的过量表达。此外在一项临床前研究中发现,CDK4/6抑制剂可促进抗肿瘤免疫效应。因此,CDK4/6抑制剂与免疫疗法相结合可能在克服对CDK4/6抑制剂的耐药性方面发挥一定作用
三、基于CDK4/6抑制剂耐药的改进策略
1、与其他内分泌药物联用
有研究报道CDK4/6抑制剂联合内分泌治疗可以克服CDK4/6抑制剂耐药。哈佛医学院的一项研究表明,对于先前接受过CDK4/6抑制剂palbociclib或 ribociclib的患者,在疾病进展后改用abemaciclib单药治疗或与内分泌治疗联合治疗可实现5.4个月的mPFS时间。此外,一项II期临床研究比较了在CDK4/6抑制剂进展后接受转换内分泌治疗ribociclib的效果。研究人员发现,与单药治疗组相比,联合治疗组的PFS时间延长了2.5个月。因此,改用其他内分泌药物联合CDK4/6抑制剂是耐药后的选择之一。
2、与PI3K抑制剂、mTOR抑制剂等靶向抗癌药物联用
PIK3CA是乳腺癌中最常见的突变基因之一。大约40%的HR+和HER2− ABC 患者有PIK3CA突变。PIK3CA突变可通过激活PI3K通路促进内分泌抗性,这与预后不良有关。作为一种α选择性PI3K抑制剂,alpelisib在SOLAR-1研究中首次证明了其疗效。在AI(芳香化酶抑制剂)治疗期间或之后进展的HR+/HER2- ABC PIK3CA突变患者的SOLAR-1研究中,alpelisib + fulvestrant组与安慰剂+ fulvestrant组比较,PFS时间延长了5.3个月,中位总生存期(mOS)延长了7.9个月(39.3 vs 31.4个月)。因此,对于内分泌治疗联合CDK4/6抑制剂治疗后出现疾病进展的PIK3CA突变患者,内分泌治疗联合PI3K抑制剂治疗可以成为患者的一种选择。
mTOR通路是PI3K下游的重要信号通路,因此mTOR抑制剂与PI3K抑制剂一样受到关注。依维莫司是mTOR抑制剂的代表,其作用已在BOLERO-2研究中得到证实。在BOLERO-2研究中,对于NSAI治疗后疾病进展的患者,依维莫司+依西美坦(SAI) 组的mPFS和mOS 时间明显长于安慰剂+依西美坦组。因此,对于对CDK4/6抑制剂耐药的患者,mTOR 抑制剂似乎是一个不错的选择。
3、与化疗药物联用
对于对内分泌治疗+ CDK4/6抑制剂耐药的HR+/HER2− ABC的患者,化疗也是一个不错的选择。在临床中,通常选择化疗作为后续治疗方案。一项研究表明,在接受CDK4/6抑制剂治疗后出现疾病进展的525名患者中,超过三分之一的患者接受了后续化疗,所用的化疗药物为卡培他滨和紫杉烷类。目前正在进行三项临床试验(NCT04251169、NCT03901339和NCT04134884)评估了ER+/HER2- 乳腺癌患者在CDK4/6 抑制剂耐药后化疗的疗效。因此,在 HR+/HER2- ABC 患者对内分泌治疗+CDK4/6抑制剂耐药后,化疗仍然是一种不错的治疗选择。
4、PROTAC策略
PROTAC技术在克服耐药性以及针对不可成药靶点方面具有巨大优势。PROTAC是一种双功能分子,它不是抑制靶点的功能,而是通过劫持泛素蛋白酶体系(UPS)来诱导整个致病靶蛋白的降解发挥治疗作用。
由于CDK4/6在细胞周期中的冗余作用,需要同时沉默CDK4/6以实现G1/S停滞。由于CDK4/6具有相似的结构特征和共同的配体,因此靶向CDK4/6的PROTAC可以同时降解这两种激酶蛋白。Kevin Burgess等人在2019年报道了第一个强效的CDK4/6降解剂Pal-pom。Pal-pom是基于泊马度胺和帕博西尼的CDK4/6 PROTAC降解剂(图5)。研究发现,Pal-pom可以以低剂量有效降解MDA-MB-231乳腺癌细胞系CDK4和CDK6,其DC50值分别为13 nmol/L和34 nmol/L,并且Pal-pom可以以剂量依赖性方式降低Rb磷酸化水平 。

图5. 基于CDK4/6 PROTAC Pal-pom的化学结构
四、CDK4/6抑制剂的研究进展
迄今为止,全球共有4款CDK4/6抑制剂获批上市(图6)。分别是辉瑞研发的palbociclib,诺华的ribociclib以及礼来abemaciclib。值得注意的是,这三种药物都是口服给药,目前已被批准用于晚期HR阳性乳腺癌患者的治疗。此外,还有一款是通过静脉注射给药,由G1 Therapeutics研发的CDK4/6抑制剂trilaciclib,被批准用于减少小细胞肺癌 (SCLC) 患者因化疗引起的骨髓抑制。
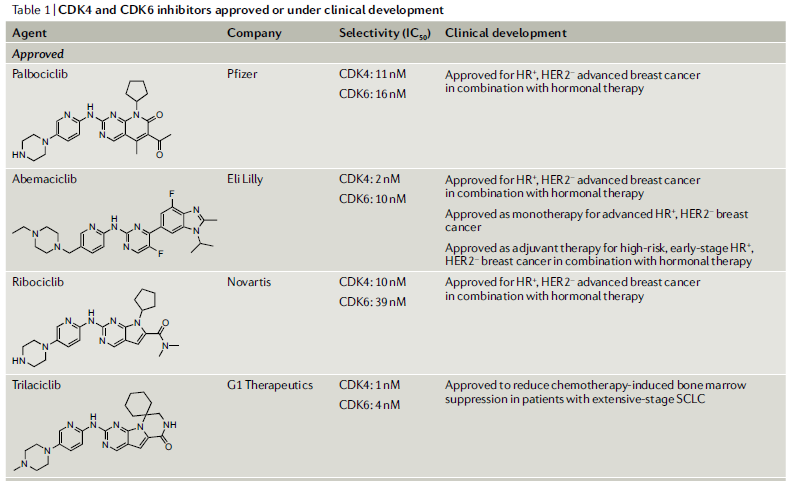
图6.已上市的CDK4/6抑制剂汇总
目前,也有多款CDK4/6抑制剂处于临床试验阶段,其中,江苏恒瑞医药的SHR6390处于临床三期,领跑国内的CDK4/6赛道。此外,倍而达药业、安进公司等药企都在CDK4/6领域进行布局(图7)。
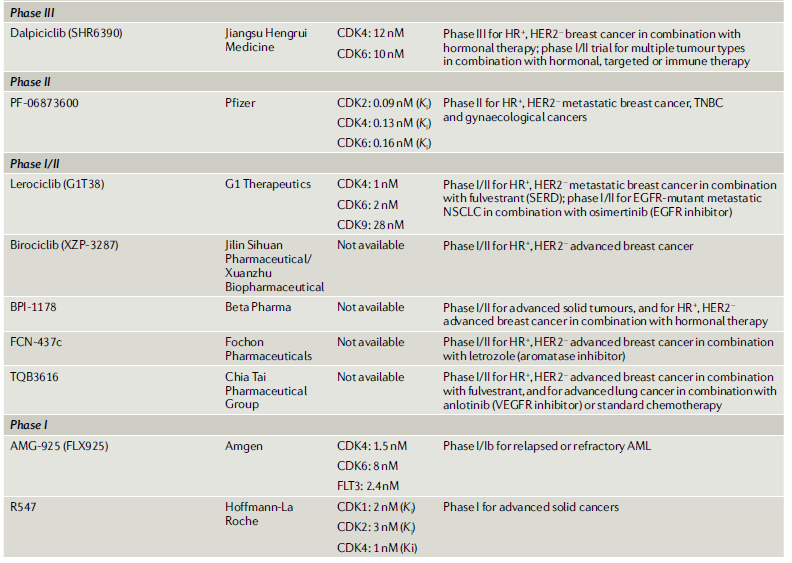
图7. 处于临床试验阶段的CDK4/6抑制剂
五、小结
在过去的几十年里,基于乳腺癌领域的药物研发已经取得了长足的进步。靶向细胞周期机制已成为治疗癌症的一种有吸引力的策略,在临床前和临床阶段都显示出积极的结果。目前全球已有三款CDK4/6抑制剂批准上市,用于治疗HR+/HER2-乳腺癌患者。但这些药物在临床使用过程不可避免出现了耐药性,限制了这些药物的治疗效果。目前,药物联用策略及PROTAC策略在很大程度上克服了CDK/6抑制剂的耐药性问题。相信随着CDK4/6抑制剂耐药性、不良反应等问题的不断解决,未来会有更多CDK4/6抑制剂被成功研发上市,有望改写乳腺癌的治疗格局,使乳腺癌患者受益。
参考文献:
1.Targeting CDK4 and CDK6 in cancer Nat Rev Cancer, 2022, 22, 356–372。https://doi.org/10.1038/s41568-022-00456-3
2.CDK4/6 inhibitor resistance mechanisms and treatment strategies. DOI: 10.3892/ijmm.2022.5184
3.Targeting CDK4/6 for Anticancer Therapy. Biomedicines 2022, 10, 685. doi.org/10.3390/biomedicines10030685
4.PROTACs suppression of CDK4/6, crucial kinases for cell cycle regulation in cancer. Chem. Commun., 2019,55, 2704-2707. doi.org/10.1039/C9CC00163H
5.CDK4/6 inhibitors in HER2-positive breast cancer. Critical Reviews in Oncology/Hematology 112 (2017) 208–214 DOI:10.1016/j.critrevonc.2017.02.022
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言