西安电子科技大学王忠良、张象涵团队Nano Letters:绕过Ca2+内流:核靶向近红外花菁光敏剂在抗转移光动力治疗中的应用
2024-12-14 BioMed科技 BioMed科技 发表于陕西省
西安电子科大团队在《Nano Letters》发研究论文,提出创新光动力疗法,开发核靶向近红外花菁光敏剂,可抑制肿瘤转移,阐述其原理、体外及体内验证情况,为癌症治疗提供新策略。
近日,西安电子科技大学生命科学技术学院王忠良教授、张象涵副教授在国际综合类顶级期刊《Nano Letters》,发表了题为“Bypassing Ca2+ Influx for Antimetastasis Photodynamic Therapy via Robust Nucleus-Targeted Near-Infrared Cyanine”的研究论文(DOI: 10.1021/acs.nanolett.4c04789)。该研究提出了一种创新的光动力疗法,开发了具有核靶向能力的近红外(NIR)花菁光敏剂,在光动力治疗原发肿瘤的同事能有效抑制肿瘤的转移,为PDT癌症治疗领域带来了新的策略。论文第一单位为西安电子科技大学,生命科学技术学院张象涵副教授为论文的第一作者,杨鹏博士、夏玉琼副教授和王忠良教授为论文的共同通讯作者。
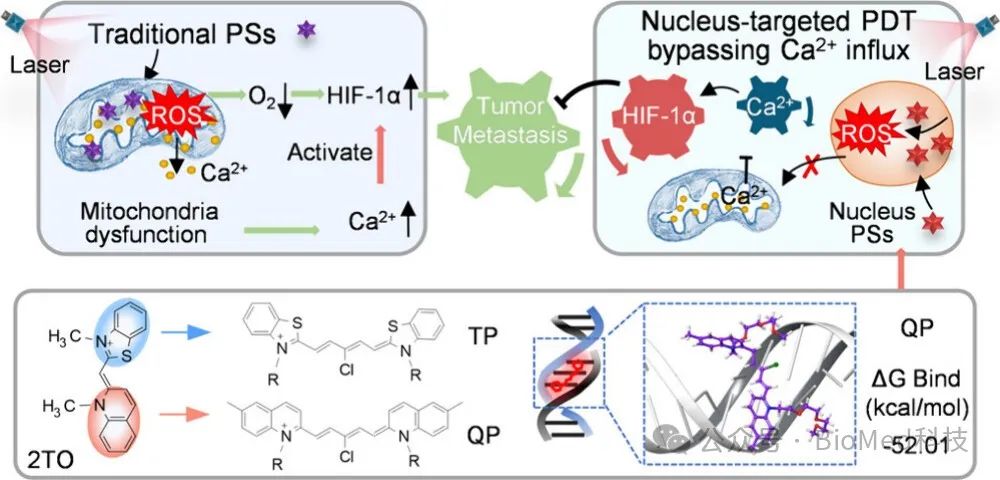
癌症转移是导致癌症患者死亡的主要原因之一,而缺氧环境是这一过程的关键诱导因素。乏氧诱导因子(HIF-1α)促进癌细胞对缺氧的适应,并作为促进转移的关键微环境因子。光动力疗法(PDT)作为一种新兴的治疗手段,在局部精准肿瘤治疗中展现出巨大潜力。然而,的氧依赖性可加剧肿瘤缺氧,进而上调HIF-1α及其下游信号通路,促进肿瘤转移,这成为PDT治疗的一大挑战。当前研究策略主要集中在缓解HIF-1α通路,但迫切需要创新的PDT方法从光敏剂源头预防转移。研究表明,传统的PDT会触发细胞质内Ca2+水平升高,进而激活HIF-1α,而降低Ca2+水平则可以抑制肿瘤转移。钙离子作为细胞内重要的信使,在HIF-1α的生命周期中发挥重要作用,从其转录到降解,从而影响HIF-1α的活性。
在PDT治疗中,传统的PSs如Ce6主要靶向线粒体,可实现PDT对原发肿瘤的高效治疗;然而,由于线粒体也是Ca2+存储和调控的关键枢纽,同时也会因ROS诱导细胞质Ca2+水平的提高,从而增强HIF-1α活性,恶化肿瘤转移。Ce6作为典型线粒体靶向PS,在激光照射后,在 Ce6 组(称为 Ce6-PDT)的细胞质内观察到Ca2+荧光增加了 3 倍(图 1b 和 c),HIF-1α 的活性和稳定性也随之增加(图 1d 和 e)。我们推测PDT 产生的 ROS 升高诱导Ca 2+从线粒体泄漏。研究人员采用钙螯合剂 BAPTA-AM联合Ce6治疗(简称 Ce6-B),降低细胞质钙离子含量同时,降低了 HIF-1α表达及活性,表明细胞内Ca2+水平与HIF-1α活性存在显著相关性。为了进一步评估 Ca2+抑制可减少线粒体靶向 PDT 后的肿瘤转移,4T1荷瘤小鼠在用 Ce6-PDT 或 Ce6-B-PDT (Ce6 + BAPTA-AM + 激光;图 1g)治疗 20 天后,肺组织的H&E染色表明 Ce6-B-PDT 组表现出相当大的抑制肿瘤转移效果(图 1h)。
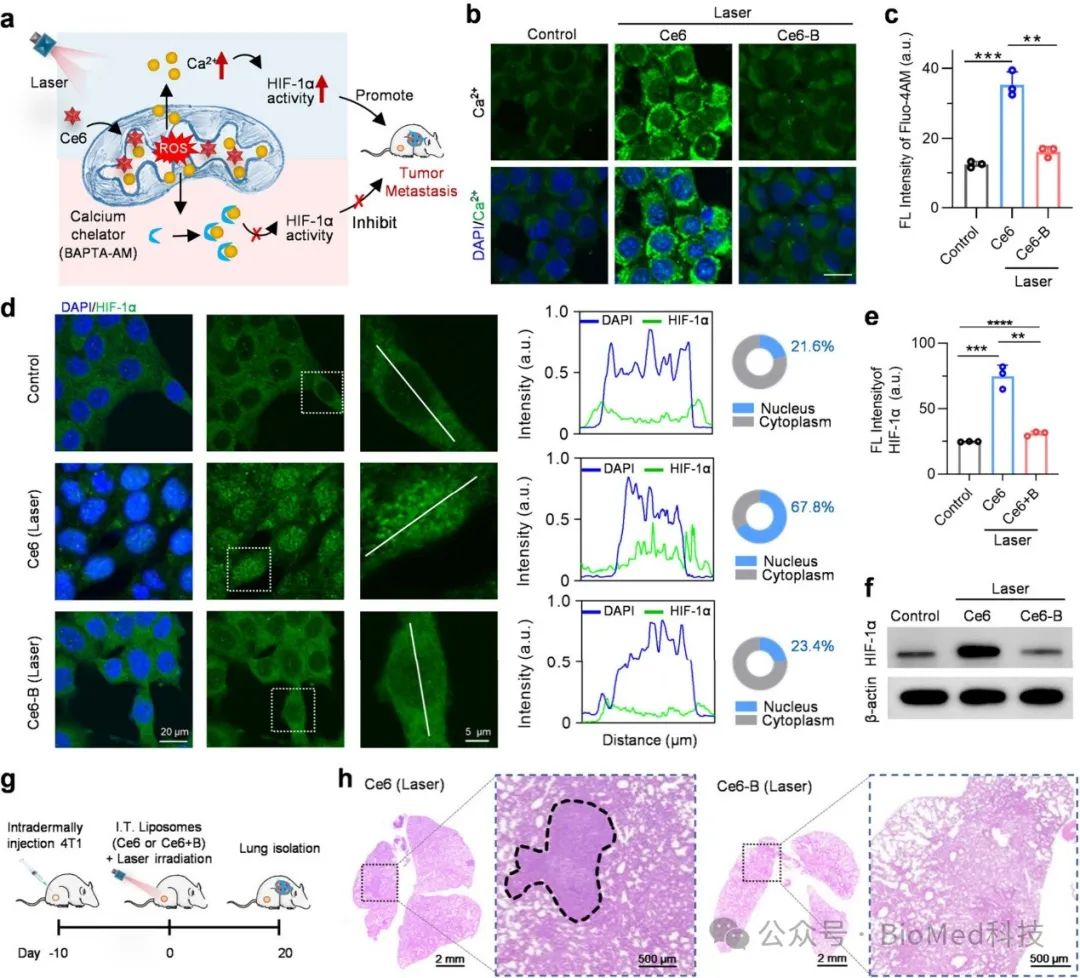
图1 抑制Ca2+减少线粒体靶向PDT引起的转移
为此,研究团队提出通过精确的细胞核靶向光敏剂(PSs)来解决PDT引起的转移问题。受经典核靶向TO探针结构的启发,通过将喹啉和苯并噻唑杂环引入花菁染料结构中,设计合成了两种核靶向光敏剂TP和QP(图2a)。首先利用分子对接的方法研究了DNA与三种PSs(Ce6、QP和TP)之间的结合能。TP和QP的吉布斯自由能较低(分别为- 60.54和- 52.01 kcal/mol),而Ce6的吉布斯自由能最高(2.31 kcal/mol),说明TP和QP具有较强的DNA结合能力(图2b)。随着DNA浓度的增加,TP和QP的荧光增强进一步证实了TP和QP都可以很容易地锚定DNA。这些共轭的PSs可以吸收660 nm的光,并特定地靶向细胞核(图2c-e)。

图2 细胞核靶向近红外花菁光敏剂的设计和表征
在细胞水平,这些核靶向光敏剂能够有效抑制细胞质内Ca2+水平的升高,并抑制HIF-1α的活性(图3c-i)。4T1细胞中Ca2+含量和 HIF-1α 相对表达之间成正相关,相关系数(R)为 0.81(图3m)。这些结果表明,该核靶向PDT方法巧妙地绕过了Ca2+通道,避免了因Ca2+大量涌入细胞内而引发HIF-1α活性升高,打破传统 PDT耗氧引发 HIF-1α活性升高所导致的转移问题,提高了抗肿瘤转移治疗的有效性(图3a)。
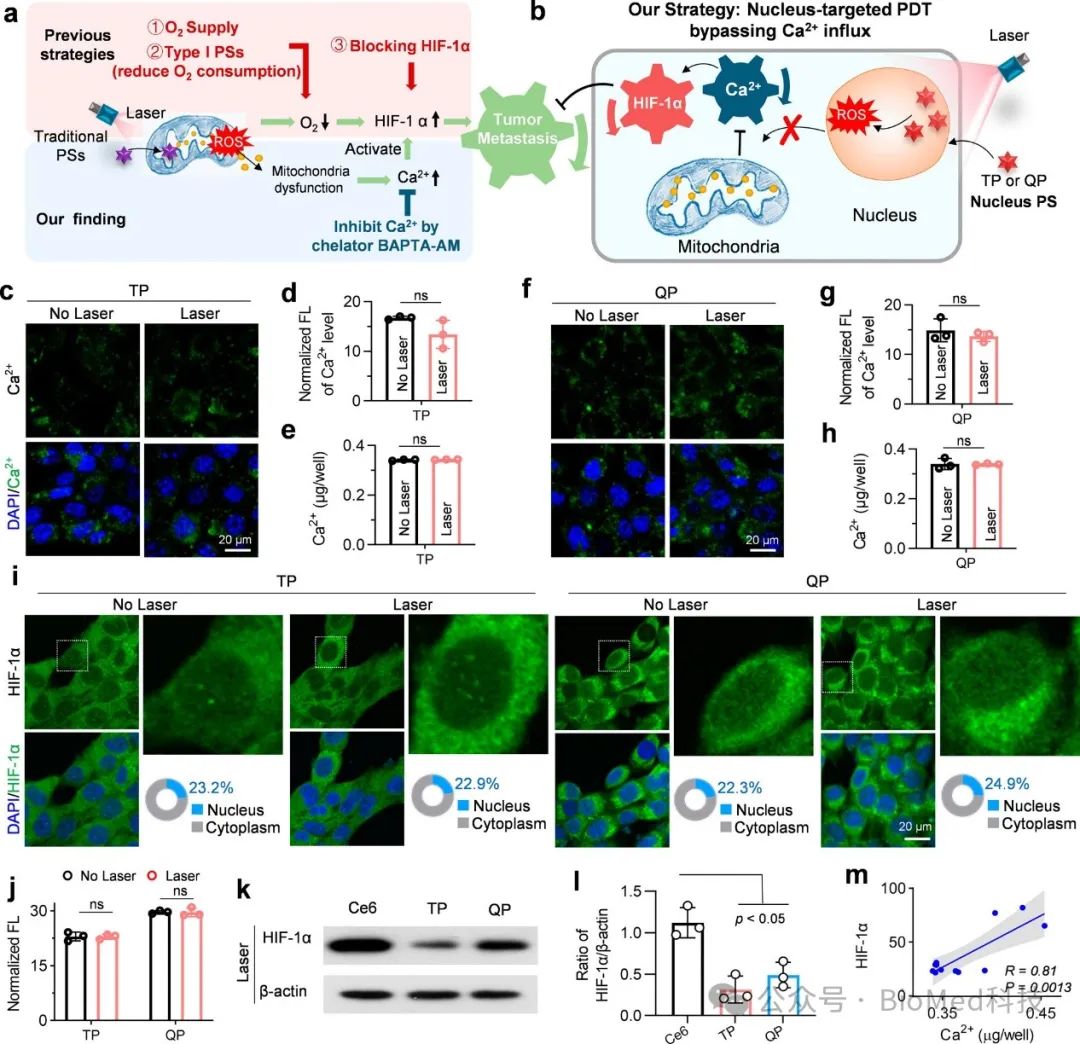
图3 细胞核靶向PDT绕过Ca2+内流并抑制HIF-1α活性
进一步验证细胞核靶向光敏剂的体外杀伤能力和抗转移能力,电子自旋共振(ESR) 分析表明PS 在激光照射下产生1O2(图 4a)。TP和QP组的的 ROS 量子产率分别约为 0.42 和 0.51(Ce6的 ROS 量子产率约0.64)(图 4b)。研究人员使用钙黄绿素-AM 和碘化丙啶的双重染色评估 PSs 的体外肿瘤细胞杀伤效率,Ce6 和 QP 组表现出比 TP 组更高的杀伤效果(图4e)。进一步,流式细胞术分析表明PDT治疗通过产生ROS诱导肿瘤细胞凋亡(Q2,早期细胞凋亡,Q3,晚期细胞凋亡)和坏死(Q1)(图 4f 和 4g)。
细胞伤口划痕实验显示,在光照后TP-PDT 和 QP-PDT 都显著抑制了细胞迁移(图 4i),Ce6-PDT 组细胞的迁移率为 35%,而 TP-PDT 和 QP-PDT 组的迁移率显著降低,分别为 17% 和 14%(图 4j),约为 Ce6-PDT 组的 1/2,尽管 Ce6 具有更高的 ROS 生成能力(图 4b,c)。这表明核靶向的 PS(TP 和 QP)比线粒体靶向的PS(Ce6)具有更强的抑制细胞迁移能力。随后,使用Transwell实验显示,与 Ce6-PDT 相比,TP-PDT 和 QP-PDT组细胞迁移能力降低(图 4k-l),这表明细胞核靶向 PDT 在降低肿瘤细胞的侵袭能力比线粒体靶向PDT更有效。总的来说,这些结果表明,细胞核靶向PDT可以显著减少癌细胞迁移和侵袭。
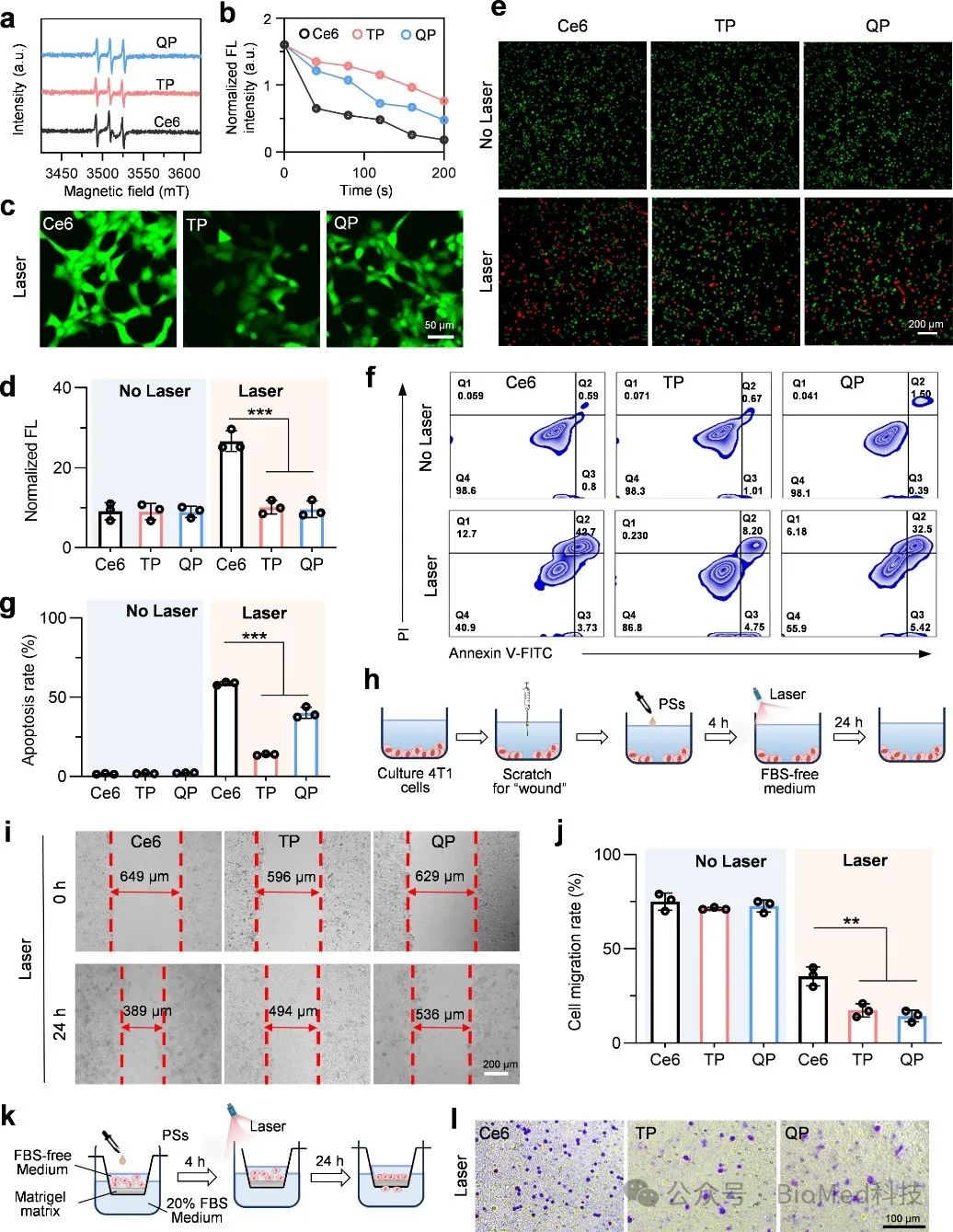
图4 核靶向PDT的体外抗转移能力
最后,研究人员在 4T1 荷瘤小鼠上评估了细胞核靶向 PDT 的体内抗转移能力(图 5a)。Ce6、TP 和QP治疗组20天后,所有原发性肿瘤均被完全抑制(图 5b)。随后,研究人员对肺组织并进行了转移评估,结果显示TP-PDT 和 QP-PDT所导致的肺转移可忽略不计,而Ce6-PDT 组观察到明显的转移结节(图 5c-5e)。值得注意的是,钙离子抑制剂联合Ce6组(Ce6-B-PDT)表现出对肿瘤转移的显著抑制。同时PDT 治疗后 24 小时原发肿瘤组织中的 HIF-1α和Ca2+进行染色结果也显示,与 Ce6-PDT 组相比,Ce6-B-PDT、TP-PDT 和 QP-PDT 组的Ca2+含量和 HIF-1α 绿色荧光信号明显降低。进一步证实了破坏Ca2+– HIF-1α 相互作用可有效减少PDT触发的转移。此外,观察到肺转移百分比与Ca2+和HIF-1α水平呈正相关(图 5i)。这些发现不仅证实了细胞核靶向 PDT 的卓越抗转移功效,而且还揭示了Ca2+ Ca2+水平和PDT 后的抗转移作用之间的关系。
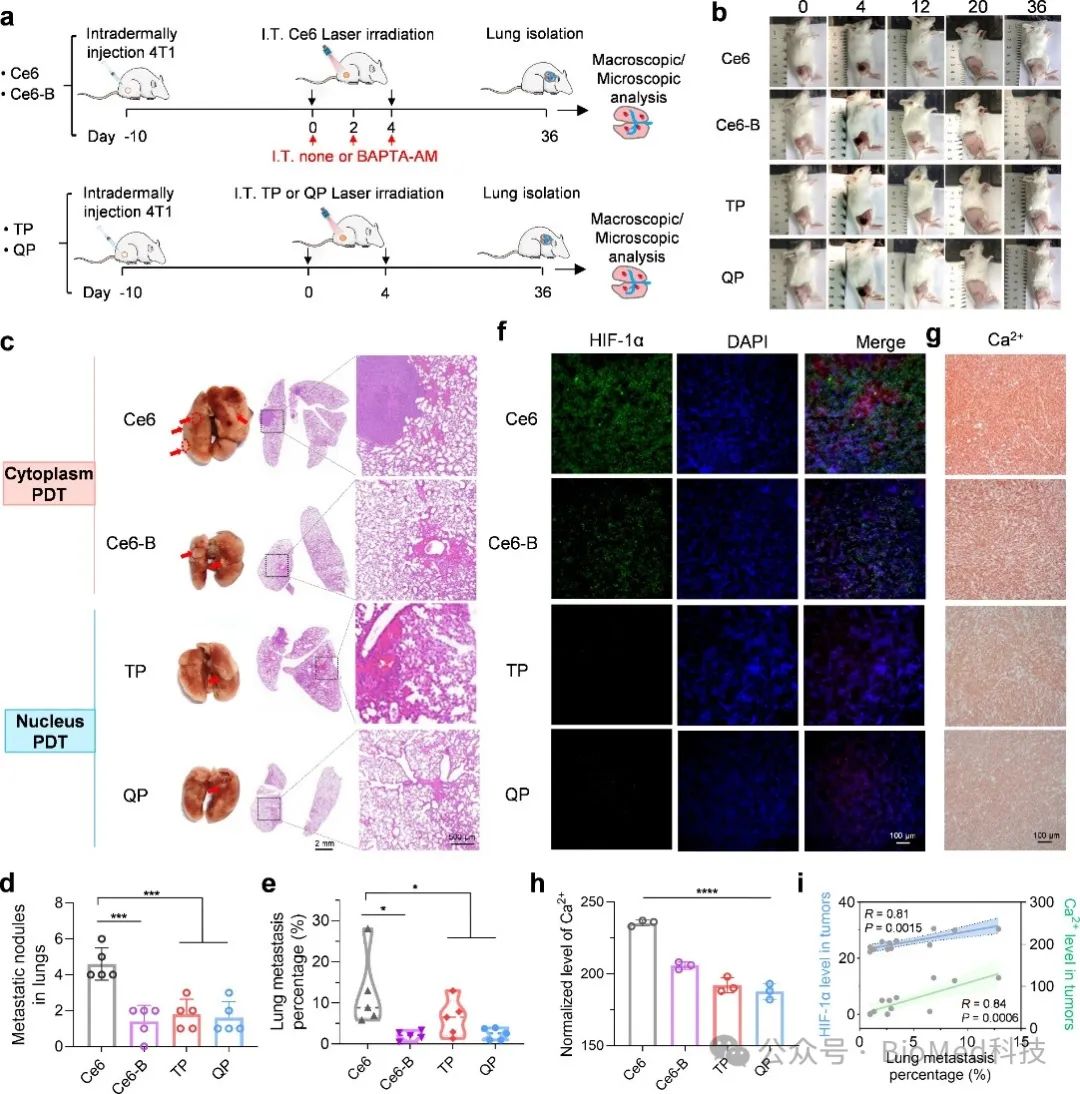
图5 核靶向PDT的体内抗转移能力
【结论与展望】
总的来说,在这项研究中,研究人员证明了传统线粒体靶向PDT触发了细胞质Ca2+水平的增加,激活HIF-1α并增强了转移。基于Ca2+在细胞质中的储存和调节作用,研究人员提出精准核靶向光敏剂从源头解决PDT诱导的转移。随后,设计了两种具有细胞核靶向能力的NIR花菁PSs,可绕过Ca2+泄露,有效降低HIF-1α活性,从而在4T1肿瘤中取得优异的PDT抗转移效果。该研究不仅为打破Ca2+−HIF-1α相互作用以防止肿瘤转移提供了新的见解,而且从PDT治疗源头提供了一种新型核靶向PSs来规避转移的有效方法。
【文献详情】
X. Zhang, H. Zhang, Q. Dong, Y. Qin, Y. Cao, H. Zhu, Z. Ma, Z. Li, Z. Rao, P. Ning, Z. Tian, Y. Xia, P. Yang, Z. Wang. Bypassing Ca2+ Influx for Antimetastasis Photodynamic Therapy via Robust Nucleus-Targeted Near-Infrared Cyanines. Nano Lett., 2024, DOI: https://doi.org/10.1021/acs.nanolett.4c04789
原文链接:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#光动力疗法# #核靶向光敏剂#
22