【Blood】CD37 CAR-T治疗CD37+淋系肿瘤的首次人体临床试验
2024-09-17 聊聊血液 聊聊血液 发表于上海
《Blood》近日报道了CD37 CAR-T治疗CD37+淋系肿瘤的首次人体临床试验。
CD37 CAR-T
CD37是一种在B细胞和T细胞恶性肿瘤中高度表达的抗原,是一个很有希望的CAR-T靶点,因其表达仅限于淋巴组织,特别是成熟B细胞,而在浆细胞和树突状细胞上的表达水平很低。CD37在皮肤和外周T细胞淋巴瘤(CTTL和PTCL)中也有表达,其预后明显差于B细胞淋巴肿瘤,因此CAR-T细胞方法的发展成为这些恶性肿瘤的重中之重。此外目前还没有FDA批准的靶向CD37的疗法,也没有CD37 CAR-T。
因此学者设计了CD37 CAR-T,《Blood》近日报道了CD37 CAR-T治疗CD37+淋系肿瘤的首次人体临床试验。
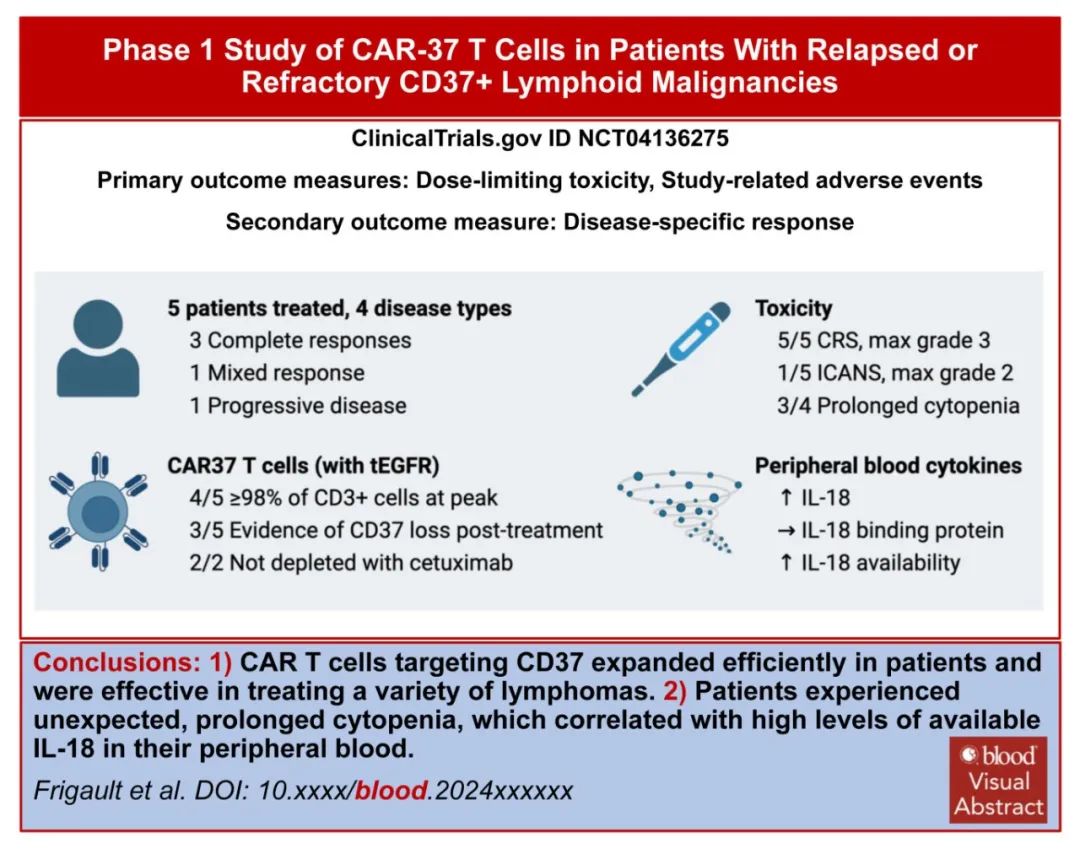
研究结果
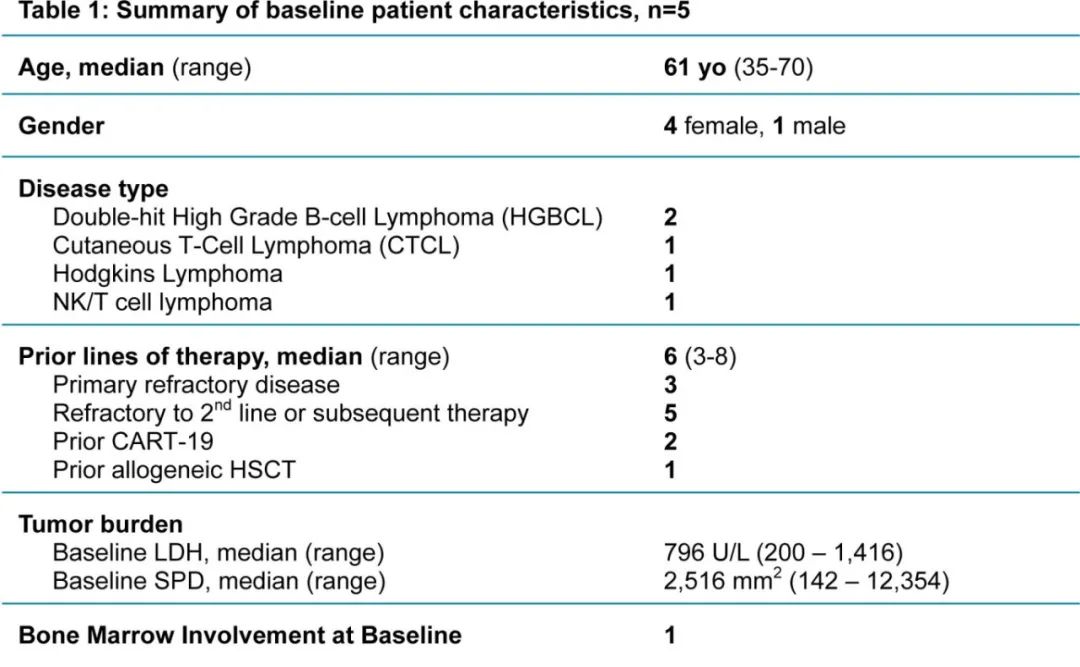
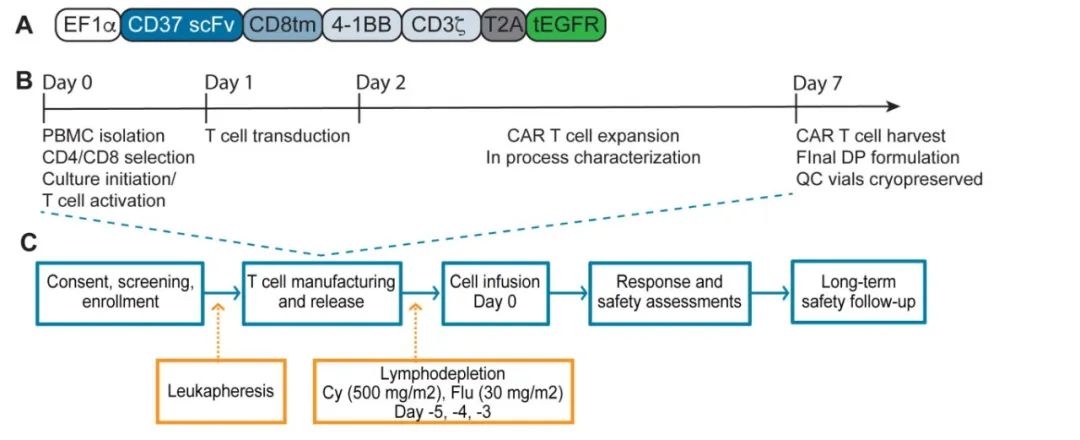
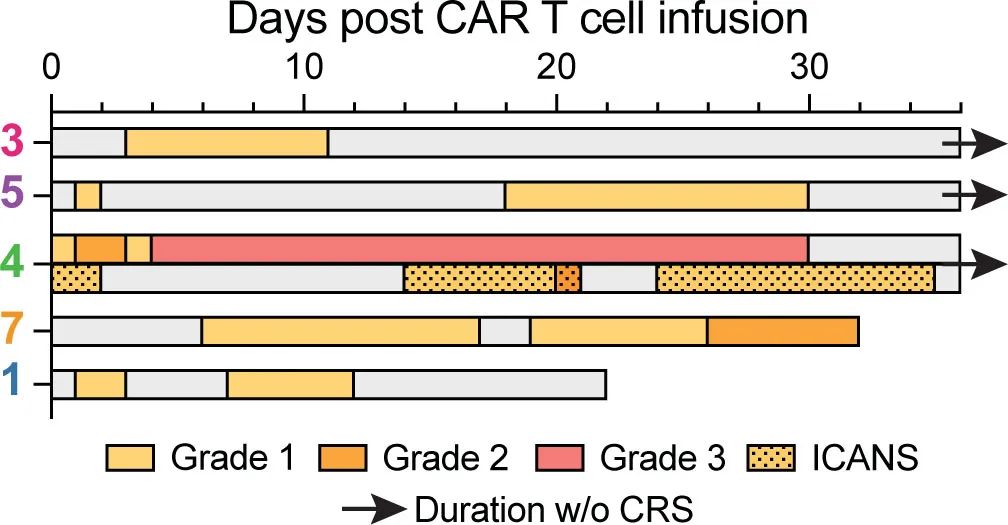
研究纳入5例复发或难治性CD37+淋系恶性肿瘤患者接受自体CD37 CAR-T细胞输注。所有患者均成功制备CAR-T细胞,且静脉到静脉的中位时间仅为10天。
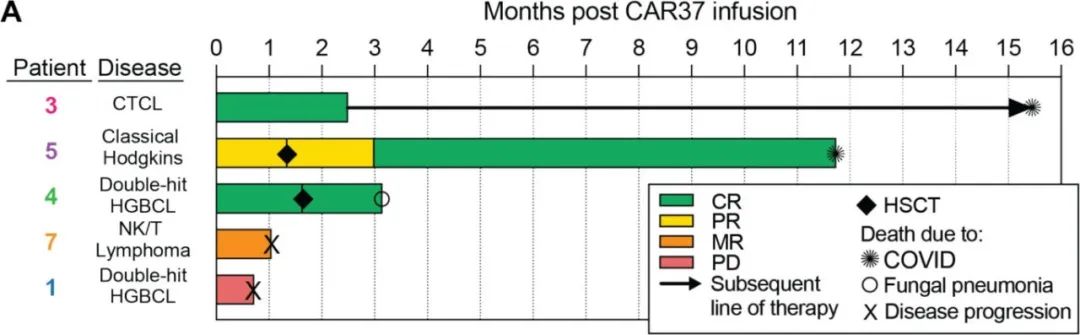
CD37 CAR-T细胞在所有患者的外周血中扩增,峰值时在4/5患者中占总淋巴细胞的94%以上。4/5例患者出现肿瘤应答,其中3例完全应答、1例混合应答;另1例疾病进展迅速且CD37表达相对缺失,预后较差,可能归因于CD37的代谢检查点功能。
所有患者均发生CRS,1例患者发生ICANS。三例患者发生长期和严重的血细胞减少,其中两例患者用西妥昔单抗消融CD37 CAR-T细胞(其被设计成共同表达截断的EGFR)的努力失败;这两例患者在异基因造血干细胞移植后恢复造血功能。未发生其他重度非血液系统毒性。在最终的细胞产物中,绝大多数CAR-T细胞为CD4+,这可能在CRS的后期发生中发挥作用,因为它们是CRS的主要介质。毒性问题强调了疗效和安全性之间需要平衡。
作者研究了深度全血细胞减少的机制,未观察到CD37 CAR-T细胞在体外对造血干细胞反应而活化,或人源化模型中的血液毒性。全血细胞减少症患者外周血IL-18水平持续高,IL-18结合蛋白水平低。CD37 CAR-T治疗患者的IL-18水平明显高于CD19 CAR-T治疗患者的细胞减少性和非细胞减少性队列。IL-18主要来源于上皮细胞和/或髓细胞,IL-18是否直接干扰造血功能或作为损害骨髓功能的一般炎症活动的替代物仍有待确定。此外,鉴于目前许多策略旨在增强CAR-T细胞释放IL-18以重塑肿瘤微环境,IL-18与血细胞减少症之间的关联不应被忽视。
该研究还讨论了将tEGFR作为CAR结构的一部分作为安全开关的使用,该功能主要用于量化CAR表达细胞,但也允许在必要时使用抗EGFR抗体(如西妥昔单抗)消融它们。然而该机制在某些条件下(例如严重血细胞减少症)并不像预期的那样起作用,这可能会对抗体依赖性细胞毒性产生负面影响,也突出了未来研究和改进的关键领域。
总体而言,CD37 CAR-T细胞表现出抗肿瘤活性,具有显著的CAR扩增和细胞因子产生。CD37 CAR-T细胞作为造血干细胞移植的桥接治疗,可能是一种有效的血液恶性肿瘤治疗方法。
该研究为治疗r/r淋系恶性肿瘤开辟了一条有希望的新途径。尽管结果在疗效方面很有希望,但副作用也需要进一步研究,以优化这种创新治疗方法的安全性。抗CD37从实验到临床的历程充分说明了将前沿科学研究转化为潜在临床治疗的挑战和回报。从这项试验中获得的见解可能会为未来的研究方向提供信息,可能会导致更精细和更安全的CD37 CAR-T细胞疗法。
参考文献
1.Frigault MJ, et al. Phase 1 study of CAR-37 T cells in patients with relapsed or refractory CD37+ lymphoid malignancies.Blood . 2024 Sep 12;144(11):1153-1167. doi: 10.1182/blood.2024024104.
2.Mougiakakos D.Anti-CD37 CAR T cells: another arrow in the quiver.Blood . 2024 Sep 12;144(11):1133-1134. doi: 10.1182/blood.2024025361.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#CD37# #淋系恶性肿瘤#
54