靶向KRAS G12C药物研发现状
2022-10-26 精准药物 精准药物
对晚期/转移性NSCLC患者一种疗效及安全性更优的口服药物。当然,目前就初治和经治KRAS G12C阳性晚期NSCLC患者,联用方案的发展亦方兴未艾,如KRAS G12C与SHP2抑制剂的联用、与EG
在近期的ESMO上,安进披露了CodeBreaK 200 Ⅲ期试验的最新结果,与标准化疗相比,KRAS G12C抑制剂sotorasib用于经治晚期和转移性非小细胞肺癌(NSCLC)带来了一些获益。在中位随访17.7个月后,Sotorasib使患者的无进展生存期显著改善,mPFS分别为5.6个月和4.5个月,客观缓解率分别为28.1%和13.2%。但是两组的总生存期没有差别,mOS分别为10.6个月和11.3个月,化疗组甚至超过了试验组。安全性方面,≥3级TRAE发生率分别为33.1%和40.4%,严重TRAE发生率分别为10.7%和22.5%。
总的来看,Sotorasib的疗效优势并不显著,但是安全性优势明显,可谓是对晚期/转移性NSCLC患者一种疗效及安全性更优的口服药物。当然,目前就初治和经治KRAS G12C阳性晚期NSCLC患者,联用方案的发展亦方兴未艾,如KRAS G12C与SHP2抑制剂的联用、与EGFR抑制剂的联用以及与免疫检查点抑制剂的联用,未来有望大放异彩。
1、KRAS G12C简介
KRAS是人类癌症中最常见的突变癌基因,在许多类型的人类癌症中已检测到KRAS突变。KRAS突变普遍存在于胰腺癌(95%)、CRC(40%)、NSCLC(25%),并且也存在于甲状腺癌、卵巢癌、膀胱癌、全身性红斑狼疮、乳腺癌、肝癌等。放眼全球,KRAS突变阳性癌症的发病人数呈上升趋势,2016年至2020年,发病人数从180.0万人增长至200.9万人,并预计于2025年增长至227.6万人,于2030年增长至256.0万人。聚焦国内,排名前三的KRAS阳性癌症分别为肺癌、结直肠癌、胰腺癌。自2016至2020年,中国主要KRAS突变癌种的发病人数从42.1万人增长至47.7万人,并预计于2025年达到55.8万人,于2030年达到64.1万人。
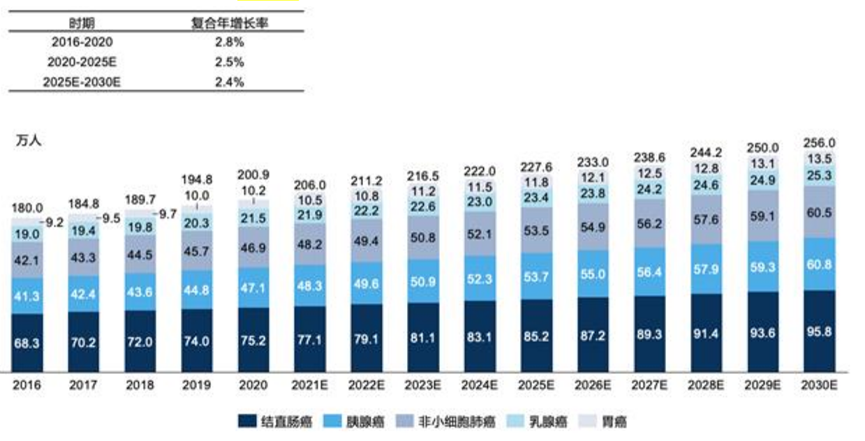
图:全球主要KRAS突变阳性癌症的发病人数 (数据来源:弗若斯特沙利文)
KRAS G12C是在第12个密码子处有甘氨酸至半胱氨酸替代物的单点突变,在KRAS突变的占比达到11.3%,约5-13%的非小细胞肺癌患者,3%的结直肠癌患者以及较低比例的若干其他难治癌症患者携带KRAS G12C突变。根据弗若斯特沙利文的数据,2016年至2020年,全球主要KRAS G12C突变阳性癌症的发病人数从27.0万人增长至30.0万人,并预计于2025年增长至34.1万人,于2030年增长至38.5万人。
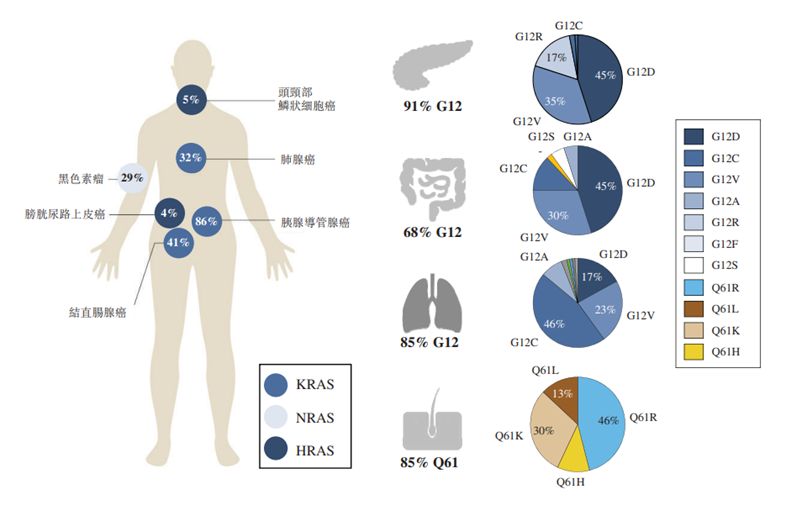
KRAS 与肿瘤的关系
尽管KRAS突变的患者人群庞大,但针对KRAS药物的研发却不算顺利,究其原因,一方面在于KRAS与底物GTP的结合力非常强,亲和系数达到皮摩尔浓度级,导致直接靶向GTP口袋的竞争抑制剂难以研发;另一方面,KRAS蛋白表面缺少理想的小分子结合口袋,难以设计出高亲和力的变构抑制剂。这导致KRAS一度被称为“不可成药”靶点。
直到2013年,加州大学旧金山分校的研究人员发现,KRAS G12C亚型的突变体蛋白上面存在一个可以与小分子药物结合的“口袋”,这一口袋与小分子化合物结合后可以将KRAS G12C突变体锁死于非活性构象中,从而为抑制KRAS突变体的活性提供了潜在的靶标。至此,科学界终于找到了破解KRAS的关键,得以突破这一“不可成药”靶点。
2、KRAS G12C在研现状
目前,全球范围内仅一款KRAS G12C抑制剂获批上市,为安进公司的AMG510(Sotorasib)。2021年5月,美国FDA有条件批准AMG510上市,用于治疗既往至少接受过一次系统治疗的携带KRAS-G12C突变局部晚期或转移性非小细胞肺癌(NSCLC)患者。目前国内尚未有KRAS G12C抑制剂获批,KRAS G12C突变的实体瘤目前尚无标准治疗方案。目前临床治疗方案包括化疗及免疫治疗等,但由于该类治疗不直接针对KRAS G12C靶点,治疗效果有限。总的来看,晚期KRAS G12C突变的实体瘤患者对KRAS G12C抑制剂有着迫切需求。
表:全球在研KRAS G12C药物一览
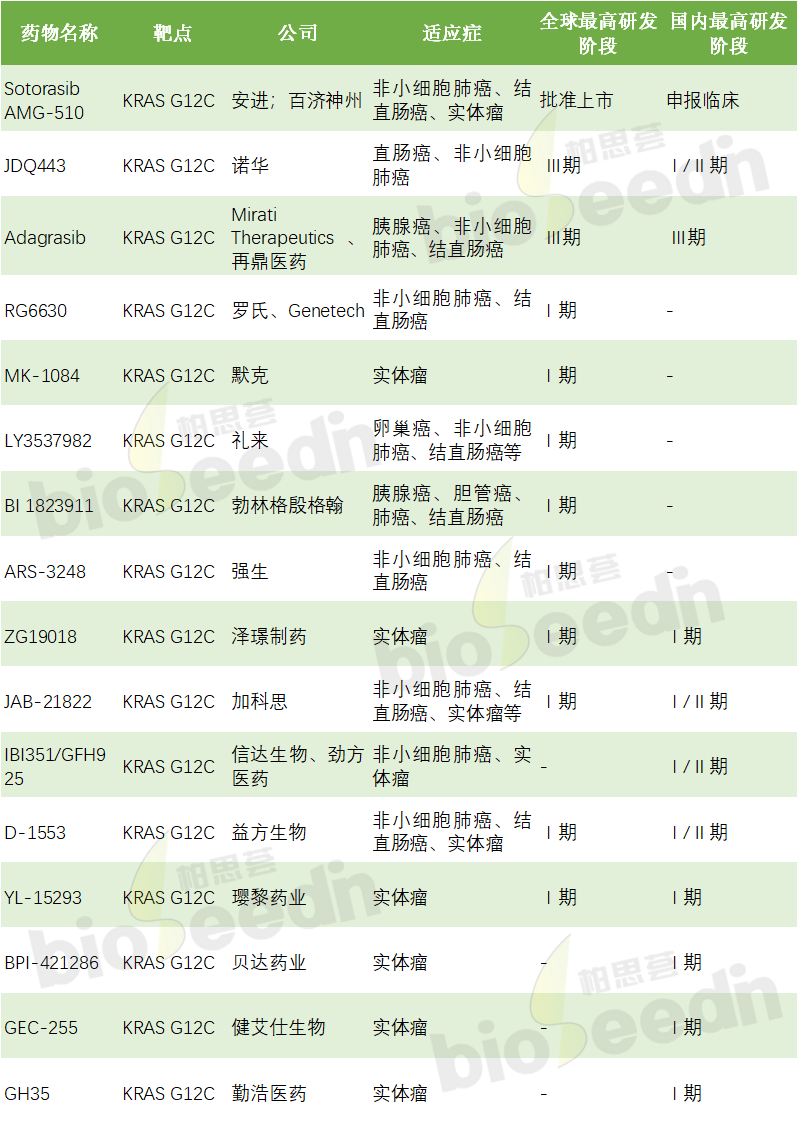
数据来源:CDE、ClinicalTrials
(1)AMG510是首个获批上市的靶向KRAS G12C的口服抑制剂,瞄准KRAS蛋白表面隐藏凹槽,可与KRAS突变蛋白Cys 12发生不可逆结合,牢牢锁定,使GDP无法活化成为GTP,从而阻止了肿瘤细胞的增殖。2021年5月,安进公司的AMG510(Sotorasib)获FDA批准上市,打破KRAS“不可成药”的魔咒,适应症为二线治疗患有KRAS G12C突变的非小细胞肺癌。
除了单药疗法外,AMG510联用方案正逐步亮相。2022WCLC上,AMG510与阿替利珠单抗/帕博利珠单抗的Ⅰb期CodeBreak 100/101研究表明,58名既往接受过治疗的NSCLC患者ORR达29%,mOS达15.7个月,但G3 TRAE发生率较单药治疗明显提升,肝毒性问题较为严重。
目前,AMG510用于治疗KRAS G12C结直肠癌(CRC)的试验也正在推进中。在2020ASCO上,安进披露了AMG510治疗结直肠癌的Ⅰ期数据,42名先前接受过标准治疗方案的受试者接受AMG510治疗,ORR和疾病控制率达7.1%和76.2%。在2022 ESMO上,安进披露了AMG501联合帕尼单抗(一种 EGFR 抗体)的Ⅰb期剂量扩展队列研究,40名患者的ORR达30%,DCR达90%,mPFS达5.7m。总的来看,Sotorasib联用方案的缓解率较单药方案提升近四倍,联用方案值得期待。
点评:AMG510作为首个上市的KRAS G12C抑制剂,先发优势明显,2022年上半年实现销售额1.39亿美元。但AMG510的疗效优势并不算十分显著,2022ESMO披露的CodeBreak 100的Ⅲ期OS数据与化疗甚至没有显著优势。联用方案上,与免疫检查点抑制剂的联用方案疗效优势明显,但肝毒性较为明显;与EGFR单抗联用的Ⅱ期数据值得期待。
(2)MRTX-849 (Adagrasib)由Mirati Therapeutics公司设计,结构与安进的AM510类似。在KRAS蛋白分子中,临近第12位密码子突变的半胱氨酸及分子开关Ⅱ区域(S-IIP)有一个可扩张的小口袋,MRTX-849通过共价形式与Cys 12不可逆结合,将KRAS G12C蛋白锁定在“关闭”状态,从而阻断KRAS信号传导。
针对非小细胞肺癌,2022ASCO披露了Adagrasib的注册性Ⅱ期临床试验,研究共纳入116名先前接受过铂类化疗和抗PD-1/L1治疗的NSCLC患者,结果显示,112例基线可测量疾病患者的ORR达43%,DCR达80%,mPFS为6.5个月,mOS为12.6个月。研究人员进一步评估了Adgrasib在稳定CNS转移的经治患者的疗效。颅内ORR为33%,其中包括5例CR(15%)和6例PR(18%)。
针对结直肠癌,Adagrasib单药及联合西妥昔单抗的Ⅰ/Ⅱ期临床试验在2022ESMO上披露,结果显示,Adagrasib单药组的客观缓解率达19%(8/43),疾病控制率达86%,mPFS达5.6个月。在联用组,32例患者的客观缓解率为46%,疾病控制率为100%,mPFS为6.9个月。
点评:Adagrasib的PDUFA日期为2022年12月14日,上市正逐步逼近。但Adagrasib较AMG510的疗效优势不算明显,但毒性却显著增加,Ⅱ期KRYSTAL-1研究显示G3 TRAE达43%。与西妥昔单抗联合治疗结直肠癌疗效卓越,期待后续注册性临床的数据。
(3)JAB-21822是加科思自主研发的一款强效、不可逆的KRAS G12C变构抑制剂,JAB-21822通过共价结合于KRAS G12C的12位突变的半胱氨酸残基上,使KRAS G12C锁定在非活化状态,从而阻断KRAS依赖的信号转导,抑制肿瘤细胞的增殖,并诱导细胞凋亡。
在2022ASCO上,加科思披露了JAB-21822在KRAS G12C突变的非小细胞肺癌的Ⅰ/Ⅱ期试验,32例KRAS G12C突变的非小细胞肺癌患者ORR达56.3%,DCR达90.6%。在400mg/d及800mg/d的QD剂量组中,ORR达66.7%,DCR达100%。
(4)IBI351是信达生物/劲方医药旗下的高效口服新分子实体化合物,通过共价不可逆修饰KRAS G12C蛋白突变体半胱氨酸残基,有效抑制该蛋白介导的GTP/GDP交换从而下调KRAS蛋白活化水平。在2022ASCO上,信达生物披露了IBI351单药治疗晚期实体瘤患者的Ⅰ期剂量递增研究。研究共入组31例既往经过标准治疗失败或不耐受的晚期恶性肿瘤受试者,其中12例非小细胞肺癌患者接受700mg QD及以上剂量的IBI351治疗,ORR达50%,DCR达83.3%;5例结直肠癌患者接受IBI351治疗,ORR达40%,DCR达60%。安全性方面,12.9%的受试者出现3级TRAEs,无4级和5级的TRAEs以及导致治疗终止的TRAEs发生。
(5)D-1553是益方生物旗下的一款小分子KRAS G12C。在2022WCLC上,益方生物披露了D-1553的Ⅰ期临床数据,79例先前接受过≥2线系统性治疗的KRAS G12C突变的NSCLC患者ORR达37.8%,DCR达91.9%,mPFS为7.6m。安全性方面,未观察到剂量限制性毒性,未发生治疗相关的致死性不良事件。
SUMMARY 小结
KRAS G12C抑制剂的研发渐入深水区,从单药疗法到联合疗法,疗效逐步提升,有望为KRAS G12C突变的NSCLC和CRC患者提供新的治疗手段。目前,全球仅sotorasib获批上市,Adagrasib的PDUFA日期为2022年12月14日,年底有望上市。聚焦国内,数十家企业深耕KRAS G12C抑制剂,其中加科思、信达生物、益方生物等临床进展居前,旗下药物已展示出潜在良好的临床疗效。期待KRAS G12C抑制剂后续的单药及联用数据,包括大家尤为关注的OS优势。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言