STTT:赵维莅教授团队探索信迪利单抗联合培门冬酶一线治疗晚期NK/T细胞淋巴瘤的疗效及标志物
2024-03-10 聊聊血液 聊聊血液 发表于威斯康星
上海交通大学医学院附属瑞金医院赵维莅教授团队开展了一项抗代谢药物培门冬酶联合PD-1抗体信迪利单抗的II期临床研究。
NKTCL无化疗方案
NK/T细胞淋巴瘤(NKTCL)一种高侵袭性淋巴瘤,晚期患者(Ann Arbor III/IV期,约占30%)对强化化疗反应差,中位生存期仅有4-7个月。为探索新诊断晚期NKTCL的有效和安全的治疗方案,上海交通大学医学院附属瑞金医院赵维莅教授团队开展了一项抗代谢药物培门冬酶联合PD-1抗体信迪利单抗的II期临床研究,研究结果近日发表于《Signal Transduction and Targeted Therapy》。

研究方法
该研究是一项研究者发起的开放标签、单臂、II期研究,纳入WHO分类进行组织学诊断的≥18岁、Ann Arbor III/IV期NKTCL患者。方案概况见图1a。
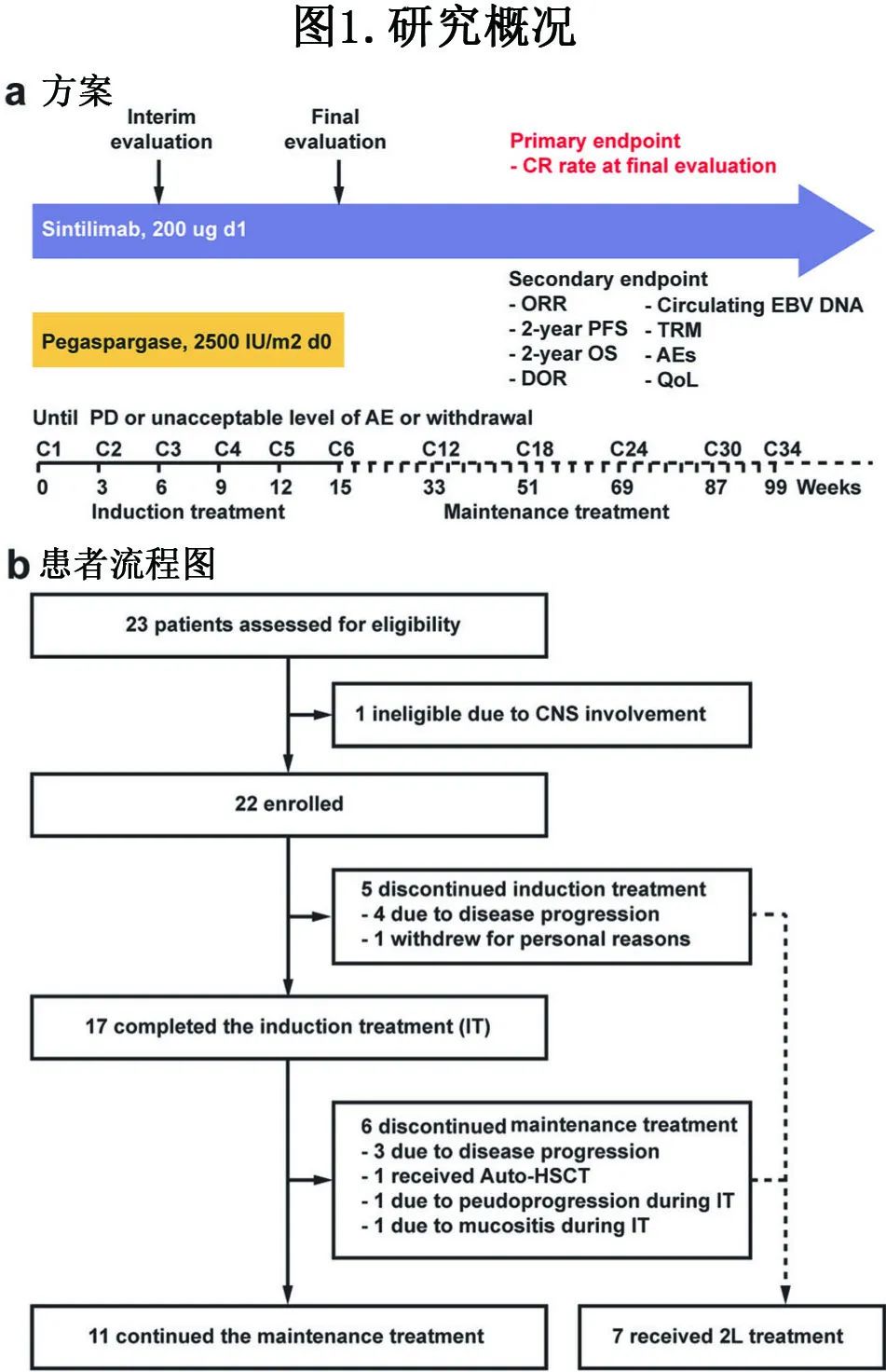
研究结果
患者特征
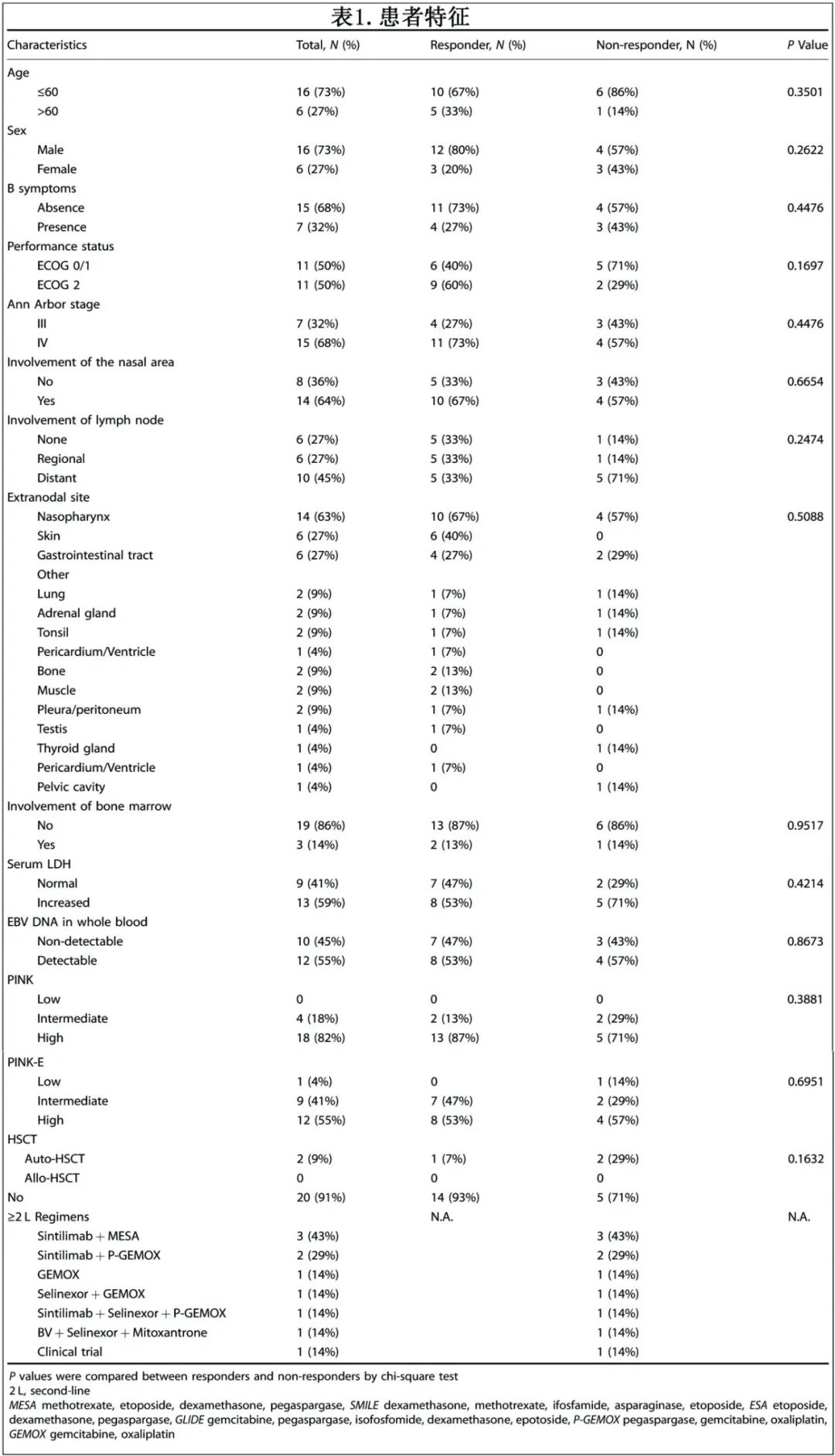
该研究评估23例患者并纳入22例,1例患者因中枢神经系统受累排除(图1b)。5例患者未完成诱导治疗:4例患者因疾病进展停止诱导治疗;1例患者在中期评估时达到部分缓解(PR),但在5个月时因个人原因撤回知情同意,该患者在意向治疗(ITT)分析中确认为缓解。17例患者完成诱导治疗,最终评估包括CR 13例,PR 1例,PD 3例;14例CR/PR患者中,11例继续信迪利单抗维持治疗,其中8例完成维持治疗,1例接受自体造血干细胞移植(auto-HSCT), 2例患者分别因诱导治疗期间假性进展和黏膜炎未完成维持治疗。
基线特征见表1。中位年龄51岁(24~74岁),>60岁者占23%。68%为Ann Arbor IV期,59%的患者血清乳酸脱氢酶(LDH)水平升高,45%的患者有远处淋巴结受累。风险分层显示,根据PINK和PINK-E分别有82例和55%的患者为高危。
疗效
研究分两个阶段,第一阶段入组7例患者,如果CR>3/7则继续;结果为5例CR, 2例PR。ITT分析中,6个周期诱导治疗后的总缓解率(ORR)为68%, CR率为59%,PR率为9%。来自CR患者的代表性PET-CT图像见图2a。大多数患者的肿瘤负荷降低≥50%(71%,图2b)。1例患者纵隔出现新病灶,经活检诊断为假性进展。与无应答者相比,应答者在3个周期诱导治疗后循环EBV DNA水平显著下降,并在6个周期诱导治疗后转阴(图2c)。PFS和OS均中位随访30个月,该无化疗治疗的2年PFS率和OS率分别为68%和86% (图2d)。未达到中位缓解持续时间(DOR)。值得注意的是,应答组的PFS和OS均优于无应答组(图2e)。
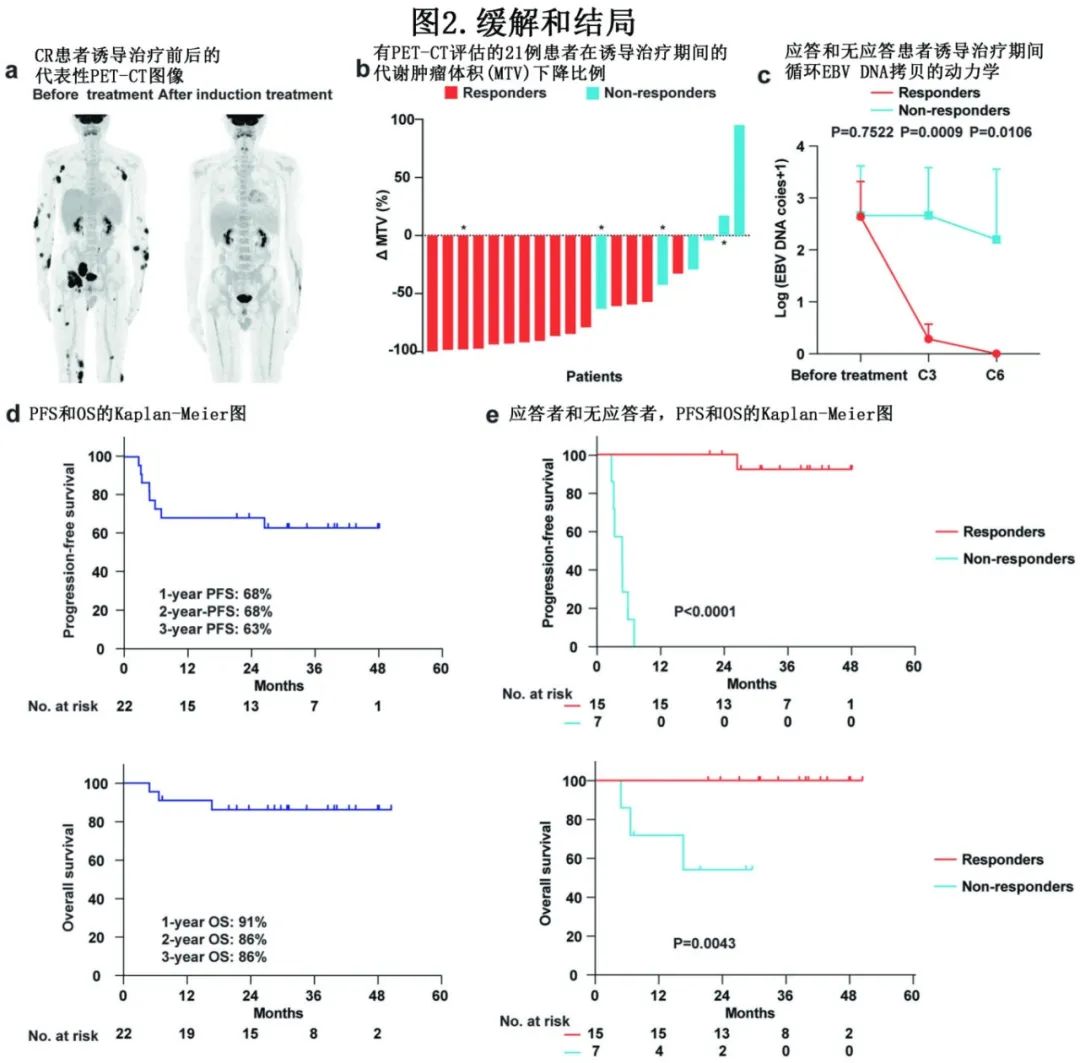
考虑到一线auto-HSCT未显示出生存获益,因此本试验中一般未采用auto-HSCT进行巩固治疗,并且仅有1例患者接受auto-HSCT。13例CR患者在维持治疗(10例)和随访评估(3例)中均无病生存,停药后(中位5个月)均无复发。1例PR患者在信迪利单抗维持治疗20个周期后出现疾病进展,经二线治疗后仍存活。
7例无应答患者接受了≥2线化疗(表1),其中2例获得CR;1例接受塞利尼索、信迪利单抗和P-GEMOX治疗,1例接受信迪利单抗和MESA治疗。
安全性
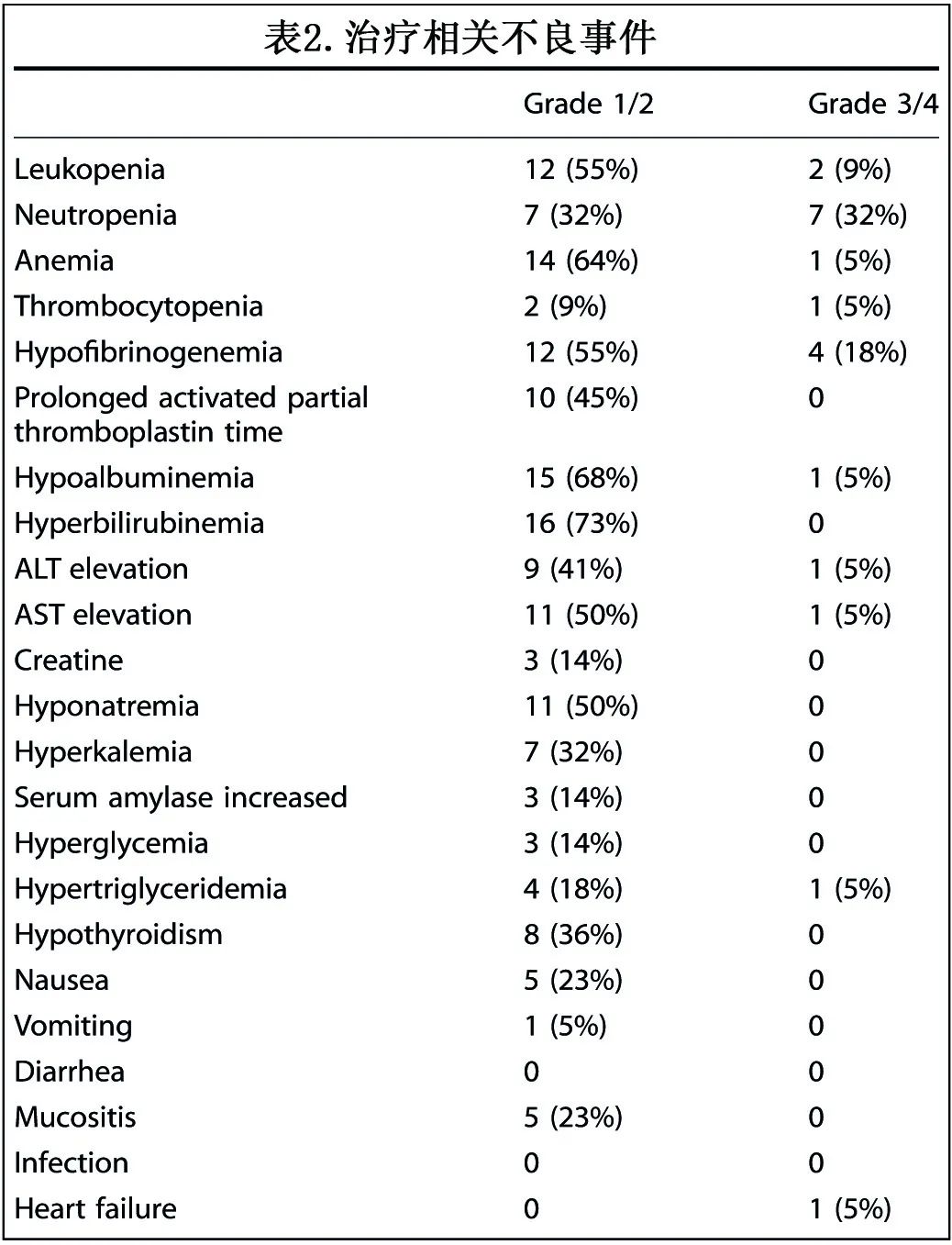
在22例接受方案治疗的患者中,91% (n=20)发生至少1次AE,大多数为轻、中度。10例(45%)患者出现3/4级不良事件,包括中性粒细胞减少(32%,n=7)、低纤维蛋白原血症(18%,n=4)、白细胞减少(9%,n=2)、贫血(5%,n=1)、血小板减少症(5%,n=1)、低白蛋白血症(5%,n=1)、天冬氨酸转氨酶(AST)/丙氨酸转氨酶(ALT)升高(5%,n=1)、心力衰竭(5%,n=1),均在可控制范围内,未导致停药。所有患者均未出现培门冬酶超敏反应,且均未预防性使用糖皮质激素。无出血或血栓栓塞事件发生。1例患者在诊断NKTCL前6个月因阵发性室性心动过速行植入式心律转复除颤器手术,第1周期诱导治疗后出现心力衰竭;患者继续治疗,诱导治疗后获得CR,因此考虑为与治疗无关。
最常见的1/2级血液学不良反应为贫血(64%,14例)、白细胞减少(55%,12例)和中性粒细胞减少(32%,7例),非血液学不良反应为高胆红素血症(73%,16例)、低白蛋白血症(68%,15例)、低纤维蛋白原血症(55%,12例)、AST升高(50%,11例)和低钠血症(50%,11例)。
8例患者(36%)发生1/2级甲状腺功能减退,无症状且不需要药物治疗;无3/4级甲状腺功能减退。未观察到肺炎、肾上腺皮质功能不全、肝炎、白癜风等其他免疫相关不良反应。表2列出了诱导治疗期间发生的所有级别AE。
标志物分析
没有临床特征与培门冬酶联合信迪利单抗治疗的应答相关,如Ann Arbor分期、鼻外型、远处淋巴结受累、循环EBV DNA、PINK和PINK-E等(表1)。应答者和无应答者之间治疗前肿瘤EBV基因表达无差异。通过PD-L1免疫组化检测PD-L1表达,并通过肿瘤比例评分(TPS)进行定量,TPS定义为染色的肿瘤细胞占总肿瘤细胞的百分比;结果CR患者治疗前肿瘤组织的PD-L1 TPS显著高于PD患者(图3a),而肿瘤浸润淋巴细胞 (TIL)上PD-1的表达与治疗反应差相关(图3b)。
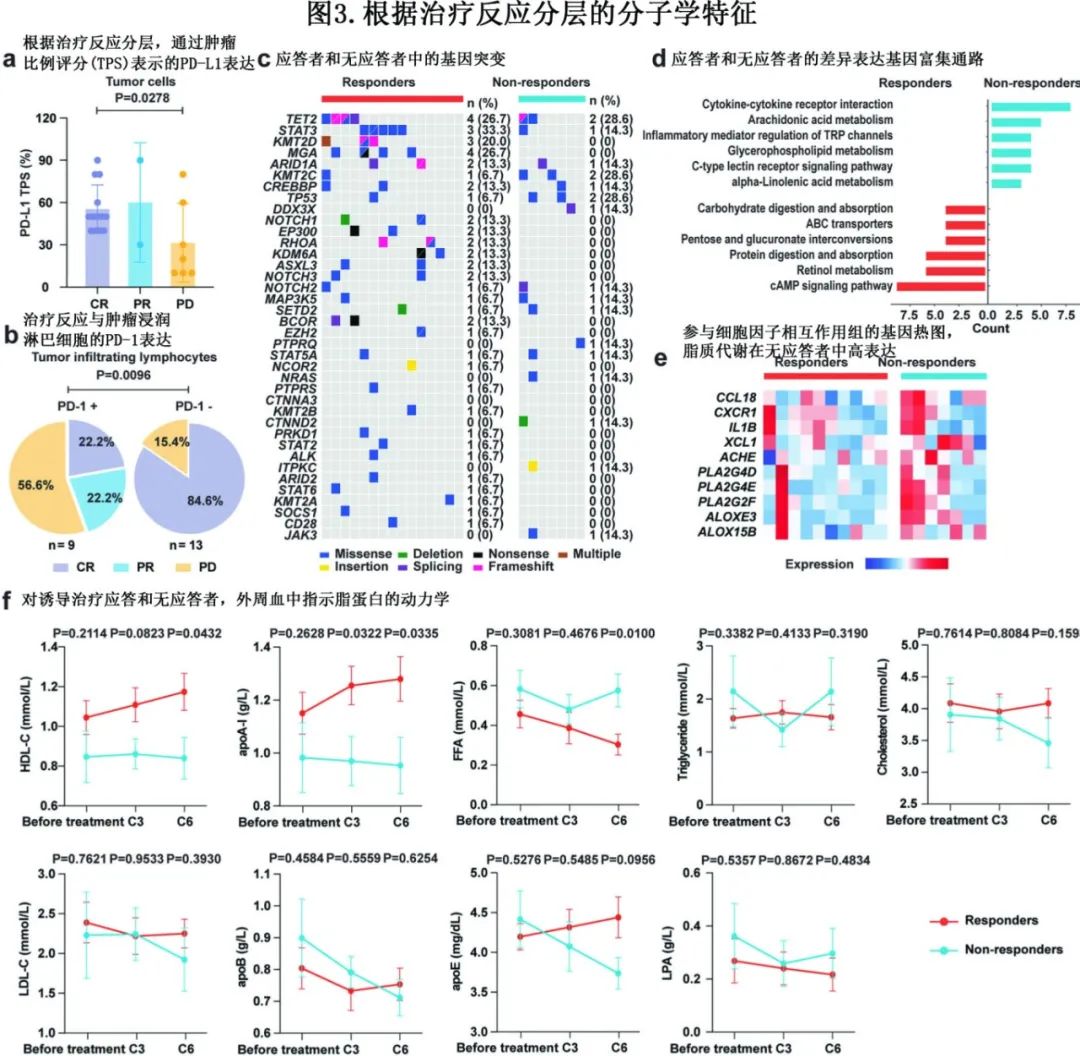
为探索生物标志物,作者对患者治疗前的肿瘤样本进行了靶向DNA测序(n=22)和RNA测序(RNA-seq,n=17)。在应答者和无应答者之间,突变模式无显著差异(图3c)。接下来使用RNA-seq数据比较差异表达基因(differentially expressed genes),并在无应答者中确定了303个上调基因和519个下调基因,其中细胞因子-细胞因子受体相互作用、花生四烯酸、α -亚麻酸和甘油磷脂代谢在无应答者中显著激活(图3d)。通过比较来自1例无应答患者的新诊断和配对复发肿瘤活检的RNA-seq数据,观察到类似的结果。图3e进一步揭示,在无应答者中上调的基因包括CCL8、CXCR1、IL1B和XCL1(参与免疫抑制性Treg细胞的募集、迁移、扩增和功能)和ACHE、PLA2G4D、PLA2G4E、PLA2G2F、ALOXE3和ALOX15B(参与磷脂酰胆碱分解代谢和高密度脂蛋白[HDL]稳态)。相应的,在诱导治疗应答的患者中,外周血HDL胆固醇(HDL-C)和载脂蛋白A-I (apoA-I,HDL的主要蛋白质成分)升高,而游离脂肪酸降低(图3f)。其他血脂指标,包括甘油三酯、胆固醇、低密度脂蛋白胆固醇(LDL-C)、apoB、apoE和脂蛋白A (LPA),在应答者和无应答者之间无差异(图3f)。需要注意的是,所有患者治疗前均未服用口服降脂药物,由于使用培门冬酶,诱导治疗期间均采用低脂饮食。
最近研究发现霍奇金淋巴瘤中外周血免疫特征与检查点阻断反应相关,受此启发,作者进一步应用单细胞蛋白质组学分析(通过飞行时间质谱细胞分析,CyTOF),使用40个免疫细胞标记物(指定34个免疫细胞簇[clusters])研究了外周血免疫特征(n=8,有合格的血液样本)。共鉴定出2个蛋白簇(C1和C2,图4a),在应答组(n=5)和无应答组(n=3)中表达水平不同,其中C1蛋白(如HLA-DR、CD141、CD11b、CD11c、CD14、CD16和CD107a)在应答组中表达上调,主要表达于单核细胞、DC和B细胞;而C2蛋白(如FOXP3、CD25、CD127、CD62L和CD197)在无应答组表达上调,主要表达于Treg和幼稚T细胞(图4b)。作者分析了免疫检查点的蛋白表达,发现应答者的T细胞簇上的PD-1增加,而无应答者的单核细胞、DC和Treg细胞上的CTLA-4增加(图4c)。NKTCL的外周血免疫细胞簇的比例与健康志愿者显著不同(n=10)。与应答者和无应答者中下调的初始CD4+ 和CD8+ T细胞具有相似特征,应答者中 Treg 细胞下调,而无应答者中 Treg 细胞上调(图4d)。此外,采用流式细胞术(FCM)对全部22例入组患者治疗前的外周免疫细胞亚群进行评估,证实无应答患者的CD4+CD25+CD127low Treg细胞亚群显著高于应答患者。免疫抑制性Treg细胞与甘油三酯、apoE、FFA呈正相关,而免疫激活的细胞毒T细胞与HDL-C、apoA-I、apoB、cholesterol、LDL-C、LPA等脂质蛋白呈正相关。
总结
目前晚期NKTCL尚无标准治疗方案,根据NCCN指南,主要包括SMILE、DDGP和P-GEMOX为首选方案。而无化疗的培门冬酶联合信迪利单抗方案可同时靶向谷氨酰胺代谢和免疫检查点PD-1,一线治疗初治、晚期NKTCL安全有效。2年PFS和OS分别为68%和86%,最常见的3/4级不良事件为中性粒细胞减少(32%,n=7)和低纤维蛋白原血症(18%,n=4),不良事件可控且不会导致停药。PD-L1、外周血高密度脂蛋白胆固醇、载脂蛋白A-I的肿瘤比例评分与反应良好相关,而肿瘤浸润淋巴细胞和外周血Treg细胞的PD-1表达与反应较差相关。
脂质代谢异常和免疫抑制特征异常可导致NKTCL治疗耐药,为脂肪酸代谢和CTLA-4的双重靶向治疗提供了替代治疗方案;通过调节肿瘤代谢和免疫抑制状态,有望为NKTCL的机制指导(mechanism-guided)治疗策略开辟新的通路。
参考文献
Xiong, J., Cheng, S., Gao, X. et al. Anti-metabolic agent pegaspargase plus PD-1 antibody sintilimab for first-line treatment in advanced natural killer T cell lymphoma. Sig Transduct Target Ther 9, 62 (2024). https://doi.org/10.1038/s41392-024-01782-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#信迪利单抗# #培门冬酶# #NK/T细胞淋巴瘤#
51