细菌工程已经允许活细胞诊断和治疗的发展,包括对肠道炎症、肠道出血、病原体和缺氧肿瘤做出反应的微生物。细菌可以进入整个胃肠道,产生粪便或尿液中可测量的输出。细胞记忆,如双稳态开关或基因组重排,使细菌能够随着时间的推移存储信息。一些细菌天生具有转化能力,可以直接从其环境中采集细胞外DNA。
水平基因转移(HGT),即生物个体之间的遗传物质交换,在微生物中很常见。贝氏不动杆菌(Acinetobacter baylyi)是一种自然感受态细菌,在健康人体内基本上没有致病性。可以定植小鼠胃肠道,并获取未纯化的环境DNA。
近日,一组来自UCSD和澳大利亚的团队在顶刊Science上发表了一篇题为“Engineered bacteria detect tumor DNA”的文章。研究团队开发了一种称为靶向CRISPR识别水平基因转移的细胞检测(Cellular Assay for Targeted CRISPR-discriminated Horizontal gene transfer,CATCH),将细菌生物传感器提供给样品并对目标DNA进行基因组整合。为了证明这一概念,作者使用生物传感器检测工程肿瘤细胞,还开发了基因回路来检测自然的、非工程的肿瘤DNA序列,在单碱基水平上区分致癌突变。由于目标序列和输出基因是模块化的,此方法可以推广到检测任意DNA序列并以可编程的方式响应。

图片来源:Science
工程细菌检测肿瘤DNA概念概述
工程贝氏不动杆菌在直肠癌原位小鼠模型中经直肠输送。自然感受态的贝氏不动杆菌会接受从肿瘤脱落进入结直肠腔的DNA。肿瘤供体DNA被设计成在KRAS同源臂内插入了卡那霉素耐药基因(kanR)。传感器细菌被设计成具有匹配的KRAS同源臂,促进同源重组。从肿瘤DNA中接受HGT的传感器细菌会获得卡那霉素耐药性,并通过抗生素平板连续稀释进行定量。
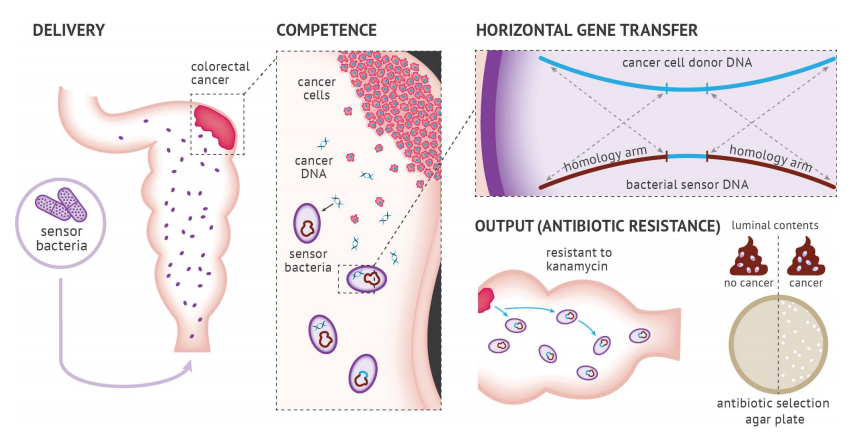
工程细菌检测肿瘤DNA。图片来源:Science
工程癌细胞系,类器官和传感器细菌
为了验证细菌可以检测特定哺乳动物DNA的假设,作者设计了一种转基因供体盒,在KRAS同源臂内插入了卡那霉素耐药基因(kanR)(下图b至C)。此技术目前仅限于特定序列的检测,如 KRASG12D。作者将这种供体盒稳定地转导到三种不同背景遗传改变的人类结直肠癌(CRC)细胞系中和两个人类CRC类器官。为了构建传感器细菌,作者在贝氏不动杆菌中提供了可与外来基因重组的KRAS基因的同源臂,并测试了“大插入”设计(2kb供体盒必须转移)和“小插入”设计(只有8个bp必须转移以修复两个终止密码子)。
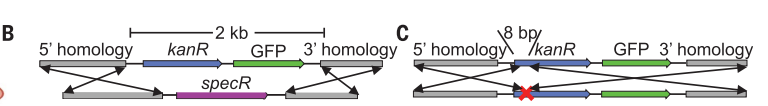
KRASG12D DNA的体外检测设计方法。图片来源:Science
检测癌细胞系的游离DNA
作者使用不同的供体DNA源,在液体培养和固体琼脂上测试了这些设计。“大插入”生物传感器可从纯化的质粒和基因组DNA中检测供体DNA(下图D、E)。“小插入”设计得到了改进检测效率大约10倍,可以可靠地检测原始裂解物(下图F和G)。固体琼脂的检测效率高于液体培养。值得注意的是,这些实验证实了生物传感器不需要DNA纯化。
作者又通过一系列令人眼花缭乱的设计使传感器细菌会通过CRISPR介导的DNA降解来拒绝野生型KRAS,但允许KRASG12D序列的整合(下图I和J)。因此,传感器贝氏不动杆菌可以被改造成检测具有单碱基特异性的KRAS基因的突变热点。
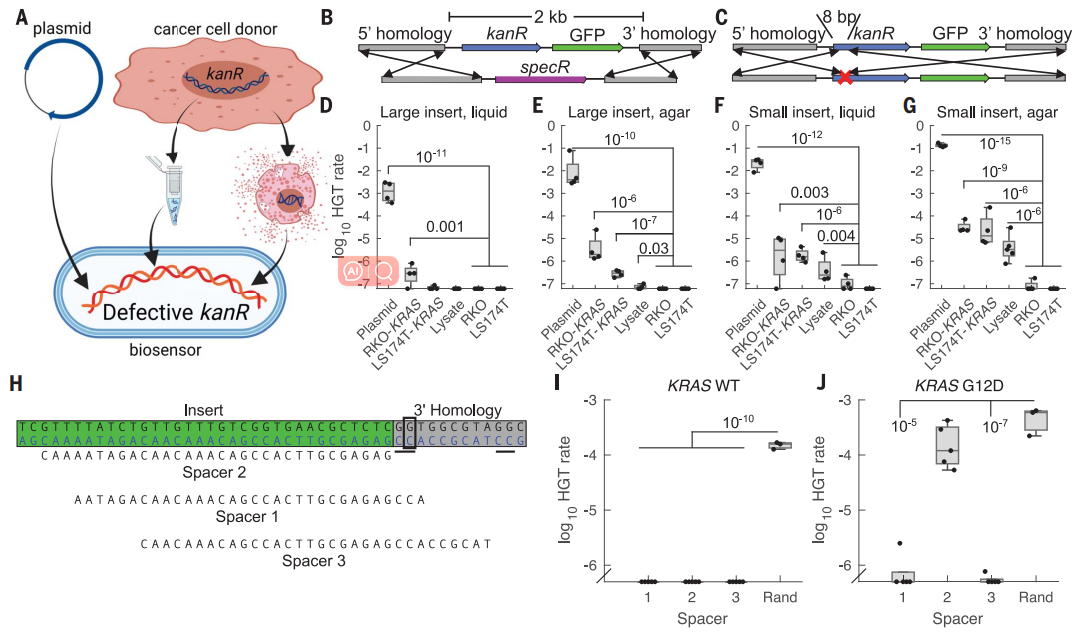
KRASG12D DNA的体外检测。图片来源:Science
肿瘤类器官游离DNA的检测
接下来,作者在类器官培养中评估传感器(下图A)。结果显示,与结直肠癌细胞系一样,贝氏不动杆菌传感器纳入了来自供体类器官裂解液的DNA,而不是来自亲本类器官的对照裂解液(图B)。当共培养表达GFP的传感器与亲代或供体类器官一起在Matrigel上培养24小时,传感器细菌包裹了类器官(图C)。在与供体(而非亲本)类器官共培养后,传感器细菌通过HGT获得了供体DNA(图D)。
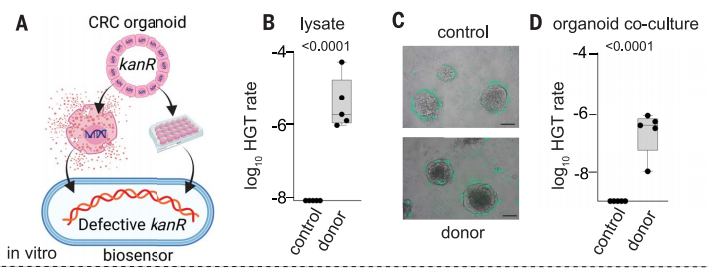
肿瘤类器官系统中供体DNA的检测。图片来源:Science
原位结直肠癌小鼠模型中游离肿瘤DNA的检测
鉴于癌症-细菌HGT发生在体外和粪便中,下一步作者试图在体内测试CATCH系统。通过小鼠结肠镜将工程CRC供体类器官或非供体类器官原位注射到免疫缺陷NSG小鼠结肠中形成结肠肿瘤,肿瘤会将肿瘤DNA释放到结直肠管腔中。在第5周,传感器(或亲代)经直肠灌肠两次给药,并对管腔流出物进行分析(下图F)。
从肿瘤到生物传感器的HGT仅在给予传感器细菌的供体瘤小鼠中检测到。对照瘤小鼠均未检测到HGT(图F)。因此在实验模型中,CATCH可以区分有CRC和没有CRC的小鼠(图G)。
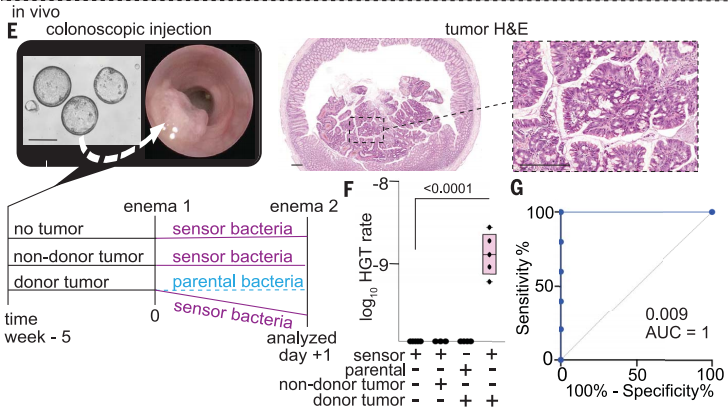
原位结直肠癌小鼠模型中游离肿瘤DNA的检测
图片来源:Science
检测非工程DNA
最后,作者设计了生物传感器来检测和分析非工程的癌症DNA。将tetR抑制基因插入生物传感器的KRAS同源臂之间,并放置了一个输出基因(图A)。在这种设计中,输出基因的表达被组成型抑制。在与KRAS靶DNA重组后,抑制因子tetR从基因组中删除。如果KRAS序列为野生型,则将被CRISPR检测并降解(图B)。如果G12位点发生突变,输出基因的表达将会开启(图C)。作者在体外证实了生物传感器对天然靶DNA的检测和识别(图D)。
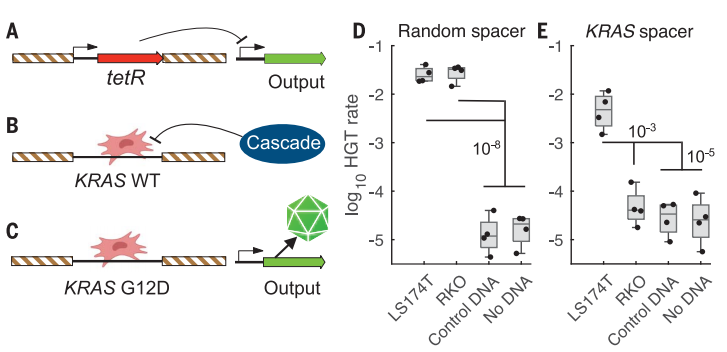
非工程DNA的检测。图片来源:Science
总结与讨论
在这里,作者设计了天然活性的贝氏不动杆菌来检测来自结直肠癌(CRC)细胞、类器官和肿瘤基因组的供体DNA。这里描述的细菌传感器假设一个活的生物传感器可以在肠道中检测从结直肠癌中脱落的特定DNA,无需样品制备或处理。同源臂和CRISPR spacer是模块化的,因此该策略可以很容易地用于检测和分析任意感兴趣的目标序列。
但此技术还没有做好临床应用的准备。这种方法需要进一步发展,以确保未来的版本可以口服给药,并达到足够肠腔浓度,以便通过粪便或血液等非侵入性采样进行可靠的检测。随着技术向临床护理方向发展,还需要更严格地评估CATCH与其他相关检测(如结肠镜检查和体外核酸检测)相比的性能。随着CATCH应用于更多的临床前模型以及在人体试验之前,确保患者安全,最大限度地减少抗生素耐药性传播的风险以及满足生物防护问题至关重要。
体外DNA分析有助于检测和管理重要的人类疾病,包括癌症和感染。在体内对肠道进行直接取样可能具有重要的优势。胃肠道含有显著的脱氧核糖核酸酶(DNase)活性,这可能降低下游粪便样本的信息含量。放置在原位的细菌生物传感器可以在DNA释放后被局部DNA酶降解之前捕获并保存DNA。然而,CATCH最令人兴奋的方面可能是,与体外诊断不同,一旦捕获目标DNA,它就可以与纳米体、肽或其他小分子递送相结合,用于治疗癌症或感染。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言