ACE-2在心肺中的调节
2023-02-28 重症医学 重症医学 发表于安徽省
ACE-2受体是一种1型跨膜金属羧基肽酶,通过肾素-血管紧张素系统(RAS)和ACE一起调节血压。它位于血管内皮细胞、肾小管上皮细胞、肺、肾、胃肠道和睾丸间质细胞。
ACE-2在心肺中的调节
中国石油中心医院EICU 边毓尧
重症行者翻译组
摘要
SARS-CoV-2感染或COVID-19疾病的发病机制研究仍是一个活跃和快速发展的研究领域。目前,血管紧张素转换酶2蛋白(angiotensin-convert enzyme 2 protein, ACE-2)是参与SARS-CoV-2发病机制的主要受体。在正常的生理反应中,ACE-2在调节肾素-血管紧张素系统(RAS)中有重要作用,包括心脏、肾脏和肺。ACE-2的失调与心力衰竭、肺动脉高压和糖尿病心血管并发症有关。COVID-19的两个主要风险因素包括高血压和心血管疾病。然而,导致这些COVID-19传染性风险因素的确切机制仍不清楚。在这篇论文中,我们提供了COVID-19心血管危险因素可能的分子机制。
简介
2019年首次报道的SARS-CoV-2 (COVID-19)病毒导致了全球范围内的大流行,导致100多万人死亡。冠状病毒属于单股正链RNA病毒的一个大家族,可以感染人类和动物。COVID-19是第七种有待确认的人类冠状病毒。感染SARS-CoV-2的患者表现为发热、咳嗽和呼吸困难。COVID-19晚期可导致肺炎、急性呼吸窘迫综合征(ARDS)和充血性心力衰竭。SARS-CoV-2病毒虽然是一种新病毒,但与SARS-CoV-1的基因组序列同源性较高(70-80%)。这种相似性延伸到SARS-CoV-1和-2发病机制所必需的受体,即血管紧张素转换酶2受体(ACE-2)。
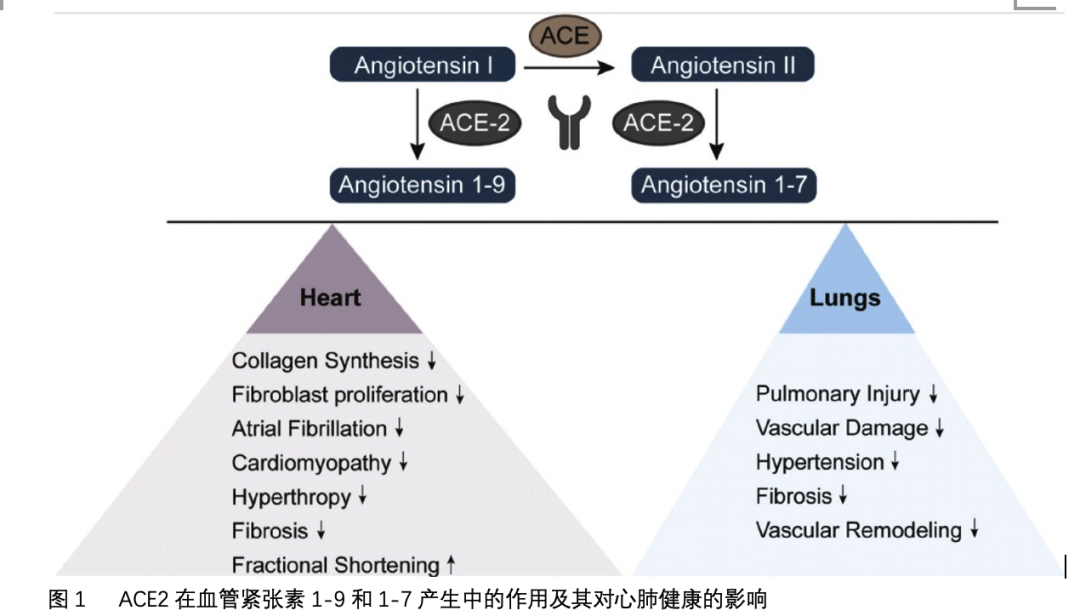
ACE-2受体是一种1型跨膜金属羧基肽酶,通过肾素-血管紧张素系统(RAS)和ACE一起调节血压。它位于血管内皮细胞、肾小管上皮细胞、肺、肾、胃肠道和睾丸间质细胞。该受体降解血管紧张素II,生成血管紧张素1 - 7和血管紧张素1 - 9,从而负向调节RAS(图1)。具体来说,血管紧张素1-7和1-9在心脏、血管和肾脏中是有效的血管扩张剂。ACE-2受体的基因突变与心力衰竭、全身性和肺动脉高压、心肌梗死和糖尿病心血管并发症有关。临床研究表明激活ACE-2受体对高血压和心血管疾病有保护作用(图1)。特别是,两项II期临床试验表明,重组人ACE-2能够减少全身炎症,并将RAS肽从血管紧张素II转移到血管紧张素1-7。在临床前研究中,活化的ACE-2可减少肺损伤和血管损伤,预防肺动脉高压,减少肺纤维化和动脉重构,并改善右心室功能(图1)。鉴于COVID-19大流行,人们对了解ACE-2受体在SARS-CoV-2发病机制中的作用越来越感兴趣。本文就调节ACE-2表达的正常生理过程进行综述。
ACE-2的心血管调节
高血压和心血管疾病是COVID-19的主要危险因素。中国的一项研究表明,高血压与死亡率和ARDS的危险比分别为1.70和1.82。随后的研究发现,有高血压病史的COVID-19患者的医院发病率和死亡率也出现了类似的趋势。据推测,年龄和性别差异可能是有高血压病史的COVID-19患者死亡率增加的原因。具体来说,ACE-2表达的增加可能调节平滑肌细胞的增殖,降低血管紧张素II的活性,导致血压升高。在COVID-19患者中,ACE-2的增加这种表达可以解释高血压患者易感性、发病率和死亡率的增加。然而,这种趋势可能存在于所有器官。一项小鼠研究发现,高血压是由血清钠水平升高和肾脏中ACE-2表达下降引起的。进一步研究高血压和ACE-2在不同器官的表达可能会为SARS-CoV-2的发病机制提供更多的信息。
心血管系统中有几个生理过程调节ACE-2的表达(图2A)。一项使用人类主动脉平滑肌细胞的临床前研究发现,与静态条件相比,重复的生理拉伸(1hz下10%的伸长)增加了ACE-2的表达和活性。一项类似的研究也检测了伸展的心肌平滑肌细胞,发现转录因子如激活蛋白1和核因子-KB可放大ACE-2的表达。2其他研究表明,血管紧张素II和内皮素-1通过激活细胞外信号调节激酶(ERK) 1/2降低ACE-2水平和MAPK信号通路。因此,我们认为ACE-2在心血管系统中的表达受多种肥大和抗肥大多肽的调控。一项研究检测了应激反应蛋白去乙酰化酶和单ADP核糖转移酶,即Sirtuin 6 (SIRT6),发现该酶通过激活amp活化的蛋白激酶(AMPK)- ACE2信号级联反应来减少重塑、纤维化和心肌损伤。用重组质粒腺相关病毒SIRT6-载体治疗高血压小鼠后,ACE-2的表达降低。其他研究发现,抑制Wnt信号通路可通过外域脱落调节ADAM17/ACE-2通路,从而减少心肌纤维化和肥厚。因此,其他调节ADAM17表达的生理机制可能直接导致了患者对COVID-19的易感性,这可能与ACE-2表达的改变有关。需要更多的研究来确定在心血管系统增加了COVID-19发病和死亡的风险。
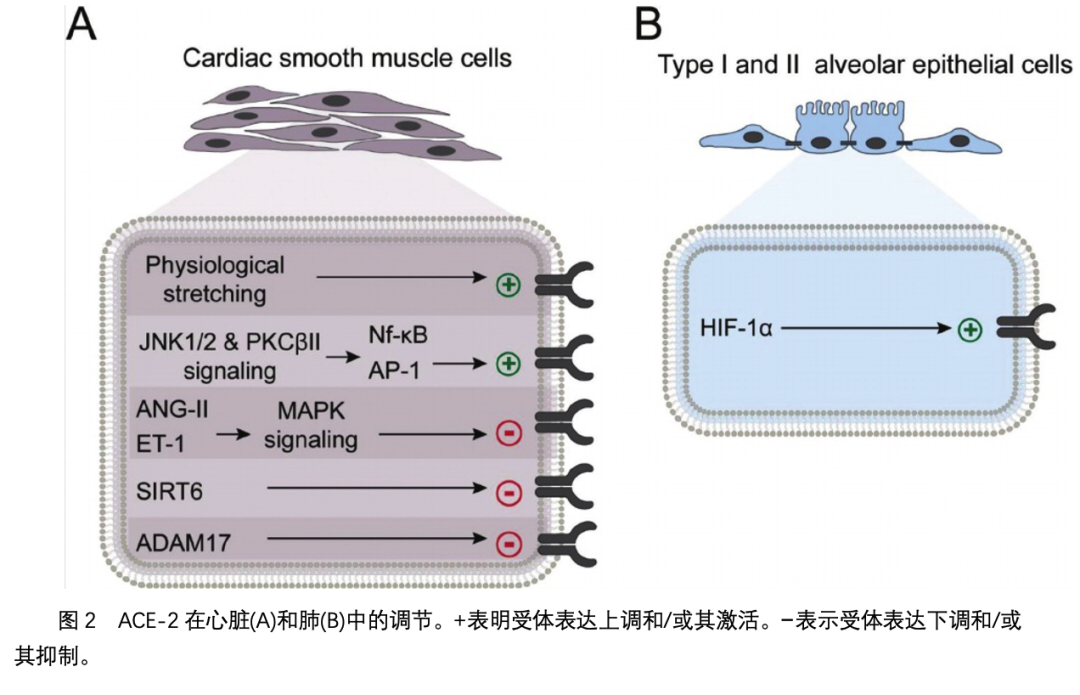
ACE-2在肺中的调节
ACE-2在肺的I型和II型肺泡上皮细胞中高度表达。ACE-2受体通过多种机制保护肺免受损伤。ACE-2的催化活性可降解血管紧张素II,阻止肺上皮细胞的血管收缩、促凋亡过程和纤维化过程,同时产生血管紧张素1-7。考虑到ACE-2在肺生理中的重要性,机体积极调节肺泡细胞中ACE-2的表达(图2)。特别是,缺氧通过上调ACE-2受体刺激造血干/祖细胞的迁移和增殖。后来发现缺氧诱导因子1α (HIF-1α)是缺氧时促进ACE-2表达的关键转录因子。因此,慢性肺病患者的ACE-2表达可能增加,这增加了他们感染COVID-19的风险 。
未来方向
鉴于SARS-CoV-2对心脏和肺的影响,大多数研究都集中在ACE-2在这些器官系统中的调节。然而,越来越多的证据表明,代谢可能影响ACE-2的表达和感染风险。最近一项对COVID-19患者的荟萃分析显示,肥胖是导致死亡的一个重要风险因素。在2009年H1N1流感中也发现了肥胖患者死亡率增加的类似发现。据此可以认为,由于代谢功能障碍、免疫功能障碍、脂肪炎症以及身体和其他医学合并症,肥胖个体在COVID-19中死亡的风险更高。一些临床前研究表明,其他代谢调节因子,如apelin、生长激素和SIRT1(沉默信息调节因子T1),可增加ACE-2的表达。肥胖可能会通过上调ACE-2受体增加COVID-19感染和死亡的风险。在可预见的未来,对COVID-19发病机制的更多研究仍将是识别风险患者和开发治疗方案的不可或缺的组成部分。
结论
ACE-2在正常生理反应中的功能研究为SARS-CoV-2的传染性和严重程度提供了可能的机制。一般来说,ACE-2受体的增加会增加病毒感染几率;具体来说,ACE-2受体数量越多,SARS-CoV-2附着在上皮表面并感染宿主的可能性就越大。相反,ACE-2的增加会降低血管紧张素II的水平,从而保护肺上皮细胞。鉴于代谢介质在ACE-2调节中的重要性,多种生理功能可能会影响特定患者感染和发展严重COVID-19疾病的总体风险。此外,SARS-CoV-2病毒的时间进程可能是另一个需要考虑的重要因素。COVID-19疾病分为两个阶段:潜伏期和症状期。3潜伏期为3-5天,期间SARS-CoV-2病毒开始附着在表达ACE-2的肺上皮细胞上。更短或更长的潜伏期以及ACE-2表达的减少或增加都可能改变整体感染风险。在症状期,尚不清楚ACE-2的增加是否会导致SARS-CoV-2的传染性相应增加。关于ACE-2是否参与了初始感染后的发病机制的进一步研究仍有待确定。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言