中科院上海药物所李亚平/尹琦研究员《AM》:个性化多表位纳米疫苗可开启B细胞介导的多种抗肿瘤免疫途径
12小时前 BioMed科技 BioMed科技 发表于陕西省
中国科学院团队构建 CM - CpG - aCD40 纳米疫苗,可激活多种抗肿瘤免疫,提高肿瘤抑制率,为基于 B 细胞的免疫治疗提供新策略,相关成果发表于 Advanced Materials。
B淋巴细胞已成为重要的免疫调节靶点。在相关研究中,接种肿瘤细胞膜衍生疫苗是一种有前景的激活B细胞的策略,但由于缺乏共刺激分子,其效率有限。
为了扩增B细胞对肿瘤的反应,中国科学院上海药物研究所李亚平研究员和尹琦研究员等人通过将免疫刺激性CpG寡核苷酸和抗-CD40抗体(aCD40)偶联到来源于三阴性乳腺癌症(TNBC)细胞的膜囊泡上,来构建时空同步抗原-佐剂整合的纳米疫苗,称为CM-CpG-aCD40。CM-CpG-aCD40在淋巴结中主动积聚,并通过aCD40识别CD40被抗原呈递细胞有效捕获。CM-CpG-aCD40上的肿瘤抗原与B细胞受体结合,为B细胞提供第一个刺激信号。同时,CpG/Toll样受体和aCD40/CD40之间的相互作用提供了叠加的共刺激信号,提高了B细胞的抗体分泌和抗原呈递能力。纳米疫苗还刺激树突细胞激活CD8+T细胞,并对肿瘤相关巨噬细胞进行重新编程。CM-CpG-aCD40可激活体液、细胞和先天抗肿瘤免疫,肿瘤抑制率达到89.3%,与抗程序性死亡配体1(PD-L1)抗体联合使用时,抑制率可进一步提高到95.4%。作者认为,CM-CpG-aCD40作为一种个性化的多表位纳米疫苗,为开创基于B细胞的免疫治疗时代铺平了道路。相关工作以“Personalized Multi-Epitope Nanovaccine Unlocks B Cell-Mediated Multiple Pathways of Antitumor Immunity”为题发表在Advanced Materials。

【文章要点】
在这项研究中,作者构建了一种自体TNBC细胞衍生疫苗,用于B细胞和T细胞的双重激活。首先,作者将TNBC肿瘤细胞的完整细胞膜提取并制备成纳米级细胞膜。然后,将CpG和激动性aCD40共价偶联到细胞膜表面,获得一种名为CM-CpG-aCD40的肿瘤疫苗,其具有氧化还原敏感接头和不可切割接头(图1)。
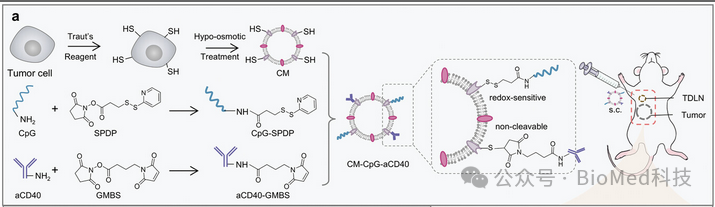
图1 CM-CpG-aCD40的制备
皮下注射后,CM-CpG-aCD40可在淋巴结中主动积聚。纳米疫苗上的TNBC抗原可与B细胞受体(BCR)结合,同时aCD40激活CD40,为启动B细胞的增殖和分化提供共刺激信号。在B细胞内化纳米疫苗后,CpG被释放并与TLR9结合,为B细胞活化提供额外的信号。具有叠加激活信号的疫苗主要通过以下机制发挥抗肿瘤作用:i)通过促进B细胞分化为浆细胞和分泌肿瘤相关抗体诱导体液免疫,从而启动抗体依赖性和补体介导的肿瘤杀伤;ii)通过增强B细胞活化T细胞的抗原呈递能力来诱导细胞免疫;iii)利用CpG的促炎能力增强先天免疫反应。因此,CM-CpG-aCD40将多价肿瘤特异性抗原、共刺激分子和免疫佐剂同步递送至抗原捕获细胞,为激活免疫反应提供了多管齐下的方法(图2)。

图2 CM-CpG-aCD40的抗肿瘤机制
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202411361
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#B淋巴细胞# #纳米疫苗#
4