最大化抗体药疗效和安全性,Fc受体全面助力抗体药物开发
2022-12-02 生物探索 生物探索 发表于陕西省
目前,全球范围内已超过100多种抗体类药物获批上市,肿瘤、自身免疫性疾病、炎症等疾病治疗领域已取得了令人瞩目的进展。
导语:目前,全球范围内已超过100多种抗体类药物获批上市,肿瘤、自身免疫性疾病、炎症等疾病治疗领域已取得了令人瞩目的进展。抗体在临床治疗、体外诊断、科学研究等领域发挥重要作用。
抗体结构和作用机制
众所周知,抗体的结构呈Y字形,分为两部分区域:Fab臂和Fc尾。Fab臂识别肿瘤细胞或肿瘤微环境(TME)中非肿瘤细胞中的游离分子或细胞表面受体。Fc尾与效应细胞结合后引起细胞杀伤作用。

抗体及FC结构图(来自参考文献)
Fab臂决定抗体的特异性。Fc尾与抗体依赖的细胞介导的细胞毒性作用(ADCC)、抗体依赖性细胞介导的吞噬作用(ADCP)以及补体依赖的细胞毒性作用(CDC)及药物半衰期都密切相关。Fab臂和Fc尾共同决定抗体药的疗效和安全性,因此开发抗体药物既要考虑Fab臂的表位、特异性和亲和力,也要充分思考Fc尾的生物学活性、理化性质与目的效应功能的关联,从而将抗体药的疗效与安全性最大化。
如何增强抗体药物ADCC活性
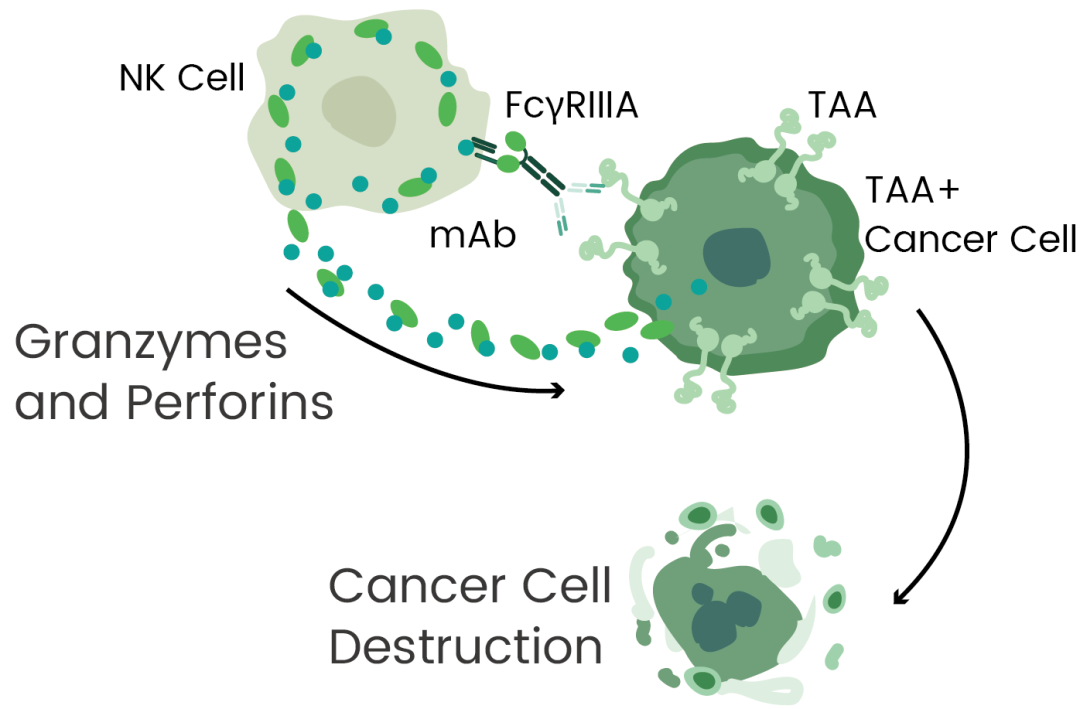
ADCC是抗体药杀伤肿瘤细胞或病原微生物的重要机制之一,已知NK细胞、巨噬细胞、中性粒细胞等参与ADCC作用。部分研究表明Fc尾与FcγRIIIA的高亲和力有益于抗体药的疗效。
增强ADCC活性的开发策略主要有:
1. 改造抗体Fc尾序列,提高抗体与FcγRs的亲和力。如抗体Fc尾改造Gly236Ala、 Ser239Asp、Ala330Leu和Ile332Glu (GASDALIE),可以将抗体与FcγRIIIA的亲和力提高20倍,而对抗体与FcγRIIB的亲和力影响极小。
2. 调整抗体Fc的糖基化修饰。如抗体平分型GlcNAc糖基化修饰可显着提高ADCC活性,核心岩藻糖和唾液酸的缺失也可提高抗体的ADCC活性。CHO细胞稳定表达外源GnTIII可协助抗体进行平分型GlcNAc糖基化,或敲除CHO细胞的FUT-8基因(或发酵时添加糖苷酶抑制剂kifunensine),都可作为提升抗体ADCC活性的方式。
3. 双特异/多特异抗体也是加强抗体药ADCC活性的重要方式。
未来联合治疗将为增强ADCC提供更多的可能。如激活CD40,降低或阻断Fc与FcγRIIB的结合(FcγRIIB抑制ADCC生物活性);或上调效应细胞上的Fc受体表达水平。另外,通过改造FcγRIIIA (Ser197Pro)来降低ADAM17对其清除,从而提高免疫细胞表面FcγRIIIA的丰度,iPSC来源的低清除FcγRIIIA的NK细胞为联合治疗提供另一个思路。
如何提高抗体药物半衰期
提高抗体药的半衰期,降低清除效率,可扩大治疗窗口期、降低给药频率,从而提高药物的疗效。

目前主要有3种方式可提高抗体药半衰期:
1. 增强抗体Fc尾与FcRn的亲和力。通过改造Fc尾,提高pH5.8亲和力,而基本不改变pH7.4亲和力,改造后的抗体药半衰期得到有效提高。在众多的改造方案中,DHS (L309D/Q311H/N434S)活性展现出了较大的优势,不仅提高半衰期,并保持了FcγRs结合能力以及ADCC活性。
2. 开发结合抗原pH依赖的抗体。TMDD(靶点介导的药物处置模型)消除快,半衰期短,导致血浆/血清抗体浓度低。开发pH敏感抗体成为克服TMDD消除快的可能。在这个模型下,抗体与抗原结合后内化至细胞的核内体中,pH6的酸性环境下抗体与抗原解离,抗体被FcRn转运回血浆,抗原则被细胞降解。
3. 降低抗体的等电点。研究表明负载阳离子分子比负载阴离子分子更易被细胞摄取、吞噬。所以在抗体优化的过程中,降低抗体的等电点是一个有价值方式。
临床/上市ADCC增强药物(部分)

Fc受体在抗体药物改造中的作用
如上所述,FcR在抗体药物改造中具有重要作用。FcR是一类能够和抗体Fc片段特异结合的细胞表面蛋白,结合不同类型抗体进而诱发免疫反应。抗体的Fc片段和宿主的免疫细胞表面的FcR结合,激活免疫细胞后通过ADCP、ADCC等机制,清除病原微生物或杀伤肿瘤细胞。
人体内有两类IgG的Fc受体(FcγR),一类为激活受体,包含 FcγRI (CD64)、FcγRIIA (CD32a)、FcγRIIC(CD32c)、FcγRIIIA (CD16a)和FcγRIIIB (CD16b);一类为抑制受体,FcγRIIB (CD32b)是唯一发现的Fc抑制受体。

为了保证临床疗效和安全性,抗体药需在临床前进行全面的评估。除亲和力和抗原特异性外,还包括ADCC、ADCP及CDC 等效应功能。FcγRs在ADCC、ADCP等效应功能上起到了关键作用,如FcγRIIIA (CD16a)激活NK介导的ADCC,FcγRIIA (CD32a) 和FcγRIIIA(CD16a)激活巨噬细胞介导的ADCP。
当然,根据药物作用机理的不同,部分抗体药需要将ADCC/ADCP/CDC等活性降低或完全消除,今天不展开描述。
义翘神州Fc受体蛋白验证数据
义翘神州作为国内生物试剂的龙头企业,提供FcR 精品蛋白,全面支持抗体药物开发。
人源FcγRIIIA / CD16a (V176)重组蛋白:10389-H08H1
HPLC和SDS-PAGE检测结果:蛋白纯度>95%

Purity: >95% as determined by SDS-PAGE & HPLC
ELISA检测结果:EC50 is 150-450 ng/mL.
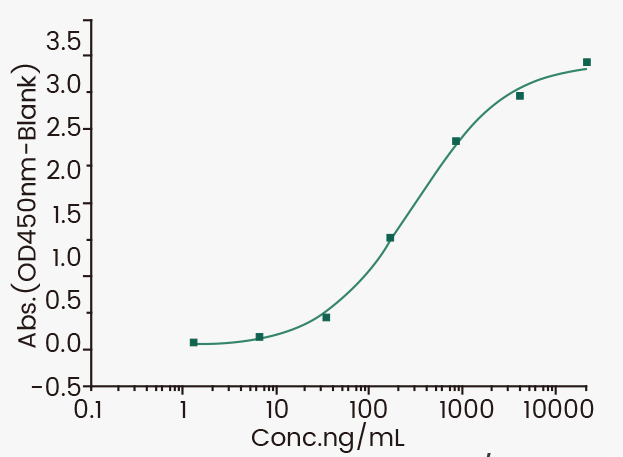
Immobilized Human FcγRIIIA / CD16a (V176) recombinant protein (Cat. 10389-H08H1) at 2 μg/mL can bind Human IgG1 (Cat. 10702-HNAC), the EC50 is 150-450 ng/mL.
BLI检测结果:亲和力常数为0.83 μM
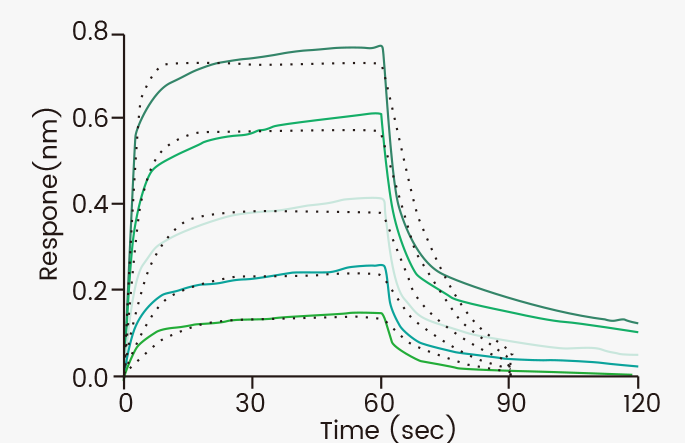
Loaded Human FcγRIIIA / CD16a (V176) recombinant protein (Cat. 10389-H08H1) on His1K Biosensor, can bind Bevacizumab (IgG1) with an affinity constant of 0.83 μM as determined in a BLI assay (ForteBio Octet Red384).
SPR检测结果:亲和力常数为0.31 μM

Captured Human FcγRIIIA / CD16a (V176) recombinant protein (Cat. 10389-H08H1) on Anti-His Chip can bind Bevacizumab (IgG1) with an affinity constant of 0.31 μM as determined in an SPR assay (Biacore T200).
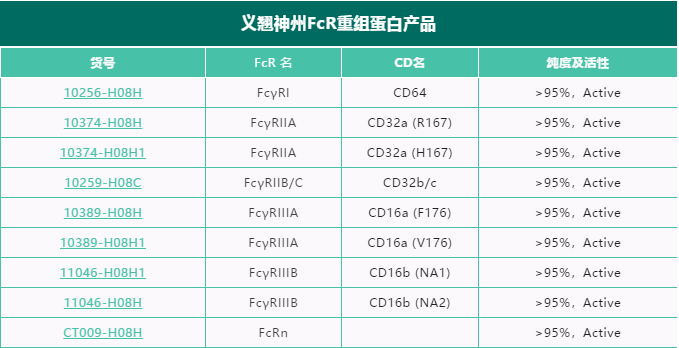
注:纯度为SDS-PAGE检测结果
参考资料:
[1]Narvekar, et al. ADCC enhancement: A conundrum or a boon to mAb therapy? Biologicals : journal of the International Association of Biological Standardization 79, 10-18(2022).
[2]Musolino, et al. Role of Fcγ receptors in HER2-targeted breast cancer therapy. Journal for immunotherapy of cancer 10, e003171 (2022).
[3]Gillis, et al. Contribution of Human FcgammaRs to Disease with Evidence from Human Polymorphisms and Transgenic Animal Studies. Frontiers in immunology 5, 254 (2014).
[4]Haraya, Tachibana and Igawa. Improvement of pharmacokinetic properties of therapeutic antibodies by antibody engineering. Drug metabolism and pharmacokinetics 34, 25-41 (2019).
[5]Lee, et al. An engineered human Fc domain that behaves like a pH-toggle switch for ultra-long circulation persistence. Nature communications 10, 5031 (2019).
[6]Dixon, Wu, and Walcheck. Engineering Anti-Tumor Monoclonal Antibodies and Fc Receptors to Enhance ADCC by Human NK Cells. Cancers 13 (2021).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言