Science:除了基因突变,肿瘤组织起源也很重要
2016-09-13 MedSci MedSci原创
9月9日,Science杂志上发表了题为“Tissue of origin dictates branched-chain amino acid metabolism in mutant Kras-driven cancers”论文。来自MIT等机构的科学家们在小鼠模型中进行了癌症研究。他们的发现再次肯定了先前的研究结果——基因突变和肿瘤组织起源都影响着恶性肿瘤细胞的行为。胰腺或肺部Kras的激活
9月9日,Science杂志上发表了题为“Tissue of origin dictates branched-chain amino acid metabolism in mutant Kras-driven cancers”论文。来自MIT等机构的科学家们在小鼠模型中进行了癌症研究。他们的发现再次肯定了先前的研究结果——基因突变和肿瘤组织起源都影响着恶性肿瘤细胞的行为。
胰腺或肺部Kras的激活和Trp53的缺失分别会引发胰腺导管腺癌(pancreatic ductal adenocarinoma ,PDAC)或非小细胞肺癌(NSCLC)。尽管引发癌症的起始事件(initiating events)相同,但这两种肿瘤利用支链氨基酸(branched-chain amino acids ,BCAAs)的方式并不同。
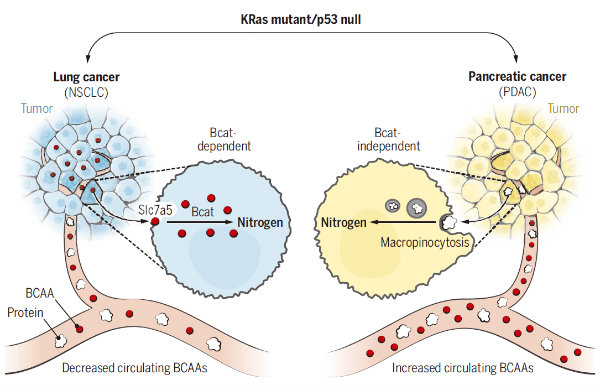
Metabolic differences in tumors of different origins.
NSCLC肿瘤会将自由的BCAAs合并到组织蛋白中,将BCAAs作为一种氮源。然而,PDAC肿瘤减少了BCAA的吸收。BCAA降解酶的表达水平反映了两者间的差异。Bcat1和Bcat2(利用BCAA所需的酶)的缺失影响了NSCLC肿瘤形成,但PDAC肿瘤形成并不需要这些酶。
研究揭示了肺肿瘤和胰腺肿瘤获取生存所需氮的不同方式,表明组织起源是癌症如何满足代谢需求的重要决定因素。
同日,Science杂志还针对这一研发发表了一篇题为“Location, location, location”的Perspective。作者们指出,在这项新研究中,科学家们证明,肿瘤首次出现的组织位置实际上与驱动突变的机制同样重要。文章指出,这一结果不仅为组织起源在肿瘤发展中发挥作用提供了更多的证据,也可能会引起与肿瘤生长早期区域相关标志物的发展。
原始出处
Jared R. Mayers1,2,*, Margaret E. Torrence1,2,*, Laura V. Danai1, Thales Papagiannakopoulos1,†, Shawn M. Davidson1,2, Matthew R. Bauer1, Allison N. Lau1, Brian W. Ji3, Purushottam D. Dixit3, Aaron M. Hosios1,2, Alexander Muir1, Christopher R. Chin1, Elizaveta Freinkman1,2,4,5,6, Tyler Jacks1,2,6, Brian M. Wolpin7, Dennis Vitkup3, Matthew G. Vander Heiden1,2,5,7.Tissue of origin dictates branched-chain amino acid metabolism in mutant Kras-driven cancers.2016
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













很好,谢谢,很有帮助。
75
#SCIE#
55