Nature:重磅!揭示贪婪的胰腺癌细胞逃避饥饿机制
2016-08-12 佚名 生物谷
一项新的研究中,来自美国纽约大学朗格尼医学中心、哈佛大学达纳-法伯癌症研究所和密歇根大学医学院等机构的研究人员通过利用胰腺癌细胞和小鼠开展实验,发现胰腺癌细胞在致密的肿瘤中通过命令附近的支持细胞(support cell,即后面提到的胰腺星状细胞)给它们提供替代性营养来源,从而避免饥饿。相关研究结果于2016年8月10日在线发表Nature期刊上,论文标题为“Pancreatic stel
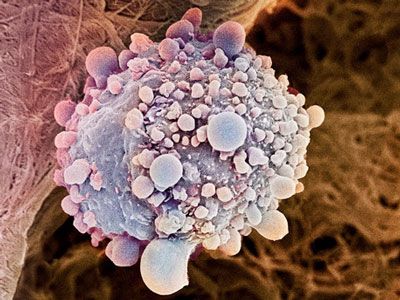
这些结果围绕着当在正常情形下由血液供应的氧气和血糖(即葡萄糖)处于短缺时,胰腺癌细胞寻找能量的独特能力。这就是肿瘤内异常的细胞生长快速地消耗掉可获得的资源时发生的情形。
这项新研究是首次揭示出胰腺癌细胞发送信号给胰腺星状细胞(stellate cell),然后胰腺星状细胞在胰腺中分泌物质从而为胰腺癌细胞生长提供支持。这会导致胰腺星状细胞将它们自己的细胞组分降解为构造单元,如蛋白的构造单元是氨基酸(如丙氨酸),DNA的构造单元是4种碱基:A、T、C和G。胰腺癌细胞然后将丙氨酸转运到它们的线粒体中,利用它作为替代葡萄糖的能源。
论文共同通信作者、纽约大学朗格尼医学中心劳拉与艾萨克-帕尔穆特癌症中心放射肿瘤科主任Alec Kimmelman博士说,“我们的研究提供更多的证据证实胰腺癌不仅区别性地使用能源,而且也要比很多其他的癌症类型更加高效地寻找它。”
Kimmelman说,“这项研究确定了肿瘤与星状细胞之间存在的一种新类型的交谈。了解这一点可能有助这个领域的科学家们设计出药物来干扰令人吃惊的让这些癌症变得如何独特的代谢灵活性。”
面临饥饿
考虑到胰腺癌细胞继续在低营养的环境中生长,研究人员试图确定胰腺星状细胞是否能够给这些肿瘤细胞提供能量。实验表明确实,胰腺星状细胞分泌代谢物导致癌细胞中的线粒体代谢增加了20%到40%和促进癌细胞生长。他们接下来试图确定哪些分泌的代谢物被胰腺癌细胞摄取从而促进这种增加的线粒体代谢。在分析的大约200种代谢物中,仅有氨基酸丙氨酸和天冬氨酸符合这种情形,而且只有丙氨酸显著地增加线粒体代谢和肿瘤细胞增殖。
研究人员接下来试图确定这些胰腺癌细胞如何使用丙氨酸。他们对组成丙氨酸的碳分子进行标记,随后证实胰腺癌细胞将丙氨酸转化为相关的代谢物,并且让它进入线粒体中的三羧酸循环(TCA),从而导致能量产生。重要的是,利用丙氨酸,这些肿瘤细胞能够将葡萄糖转移到其他的关键性途径,如制造DNA构造单元的那些途径。
再者,研究人员发现胰腺癌细胞通过分泌一种仍然未知的因子指示胰腺星状细胞发生一种被称作自噬的过程来提供更多的丙氨酸。自噬在细胞生命中发挥着重要的作用。在自噬过程中,受损的细胞部分经膜包裹后形成囊泡,这些囊泡就像小细胞(mini cell)那样与溶酶体融合在一起。这些溶酶体接着将囊泡中的蛋白和脂肪降解为代谢物,而这些代谢物经回收后构建新的DNA链和膜。没有这些构造单元在边上,癌细胞不能够增殖。
研究人员随后测试了这种代谢交谈在小鼠体内的胰腺癌生长中的重要性。鉴于胰腺星状细胞分泌的丙氨酸依赖于自噬,他们能够在胰腺癌小鼠的胰腺星状细胞中使用基因技术破坏这种自噬过程。当胰腺星状细胞的自噬过程受到抑制时,小鼠体内的肿瘤生长受到极大的阻断。
纽约大学朗格尼医学中心首席科学家、科学副主任和高级副总裁Dafna Bar-Sag博士在之前的研究中已发现胰腺癌细胞在它们自己的表面上产生囊泡来捕获附近漂移的蛋白,并且通过一种被称作巨胞饮(macropinocytosis)的过程将它们摄取到这些癌细胞内。Bar-Sagi和Kimmelman正在合作确定巨胞饮和自噬是否相互协作将捕获的蛋白和脂质运输到饥饿的胰腺癌细胞中的溶酶体内。
Kimmelman说,“几项利用药物羟氯喹(HCQ)抑制溶酶体从而可能同时下调自噬和巨胞饮的临床试验已在开展。尽管已报道这些早期的临床试验取得一些积极的结果,但是我们希望人们开发出更加强效的特异性更好的自噬和溶酶体抑制剂。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Nat#
74
值得收藏
95
继续学习
104
继续学习
119
继续学习
100
#重磅#
77
#饥饿#
68
#癌细胞#
59
继续关注,
73
继续学习
98