“温和的癌症”深藏邪恶之力,研究证实并不是无计可施!
2020-08-13 陶然 健康界
在所有癌症中,甲状腺癌是最常见的内分泌系统恶性肿瘤。根据甲状腺癌病理组织类型可将甲状腺癌分为分化型(包含乳头状甲状腺癌和滤泡状甲状腺癌,DTC)、低分化型(PDTC)和未分化型(ATC)。
在所有癌症中,甲状腺癌是最常见的内分泌系统恶性肿瘤。根据甲状腺癌病理组织类型可将甲状腺癌分为分化型(包含乳头状甲状腺癌和滤泡状甲状腺癌,DTC)、低分化型(PDTC)和未分化型(ATC)。众所周知,甲状腺癌常被称为“最温和的癌症”,这是因为以DTC为主的甲状腺癌预后较好,进展缓慢,10年生存率高,但某些组织学亚型易发生甲状腺腺外侵犯、血管侵袭和远处转移,复发率高,预后相对较差。
ATC是侵袭性最强、致死性最强的实体肿瘤之一。美国最终结果数据库分析(1986-2015)ATC报告中位总生存(OS)为4个月,6个月OS为35%,而疾病特异性死亡率为98%~99%。与预后良好、以手术为主的DTC不同,ATC患者通常表现为快速生长、浸润性颈部肿块、局部颈部淋巴结受累,约一半的患者还伴有远处转移性疾病。
因此,ATC患者通常不可手术,并且一直被姑息治疗或转诊到临终关怀。尽管ATC在甲状腺癌中所占比例不到2%,但据估计每年超过50%的甲状腺癌相关死亡是由它引起。然而,近来年ATC在治疗上的主要进展与OS之间的联系还有待评估。8月6日,JAMA子刊在线刊发一篇报道“Evaluation of Overall Survival in Patients With Anaplastic Thyroid Carcinoma, 2000-2019”,评估了近20年来ATC患者OS的发生率。

在这项跨度近20年的大型单机构队列研究中,患者管理的改变似乎与生存率的显著提高相关。随着手术和放射治疗等多学科治疗的整合,以分子为基础的个性化治疗正在逐步取代无法治疗的ATC时代。
多模式治疗各显神通
该研究回顾性评估了2000年1月-2019年10月在德克萨斯大学安德森癌症中心就诊并经病理证实的ATC患者,收集了患者的人口统计学特征、年龄校对后的查尔森合并症指数以及BRAF V600E分子检测和治疗方式(细胞毒性化疗、靶向治疗、免疫治疗、手术和放射治疗)的数据,并且根据就诊的日期将患者分为了3个亚组:2000年1月-2013年12月,2014年1月-2016年12月,2017年1月-2019年10月,分组年份的选择是根据癌症中心治疗模式的变化,详见图A和图B。(BRAFi表示BRAF抑制剂;cfDNA表示无细胞DNA;CTx表示细胞毒性化疗;EBRT表示体外放射疗法;IHC表示免疫组织化学;MEKi表示MEK抑制剂)

A:IVA期接受手术+EBRT+CTx。IVB/IVC期接受新辅助BRAFi/MEKi+/-免疫治疗。如果肿瘤可以切除,则在新辅助BRAFi/MEKi的3个月内可以进行手术。IVB期术后行EBRT+CTx治疗。BRAFi/MEKi免疫治疗在辐射期间(存在辐射召回风险)暂停,在辐射后恢复。IVC阶段术后重启BRAFi/MEKi+/-免疫治疗,不提供EBRT(放疗期间药物滞留可能导致远处转移的进展)。
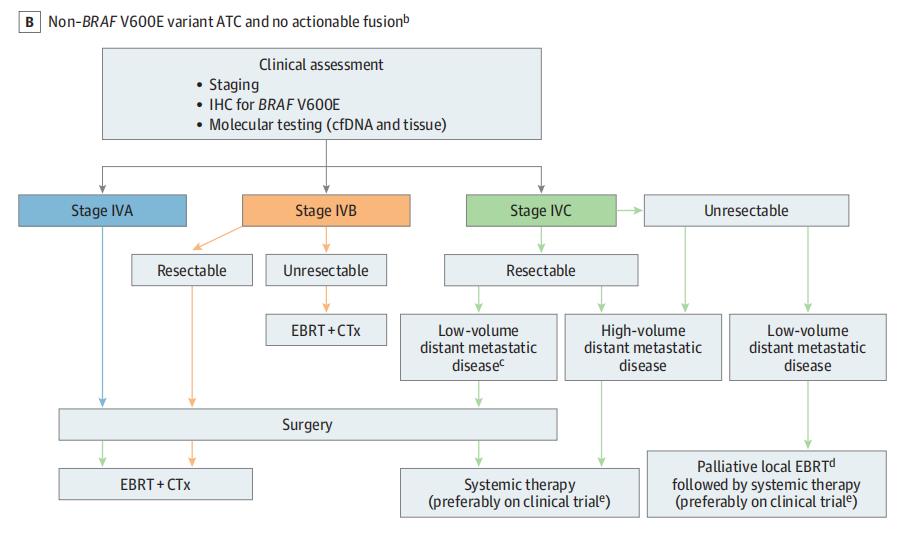 B:IVA/IVB期肿瘤可切除则接受手术+EBRT+CTx。不可切除的IVB期接受EBRT+CTx。IVC期合并可切除的低容积远处转移性病变需手术治疗。那些低容积不可切除的患者接受姑息性放疗,然后进行全身治疗。那些大容积不可切除的患者接受全身治疗。IVC期混合反应接受立体定向放射治疗以治疗进展性少的病变。如果无法忍受治疗,则提供临终关怀。
B:IVA/IVB期肿瘤可切除则接受手术+EBRT+CTx。不可切除的IVB期接受EBRT+CTx。IVC期合并可切除的低容积远处转移性病变需手术治疗。那些低容积不可切除的患者接受姑息性放疗,然后进行全身治疗。那些大容积不可切除的患者接受全身治疗。IVC期混合反应接受立体定向放射治疗以治疗进展性少的病变。如果无法忍受治疗,则提供临终关怀。
三种治疗方式有效改善OS
纳入的479例患者中,246例男性(51%),233例女性(49%),中位年龄为65.0岁,年龄范围为21.1~92.6岁,其中52例(11%)为IVA期,172例(36%)为IVB期,255例(53%)为IVC期。
2000-2013年,中位OS为0.67年;2014-2016年中位OS为0.88年;2017-2019年,中位OS为1.31年。整个队列的平均OS为0.79年(9.5个月),范围为0.01~16.63。与OS改善相关的因素包括靶向治疗、靶向治疗中加入免疫治疗、以及新辅助BRAF指导治疗后的手术。
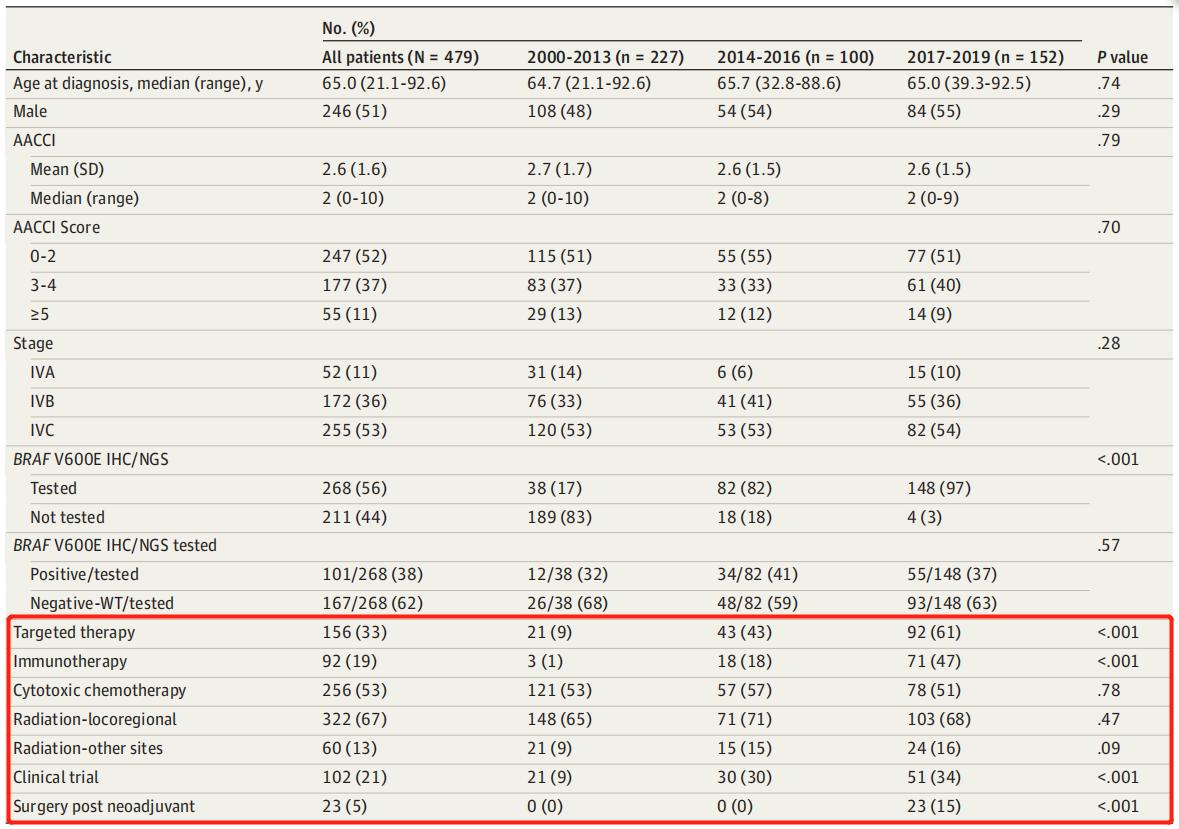 图1 三组患者的基线特征
图1 三组患者的基线特征
靶向治疗:随着时间的推移,靶向治疗的使用显著增加,这与中位OS改善相关(接受靶向治疗的患者为1.31年,而未接受靶向治疗的患者为0.63年,风险比为0.49)。
靶向治疗中加入免疫治疗:与2000-2013年(1%)和2014-2016年(18%)组相比,2017-2019年组(47%)的免疫治疗使用也显著增加(P<0.001)。对于2014-2019年间的患者,接受免疫治疗靶向治疗的患者(76例)与接受靶向治疗而不接受免疫治疗的患者(59例)的OS显著升高[1.99年(23.9个月) vs 1.20年(14.4个月)],这意味着生存率提高了0.79年(9.5个月)。
新辅助BRAF指导治疗后的手术:术前新辅助BRAF指导治疗(仅在2017-2019年实施)也与生存率的提高相关。比较接受BRAF指导治疗的患者是否接受手术,前一组的中位OS没有达到(平均随访1.21年),而后一组的中位OS为0.80年(风险比为0.29)。
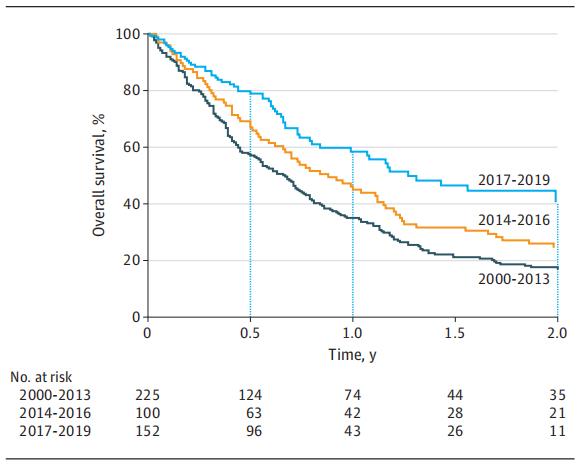
图2 ATC患者的两年OS(按发病年份)
循证数据引导治疗新方向
最近,几个主要的中心报道了几十年来选择ATC治疗方案的经验,尤其是那些能够接受手术和常规放化疗的患者。
• 梅奥诊所公布了在13年期间(2003-2015年)对48例接受多模式治疗的ATC患者的治疗结果,包括手术、紫杉烷类化疗和放疗,报告中位OS为9个月,1年OS为42%。
• 葡萄牙肿瘤研究所报告说,在超过18年(2000-2018年)的79例ATC患者中,平均生存期为2个月,其中患者接受包括手术、放疗和化疗在内的单一或多模式治疗。
• 采用类似的治疗方法,杜克大学公布了在25年(1990-2015年)的28例患者中,平均生存期为4个月,一年生存率为18%。
• Memorial Sloan-Kettering癌症中心最近公布了一组104例接受放射治疗(1984-2017年)的ATC患者的回顾性数据,这些患者在33年(1984-2017年)的时间里接受了同步放化疗(以阿霉素或紫杉醇为基础)或手术和同步放化疗。Memorial Sloan-Kettering症中心整体队列的中位生存期为7个月,一年生存率为34%,而选择性接受手术和术后同时放化疗的患者(n=53)的一年生存率为55%。
在本研究中,尽管由于多种混杂因素,生存率的提高不能直接归因于免疫治疗,特别是同时使用靶向治疗时。虽然单药免疫疗法在治疗ATC方面并没有显示出很大的前景,正在进行和/或已完成的临床试验正在研究将pembrolizumab和atozolizumab等免疫治疗剂与靶向治疗相结合的潜力,至今已取得了显著的效果。而增加免疫疗法的基本原理是所有患者最终对激酶抑制剂靶向治疗产生耐药性,免疫治疗可能会延迟和/或防止耐药性变异的出现,并在需要时(如由于毒性、手术期间、放疗期间)提供保持靶向治疗的能力,从而维持疾病控制。
综合以上研究可以发现,在过去的5年中,无论疾病处于哪个阶段,ATC的治疗方法已经从最初的姑息治疗和临终关怀治疗发展到了有效的高度专业化的基于分子的个性化疗法和适当的外科手术。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言