徐国良院士领衔!找到调节骨骼发育并推进临床诊断的靶基因
2022-08-15 转化医学网 转化医学网
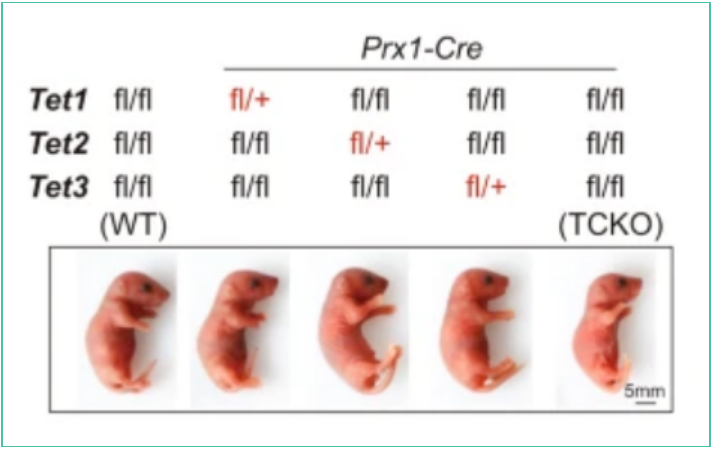
研究表明,中胚层间充质干细胞中所有三种TET蛋白的丢失导致严重的骨缺损,并且Tet基因的任何单个等位基因都可以挽救骨发育的缺陷。
导读:在哺乳动物胚胎发生过程中,已经确定了两种类型的骨形成,长骨最初形成为一个框架,或起源于间充质干细胞(MSCs)的透明软骨的细胞,然后在称为软骨内骨化的过程中被成骨细胞的矿物质沉积所取代。
近日,来自上海生物化学与细胞生物学研究所的徐国良院士、邹卫国研究员联合上海交通大学以及浙江大学的研究团队等报道中胚层间充质干细胞中的Tet基因缺乏导致骨骼发育的严重缺陷。相关研究成果发表在《Nature Communication》杂志上。研究结果表明,TET酶具有调节RUNX2活性和维持骨骼稳态的功能。

https://www.nature.com/articles/s41467-022-32138-x
导致骨缺损的基因
01
研究表明,中胚层间充质干细胞中所有三种TET蛋白的丢失导致严重的骨缺损,并且Tet基因的任何单个等位基因都可以挽救骨发育的缺陷。另一项研究表明,Tet1,Tet2和Tet3在人和小鼠BMMSCs中均有表达,但只有Tet1和Tet2在卵巢切除术(OVX)小鼠衍生的BMMSCs中降低。与PT小鼠相比,Tet1和Tet2双条件敲除小鼠在P0下显示出细微的差异,表明在胚胎骨形成期间,Tet3可以在没有Tet1和Tet2的情况下提供补偿功能。这些观察结果表明,在骨骼发育过程中,三种TET蛋白之间的功能补偿,类似于早期原肠胚形成的过程。
TET蛋白在调节基因表达方面具有双重功能。启动子区域TET介导的去甲基化与活性基因表达相关。此外,TET蛋白通过与某些调节因子和蛋白质复合物结合来参与基因沉默。例如,TET蛋白可以与PRC2和SIN3A等染色质抑制复合物相互作用,以抑制基因抑制。TCKO细胞中上调的基因可能以这种方式受到调节。神经活性配体-受体相互作用和轴突引导途径在TCKO细胞的上调基因中富集。在上调基因中,据报道,成骨细胞衍生的Cox2可以促进感觉神经纤维的神经支配。感觉神经可以维持骨量累积,这可能是TCKO小鼠骨质流失的补偿结果。
基因测序分析
02
TET介导的DNA去甲基化控制胚胎干细胞的适当分化,并且TET成员在早期原肠胚形成期间表现出功能冗余。然而,目前尚不清楚TET蛋白在哺乳动物骨骼发育中是否具有功能意义。在这里,研究人员发现任何单个Tet基因等位基因的存在都可以支持早期骨骼形成,这表明TET蛋白的功能冗余。
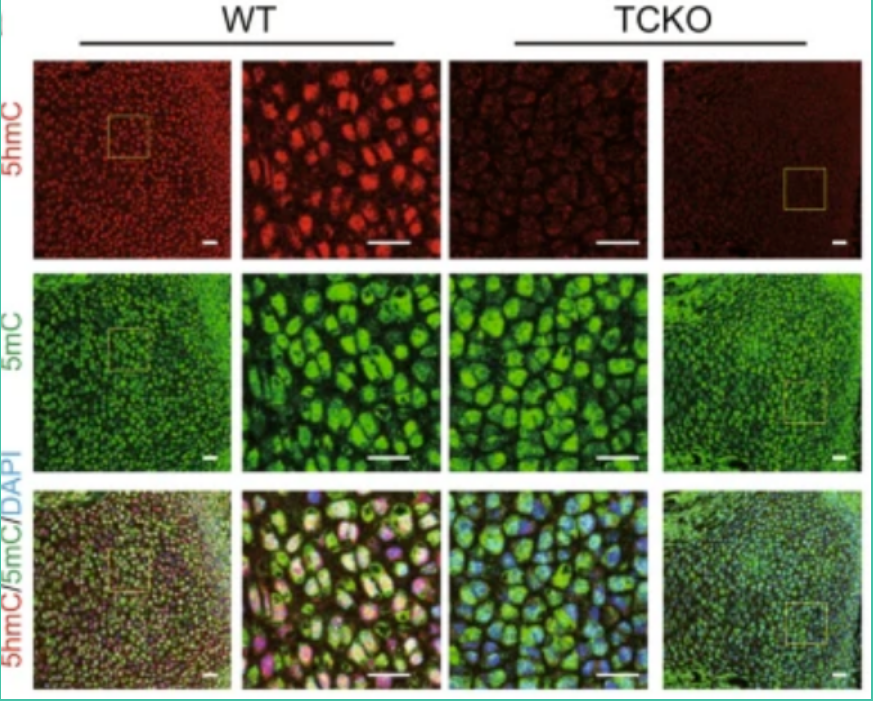
RNA-seq,全基因组亚硫酸氢盐测序(WGBS),5hmC-Seal和转座酶可及染色质(ATAC-seq)测定的综合分析表明,TET介导的去甲基化通过RUNX2和设施RUNX2调节转录增加了靶基因的染色质可及性。此外,TET蛋白通过其催化结构域与RUNX2相互作用,以调节RUNX2结合区周围的胞嘧啶甲基化。催化结构域对于TET酶调节其靶基因上的RUNX2转录活性和调节骨骼发育是必不可少的。
临床转化
03
由于TET蛋白可以与RUNX2相互作用并调节RUNX2靶向基因表达,并且RUNX2可以影响软骨内膜和膜内骨形成,因此TCKO小鼠中较短的锁骨可能是由TETs蛋白丢失引起的RUNX2靶向基因表达失调引起的。
总之,相关研究发现,TET家族介导的DNA去甲基化对于维持胚胎骨形成是必不可少的。Tet1、Tet2 和 Tet3 对于此过程在功能上是冗余的。成骨基因上TET蛋白的特异性DNA去甲基化需要RUNX2指导,这反过来又促进了这些靶向基因的表达。这一研究扩展了对RUNX2上DNA甲基化的理解,可运用于调节骨骼发育并推进临床诊断。
参考资料:
https://www.nature.com/articles/s41467-022-32138-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#靶基因#
99
#发育#
100
#临床诊断#
92