来瑞特韦vs辉瑞Paxlovid,两者结构差异性告诉您该如何选
2023-06-15 梅斯医学 梅斯医学 发表于上海
3CL抑制剂是理想的口服抗新冠病毒治疗药物。与辉瑞Paxlovid相比,来瑞特韦与蛋白结合结构更加清晰准确,药物靶点停留时间长,消除半衰期和维持血药浓度等药代动力学特性更优越2。
中国疾病预防控制中心披露的国内新冠二次感染最新数据显示1,在首次感染新冠Omicron变异株6个多月后,再次感染新冠病毒的几率明显增加,总体新冠再感染发生率达28.3%,按主要感染毒株分类时,原始毒株的再感染发生率为50.0%, Alpha 或 Delta 为35.2%,Omicron 为18.4%,且距离首次感染时间越长,再次感染发生率越高。

图1图源:中国疾病预防控制中心周报
如今距离第一波感染高峰已过去4个月,又恰好出现了XBB株系感染上升,这不得不让我们担忧第二波疫情是否即将到来,因此,“二阳”来袭,有效防治极为重要。针对病毒复制周期的小分子抑制剂是我国目前推荐的针对SARS-CoV-2病毒的主要抗病毒治疗方案之一,其中3CL抑制剂是理想的口服抗SARS-CoV-2病毒药物,包括辉瑞Paxlovid(奈玛特韦/利托那韦)以及众生来瑞特韦等。临床药物治疗在Paxlovid和来瑞特韦中如何选择呢,二者的结构差异或可揭示答案。
来瑞特韦vs辉瑞Paxlovid结构的差异性
来瑞特韦和Paxlovid同属于3CL抑制剂,均对病毒复制中所必需的病毒蛋白酶Mpro活性有抑制作用,二者作用机制和抗病毒效力相似,但在结构上存在明显差异,可能对二者解离速度、药物靶点停留等特性产生影响。
化学结构式上,来瑞特韦由P1‘α-酮酰胺基团、P1焦谷氨酰胺、P2环戊基脯氨酸、P3环己基甘氨酸和P4三氟乙酰胺组成2(图2)。
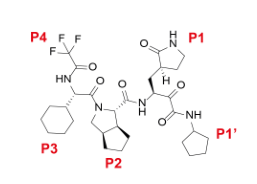
图2来瑞特韦化学结构式
辉瑞Paxlovid是由奈玛特韦和利托那韦两种活性物质组成,其中奈玛特韦具有抑制病毒作用,利托那韦用以维持奈玛特韦在体内的浓度和活性。化学结构上,奈玛特韦的P1残基是一个谷氨酰胺替代物,模仿GC376的等效残基,其中最核心的部分在于在P1残基中含有一个腈弹头(图3),与催化剂Cys145形成可逆的共价硫咪酯加合物,从而抑制了蛋白酶的生物学活性4。
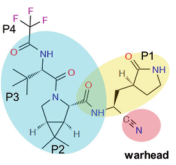
图3奈玛特韦化学结构式
与Paxlovid相比,来瑞特韦在化学结构式上将P1-P4四个基团进行了优化:首先P1’片段中的氰基优化为α-酮酰胺,其可以有效通过氢键与Mpro活性位点的氨基酸结合,从而达到抑制作用;其次P2的疏水性增强更有利于位点结合;P3作为一个环己烷基团可以使其疏远M pro结合位点(图4)。
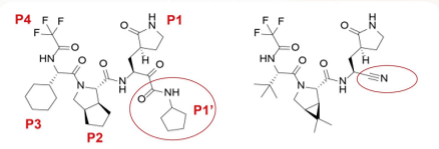
图4 来瑞特韦(左)和奈玛特韦(右)对比
在来瑞特韦Mpro酰基酶复合物的晶体结构中,来瑞特韦与蛋白结合结构清晰准确,且形成了更稳定的酰基酶加合物,通过占据3CLpro活性催化区域发挥抗病毒作用。与Paxlovid活性成分奈玛特韦相比,增加三个结合位点,共价粘附的药物与SARS-CoV- 2 Mpro酶之间的相互作用更广泛2(图5)。
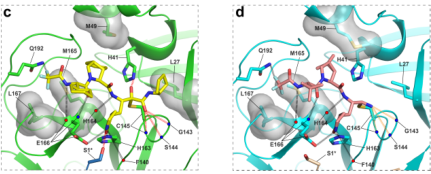
图5来瑞特韦(左)、奈玛特韦(右)和Mpro活性位点之间的详细相互作用
以上结构的差异表明来瑞特韦单药结构更强势,有效延缓了其在蛋白酶抑制剂复合物中的解离速度,药物靶点停留时间延长了约12倍,奈玛特韦药物靶点停留时间为9分钟来瑞特韦为104分钟2。
药物的性质与其结构密切相关,结构决定了化合物的化学性质及活性、药代动力学等生物性质。来瑞特韦和Paxlovid结构上的差异使得二者药代动力学特性也有所不同。
来瑞特韦vs辉瑞Paxlovid药代动力学差异
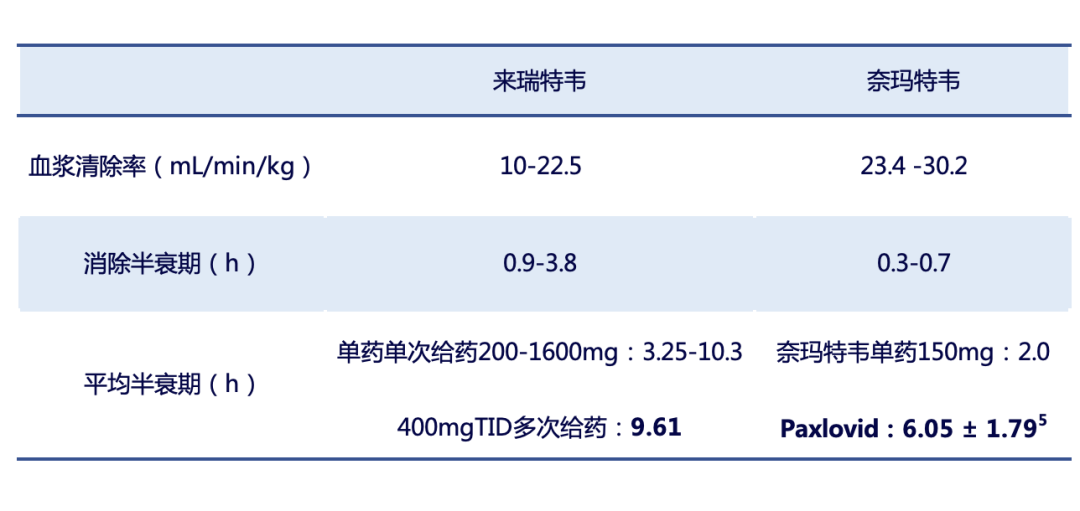
药代动力学研究发现,在不同动物中,来瑞特韦的血浆清除率和消除半衰期均优于Paxlovid活性成分奈玛特韦,表明与Paxlovid相比,来瑞特韦血浆清除效果和消除半衰期显著改善,可以更长时间维持较高的血药浓度,这使得来瑞特韦不需要联用利托那韦,因而有效避免利托那韦带来的不良药物相互作用,具有更优越的药代动力学特性2。
表1来瑞特韦和Paxlovid活性成分奈玛特韦的药代动力学对比
总结
3CL抑制剂是理想的口服抗新冠病毒治疗药物。与辉瑞Paxlovid相比,来瑞特韦与蛋白结合结构更加清晰准确,药物靶点停留时间长,消除半衰期和维持血药浓度等药代动力学特性更优越2。另外,来瑞特韦单药结构强势,不需要联合利托那韦,临床使用更加安全便利,减少了用药限制,患者依从性更好,对于高龄、有基础疾病等特殊人群患者也安全耐受,未来或可成为临床常用治疗方案,为更多患者带来更大获益。
参考文献:
1.Preplanned Studies: The Associated Factors of SARS-CoV-2 Reinfection by Omicron Variant — Guangdong Province, China, December 2022 to January 2023
2.Inhibition mechanism and antiviral activity of an α-ketoamide based SARS-CoV-2 main protease inhibitor. bioRxiv 2023.
3.Owen DR, Allerton CMN, Anderson AS, et al. An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19. Science. 2021;374:1586–93.
4.Wu CR, Yin WC, Jiang Y, et al. Structure genomics of SARS-CoV-2 and its Omicron variant: drug design templates for COVID-19. Acta Pharmacol Sin. 2022 Dec;43(12):3021-3033.
5.US Food and Drug Administration. Fact Sheet for Healthcare Providers: Emergency Use Authorization for Paxlovid. (2023). Accessed: January 6, 2023: https://www.fda.gov/media/155050/download.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








