环状RNA(circRNA)背景、特征以及在临床疾病中的应用
2015-12-03 MedSci MedSci原创
环状RNA(circRNA)背景知识环状RNA(circRNA)是一类特殊的非编码RNA分子,也是RNA领域最新的研究热点。与传统的线性RNA(linear RNA,含5’和3’末端)不同,circRNA分子呈封闭环状结构,不受RNA外切酶影响,表达更稳定,不易降解。 由于环状RNA对核酸酶不敏感,所以比线性RNA更为稳定,这使得环状RNA在作为新型临床诊断标记物的开发应用上具有明显优势。
环状RNA(circRNA)背景知识
环状RNA(circRNA)是一类特殊的非编码RNA分子,也是RNA领域最新的研究热点。与传统的线性RNA(linear RNA,含5’和3’末端)不同,circRNA分子呈封闭环状结构,不受RNA外切酶影响,表达更稳定,不易降解。
由于环状RNA对核酸酶不敏感,所以比线性RNA更为稳定,这使得环状RNA在作为新型临床诊断标记物的开发应用上具有明显优势。
在功能上,近年的研究表明,circRNA分子富含microRNA(miRNA)结合位点,在细胞中起到miRNA海绵( miRNA sponge)的作用,进而解除miRNA对其靶基因的抑制作用,升高靶基因的表达水平;这一作用机制被称为竞争性内源RNA(ceRNA)机制。通过与疾病关联的miRNA相互作用, circRNA在疾病中发挥着重要的调控作用。
图释:circRNA在哺乳动物细胞中的形成
circRNA特征
• circRNA没有“尾巴”
常规存在于线性RNA分子中的3’和5’端在环状RNA中被连接形成了闭合环状结构(图1)。而经典的RNA检测方法只能分离具有PolyA“尾巴”结构的RNA分子,所以环转RNA在以往的研究中通常被忽略了。
• circRNA不翻译
虽然很多circRNA是由蛋白编码基因产生,但是还没有结果显示circRNA在细胞中编码蛋白。环状RNA也因此被定义为一类新型非编码RNA。
• circRNA的细胞定位和稳定性
大部分环状RNA在细胞浆中富集,其丰度有时甚至比相应的线性mRNA高10余倍,这可能是由于环状RNA比线性RNA更稳定造成的。核酸酶往往通过识别线性RNA分子末端发挥作用,环状RNA是一个闭合结构,因此对核酸酶具有高耐受性。
circRNA作为内源性竞争RNA(ceRNA)
环状RNA在细胞质中富集,同时与对应的线性RNA具有相同的转录序列,说明环状RNA很有可能是通过影响miRNA的结合来行使功能。近来发现的一个环状RNA-CDR1as (也称为ciRS-7) ,在其序列上有超过60个保守的miR-7结合位点,因此起到有效的miR-7海绵作用,能够影响miR-7靶标基因活性。在斑马鱼实验中,该环状RNA的表达能够损害中脑发育,与敲除miR-7效果一致。此外,Sry 也被证实起到miR-138的海绵作用。通过高通量测序和生物信息学分析手段,研究者们在哺乳动物转录组中发现了数以千计的环状RNA,说明环状RNA很有可能就是一类新的调控型內源竞争性RNA(ceRNA)。更为重要的是,由于环状RNA的高表达和稳定特性,它在与其它的线性內源竞争性RNA共同作用过程中能够显示异常突出的ceRNA活性。
除了ceRNA活性,环状RNA也有可能与RNA结合蛋白RBPs结合,或与其它RNA碱基互补结合甚至结合RNA的翻译蛋白,从而影响基因的正常功能。
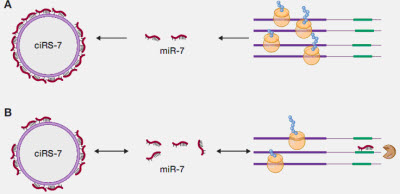
图释:ciRS-7 的miR-7海绵作用
circRNA来源
circRNA是一类通常由一个以上外显子构成的环形RNA分子,由特殊的选择性剪切产生,大量存在于真核细胞的细胞质中。那么circRNA是如何产生的呢?2013年北卡罗来纳大学医学院的Jeck WR等提出了circRNA发生的两种模型: 套索驱动的环 化(lariat-driven circularization)和内含子配对驱动的环化(intron-pairing-driven circularization)。 它 们生成的第一步是不同的: 套索驱动的环化由外显子组成的剪接供体(splice donor)和剪接受体(splice acceptor)共价结合, 而内含子配对驱动的环化则由2 个内含子互补配对结合, 从而形成环状结构。在接 下来的步骤中, 这两种模型的过程基本一致, 即:剪接体(splicesome)切除剩余内含子和形成circRNA。

中科院上海生命科学研究院的研究人员在新研究中证实,是内含子的互补序列介导了外显子环化。这一研究发现发表在9月18日的《细胞》(Cell)杂志上。上海生科院计算生物所的杨力(Li Yang)研究员和上海生命科学院生物化学与细胞生物学研究所的陈玲玲(Ling-Ling Chen)研究员是这篇论文的共同通讯作者。杨力研究员的主要研究方向是在在全转录组水平对RNA的重要生理功能及其调控作用进行系统研究。陈玲玲研究员主要研究方向为长非编码RNA和干细胞。
在这篇文章中,研究人员利用全基因组分析方法和circRNA重演,证实是外显子环化依赖于两侧的内含子互补序列。这样的序列和分布显示快速的进化改变,表明外显子环化在进化上呈动态。引人注目的是,研究人员发现侧翼内含子之间及个别内含子内部的RNA配对之间的竞争可以影响外显子环化效率。选择性RNA配对和它们之间的竞争导致了选择性的环化,使得一个基因可以生成多种circRNA转录物。
这些结果支持了内含子配对驱动环化这一假说,证实是内含子的互补序列介导了外显子环化,生成的选择性环化产物有可能进一步扩大了哺乳动物转录后调控的复杂性。
circRNA与疾病
近来研究开始关注于circRNA可能在疾病病理方面起到的作用。例如,环状ANRIL(cANRIL)是长链非编码RNA ANRIL的环状拼接形式,其在人类细胞中的表达与该位点上几个可能影响ANRIL拼接的SNP有关,能调节INK4/ARF的水平并增加动脉粥样硬化的风险。这项研究充分证明circRNA与疾病的发生存在关联,并能很好地作为疾病新型生物标记。
此外,更多的证据显示,环状RNA在miRNA水平的微调上起着非常重要的作用,通过竞争结合miRNA来调控基因的表达。而与疾病关联miRNA的相互作用则说明环状RNA能够参与疾病调节。
例如,进化上古老的microRNA-7(miRNA-7;chr 9q21.32;人类脑基因表达的重要转录后调节因子)不仅在人类脑中是高丰度的,而且与相同组织中的一个环状RNA(ciRS-7)相关;ciRS-7包含多个、串联的anti-miRNA-7序列。ciRS-7因此充当了一类内源性、竞争性、抗互补的miRNA“海绵”以吸收,并因此淬灭正常miRNA-7功能。
使用RNA印迹杂交技术和环状敏感性circRNA探针RNaseR,这里,我们提供了散发性老年痴呆症(Alzheimer's disease,AD)海马CA1区中的一个误调节miRNA-7-circRNA系统的最初证据。正如观测到的,ciRS-7及ciRS-7“海绵活性”的不足可能预期增加受AD影响的脑细胞中周围miRNA-7的水平,以最终促进选择性miRNA-7敏感mRNA靶的下调。由于ciRS-7“海绵”效应的缺乏,上调miRNA-7的出现具有高的概率以下调AD相关靶,例如,泛素蛋白连接酶A(UBE2A;miRNA-7-UBE2A mRNA关联能量,EA=-22.86 kcal/mol)。在AD和其他人类CNS进展性炎症变性中淀粉样肽清除中至关重要的自噬蛋白UBE2A在AD脑中是贫化的。这种被一群细胞和/或组织富集的circRNAs调节的miRNA-mRNA调控系统可能代表了健康和疾病中基因表达之上的另一种重要的表观遗传控制层次。当然,ncRNAs领域中的技术进展和最新发现继续挑战我们核苷酸生物化学和进化生物学的基本学说。其他circRNA介导的“miRNA海绵系统”的缺乏和周围特定可诱导miRNAs的上调可能帮助揭示广泛观测的,普遍的和进展的基因表达下调,这是散发性AD脑的特征。
考虑到miR-7是各种不同癌症相关通路的重要调节因子,同时也因能直接调节a-突触核蛋白和泛素蛋白连接酶A(UBE2A)的表达而可能与帕金森和阿兹海默疾病的发生相关,所以ciRS-7也很有可能作为神经性系统疾病和癌症发生的重要调节因子。
参考文献
1. Jeck, W. R., J. A. Sorrentino, et al. (2013). "Circular RNAs are abundant, conserved, and associated with ALU repeats." RNA 19(2): 141-157.
2. Ledford, H. (2013). "Circular RNAs throw genetics for a loop." Nature 494(7438): 415.
3. Perkel, J. M. (2013). "Assume nothing: the tale of circular RNA." Biotechniques 55(2): 55-57.
4. Salmena, L., L. Poliseno, et al. "A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language?" Cell 146(3): 353-358.
5. Wilusz, J. E. and P. A. Sharp (2013). "Molecular biology. A circuitous route to noncoding RNA." Science 340(6131): 440-441
6. Xiao-Ou Zhang, Hai-Bin Wang, Yang Zhang, Xuhua Lu, Ling-Ling Chen, Li Yang. Complementary Sequence-Mediated Exon Circularization. Cell, September 18, 2014; DOI: 10.1016/j.cell.2014.09.001
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










这篇资讯带给我们新知识,启发新思维,不论是科研还是临床工作都有很大的帮助。。。
105
#CRN#
79
好学习很值得好学习
191
好文章,值得收藏
213
好文章,值得收藏
163
好文章,值得收藏
173
#circRNA#
99
期待新的突破!
98
厉害中国
109
学到
129