陈春英院士团队ACS Nano:水凝胶介导的外泌体通讯干扰,抑制肿瘤适应性
2024-10-28 BioMed科技 BioMed科技 发表于上海
本研究开发自组装短肽 PepABS-py,可在肿瘤细胞表面形成水凝胶阻断外泌体传播,减轻低氧肿瘤微环境,调节免疫反应,增强传统化疗效果,是有前途的肿瘤膜靶向治疗工具。
低氧症是实体瘤内常见的现象,它可以刺激传播欺骗性的肿瘤外泌体,这些外泌体充当通讯桥梁,协调招募各种支持性细胞类型,以增强肿瘤在肿瘤免疫微环境中的适应性。当前的纳米技术为我们提供了智能策略来对抗低氧肿瘤微环境。然而,一旦暴露于外部刺激,如化疗,肿瘤细胞会同时释放恶性信号以发展肿瘤迁移和免疫抑制,这对临床实践提出了挑战。国家纳米中心陈春英/李佳阳利用靶向膜的治疗策略,应用自组装短肽(PepABS-py),在肿瘤细胞表面形成水凝胶,可以利用类似纤维的纳米结构阻断外泌体的传播,并有效限制传统治疗的全身不良反应。此外,PepABS-py可以通过携带低氧肿瘤过表达的CA IX酶的抑制剂,在体内减轻低氧肿瘤微环境,其中低氧症也是诱导肿瘤外泌体和调节免疫系统内细胞间通讯的关键调节因子。在这里,它在干扰外泌体通讯中的应用可以通过调节外泌体货物中的微小RNA来靶向T细胞相关信号通路,最终增强CD8+ T细胞的浸润,并在转移部位减轻炎症性单核细胞。总的来说,凭借阻断外泌体传播的能力,PepABS-py可以作为一种有前途的肿瘤膜靶向治疗工具,用于对抗肿瘤在免疫微环境中的适应性,并进一步推进传统化疗。
该研究题为“Hydrogel-Mediated Jamming of Exosome Communications That Counter Tumor Adaption in the Tumor Immune Microenvironment”发表在《ACS Nano》。

方案1阐述了一种自组装短肽PepABS-py的设计,该短肽能够在肿瘤细胞表面响应磷酸酶的活性,形成纳米纤维状结构,进而在细胞间空间内形成水凝胶。这种水凝胶能够限制恶性外泌体的传播,并且通过携带低氧肿瘤过表达的CA IX酶的抑制剂来减轻低氧肿瘤微环境,从而干扰肿瘤细胞间的通讯。结论是,PepABS-py的应用可以通过全面阻断肿瘤细胞间的通讯来作为一种重要的肿瘤治疗工具,调节肿瘤微环境,增强对肿瘤免疫治疗的效果,并可能有助于减轻传统化疗对免疫系统的不良影响。
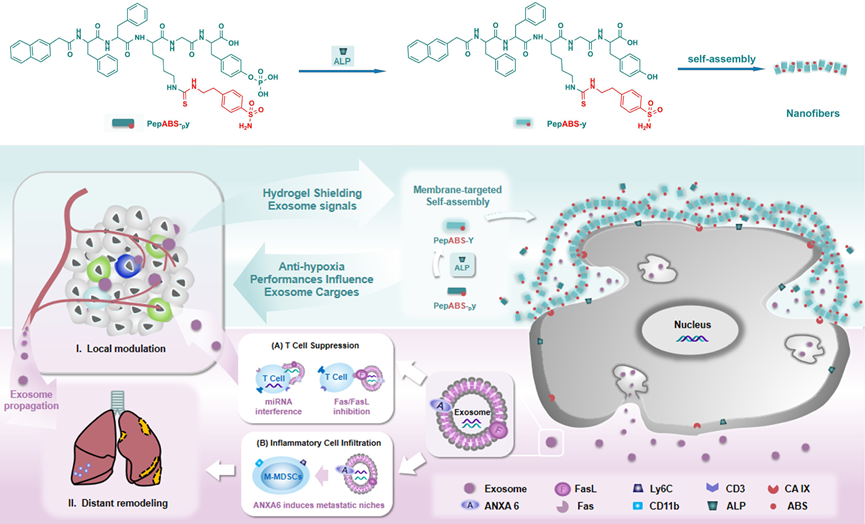
方案1. 四种细胞纳米颗粒(CNP)设计的示意图,展示了多重中和作用的逐步功能
【在癌细胞表面靶向自组装形成纳米纤维,阻碍癌细胞外泌体的传播】
图1展示了自组装分子PepABS-py在体外和体内形成水凝胶的性能及其对癌细胞外泌体传播的阻碍效果。实验结果表明,PepABS-py能够在模拟的生理条件下迅速形成具有均匀纳米纤维网络的稳定水凝胶,且该水凝胶能够在癌细胞表面形成密集的纳米纤维层,有效捕获和限制肿瘤来源的外泌体。通过透射电子显微镜(TEM)图像、流变学测试、纳米颗粒跟踪分析(NTA)和共聚焦显微镜图像等一系列实验,研究人员证实了PepABS-py自组装形成的水凝胶能够在体外和体内条件下有效阻碍癌细胞外泌体的释放和传播,从而为肿瘤治疗提供了一种新的策略,即通过物理方式阻断肿瘤细胞间的通讯,抑制肿瘤的免疫逃逸和转移能力。
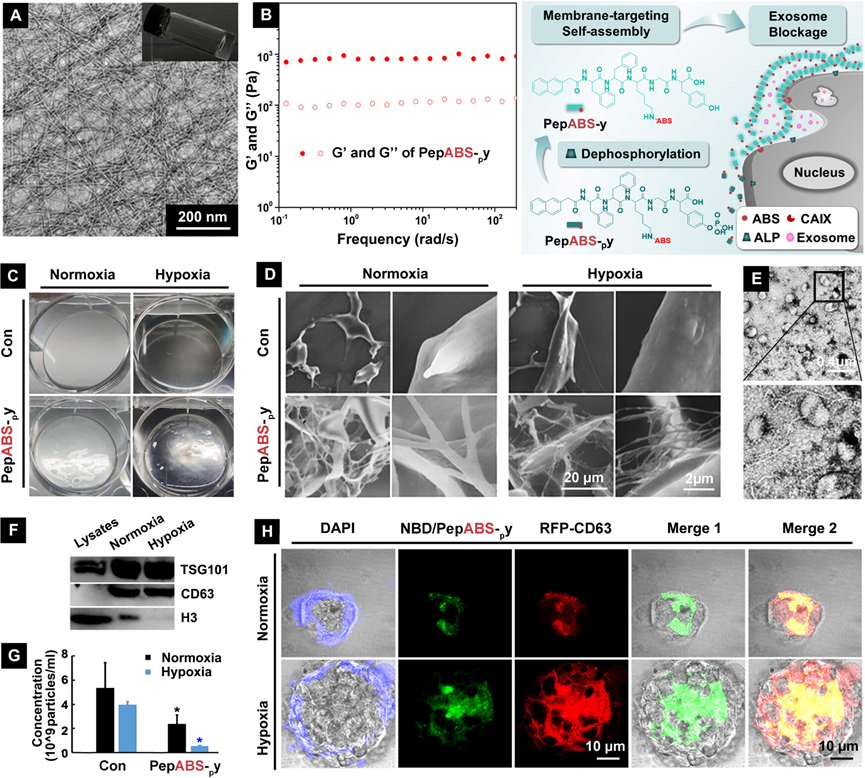
图1. 在癌细胞表面靶向自组装形成纳米纤维,阻碍癌细胞外泌体的传播
【PepABS-py处理可能针对T细胞相关信号通路】
图2探讨了PepABS-py处理对4T1细胞来源的外泌体内容物中微小RNA表达谱的影响,并分析了这些变化如何影响T细胞相关的信号通路。研究者通过RNA测序技术比较了经PepABS-py处理的细胞与未处理细胞产生的外泌体中微小RNA的差异表达,发现在低氧条件下,PepABS-py显著改变了与T细胞功能相关的微小RNAs的表达,这些改变可能通过调节外泌体中的微小RNA来影响T细胞信号通路,进而增强CD8+ T细胞的浸润并减轻转移部位的炎症性单核细胞。这些发现表明,通过干扰肿瘤外泌体的通讯,可以调节肿瘤微环境中的免疫反应,为肿瘤治疗提供了新的策略。
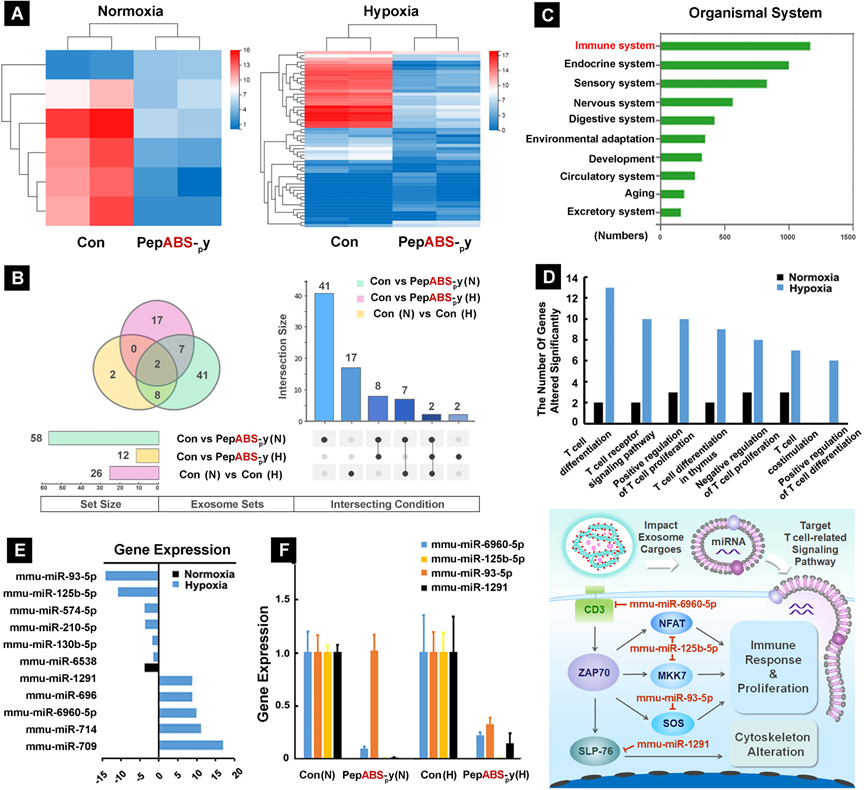
图2.PepABS-py处理可能针对T细胞相关信号通路
【PepABS-py处理在体内对4T1肿瘤的局部肿瘤免疫微环境进行调节】
图3展示了PepABS-py处理对4T1肿瘤小鼠模型中肿瘤免疫微环境的局部调节作用。研究发现,PepABS-py通过抑制肿瘤生长,增加了肿瘤组织内CD3+CD8+ T细胞的比例,激活了CD8+细胞毒性T细胞,同时通过调节微小RNA影响了T细胞调节因子如SOS、MKK7、NFATC1和SLP76的蛋白表达,导致与T细胞活化相关的信号分子IFNγ和NF-κB在肿瘤内淋巴细胞中的显著上调。此外,PepABS-py处理还降低了肿瘤外泌体诱导的T细胞抑制因子FasL的表达。这些结果表明,PepABS-py通过阻断肿瘤外泌体的传播,有效调节了肿瘤组织的免疫微环境,减轻了外泌体诱导的免疫抑制,为肿瘤免疫治疗提供了局部调节作用。
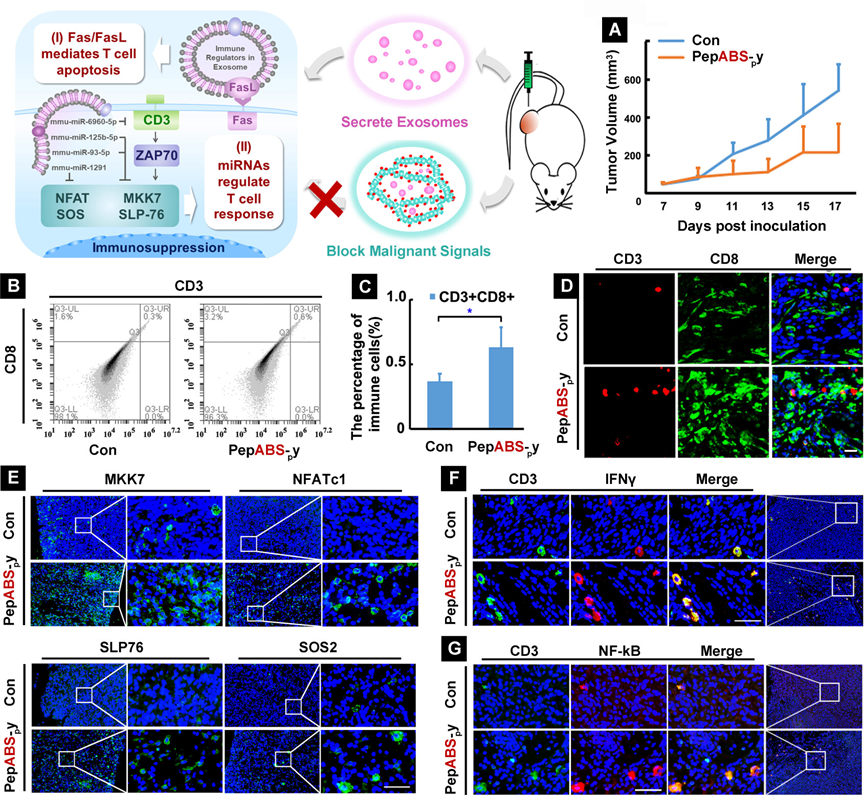
图3.PepABS-py处理在体内对4T1肿瘤的局部肿瘤免疫微环境进行调节
【PepABS-py处理在体内重塑远处免疫微环境并抑制紫杉醇诱导的转移】
图4探讨了PepABS-py处理对4T1肿瘤细胞来源的外泌体在体内远处器官(如肺)免疫微环境重塑以及抑制化疗药物紫杉醇诱导的肿瘤转移的效应。研究通过在体外用紫杉醇刺激4T1细胞分泌外泌体,随后联合应用PepABS-py处理,发现联合处理能减少外泌体的数量及其携带的FasL信号,同时减少与肿瘤转移相关的Annexin A6蛋白的表达。在小鼠模型中,通过尾静脉注射这些处理过的外泌体,PepABS-py显著降低了肺组织中促进肿瘤转移的CXCL12和ANGPT12的表达,并抑制了炎症单核细胞的浸润。此外,PepABS-py处理还减少了紫杉醇诱导的乳腺癌细胞在肺组织的转移,增加了转移病灶中CD8+ T细胞的数量。这些结果表明,PepABS-py通过干扰肿瘤外泌体的通讯,不仅减轻了化疗药物引起的肿瘤转移倾向,还激活了与T细胞相关的免疫反应。
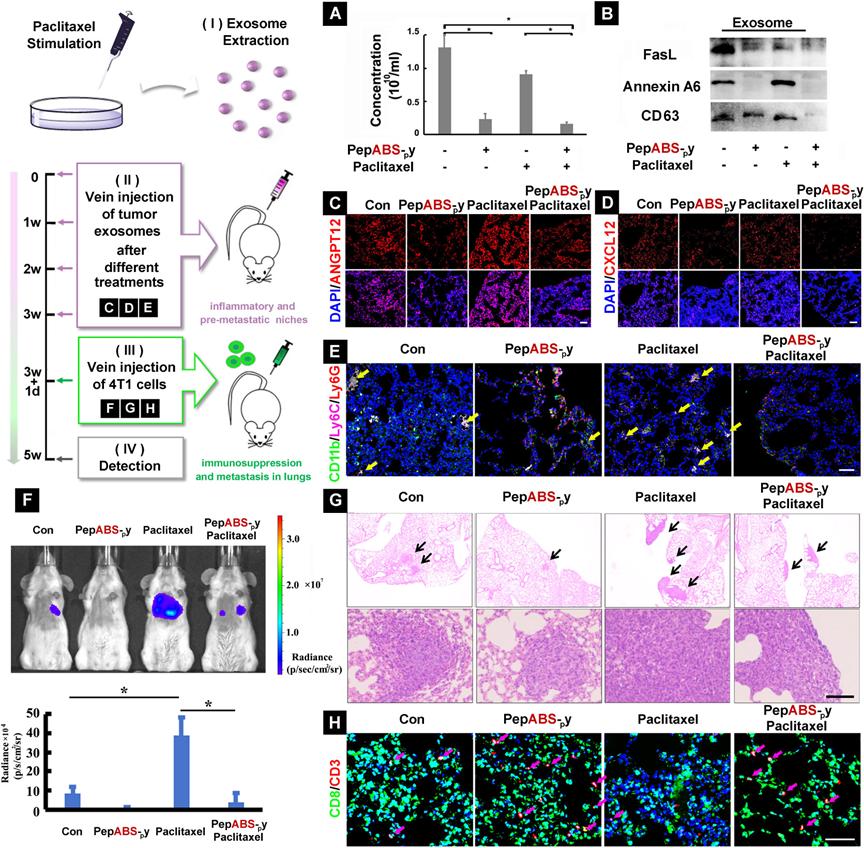
图4. PepABS-py处理在体内重塑远处免疫微环境并抑制紫杉醇诱导的转移
【PepABS-py处理在体内对4T1肿瘤进行抗低氧治疗并推进传统化疗】
图5展示了PepABS-py在体内对4T1肿瘤的抗低氧治疗作用及其对传统化疗效果的提升。研究发现,与仅含CA IX抑制剂ABS相比,PepABS-py显著抑制了低氧条件下4T1细胞的活性,并减少了肿瘤细胞的迁移能力。在肿瘤组织中,PepABS-py处理组的低氧诱导蛋白CA IX和血管生成相关蛋白CD31的表达均有所下降。此外,PepABS-py在肿瘤组织中的分布浓度显著高于自由ABS,表明其在肿瘤中的长期滞留能力更强。PepABS-py与紫杉醇联合使用时,能够显著减轻肿瘤重量、增加肿瘤坏死面积,并减少肿瘤组织内的增殖细胞。研究还发现,PepABS-py显著减少了4T1细胞在肺组织的转移结节的数量和直径,表明其在阻断肿瘤细胞与远距离器官之间的通讯、减轻化疗引起的肿瘤转移方面具有潜在的临床应用价值。综合这些结果,PepABS-py作为一种有效的肿瘤治疗工具,通过阻断肿瘤外泌体的传播和减轻肿瘤的低氧微环境,不仅能够增强肿瘤的局部免疫反应,还能提升传统化疗的效果。
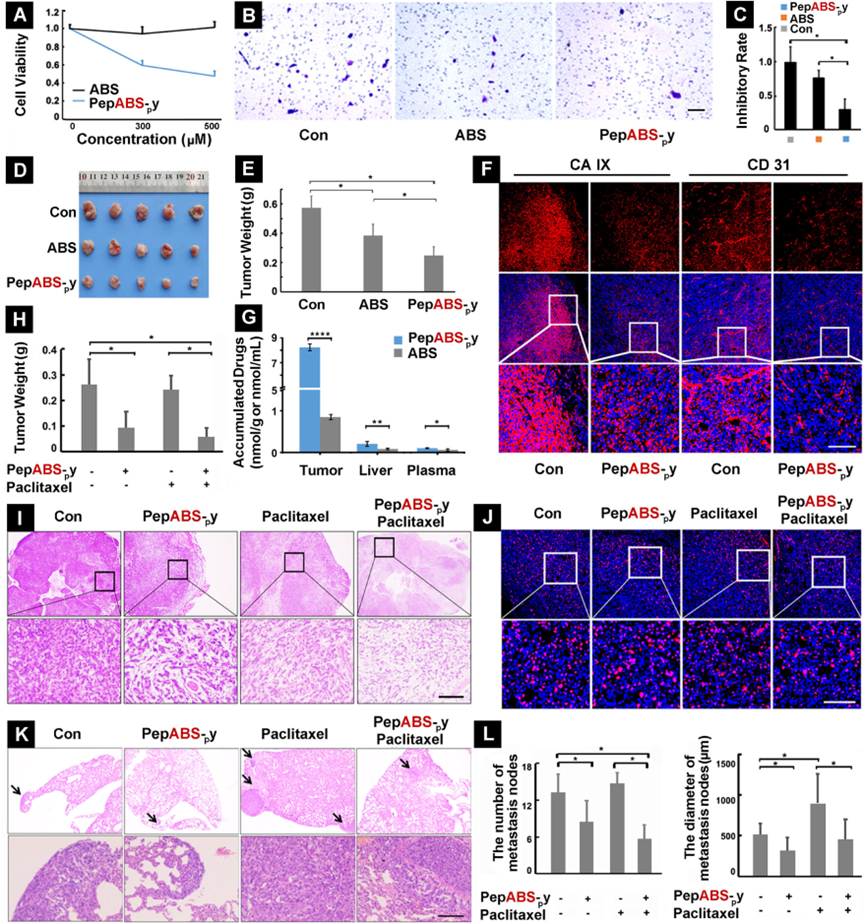
图5. 开发了由细胞膜包被的油纳米海绵用于双重模式中和有机磷(OP)神经剂
【小结】
该研究指出,肿瘤微环境与肿瘤的进展和转移密切相关,涉及肿瘤内部各种类型细胞之间的复杂合作,通过信号通讯维持肿瘤的适应性。研究中开发的靶向肿瘤细胞膜的自组装短肽PepABS-py,能够在肿瘤细胞表面形成水凝胶,有效阻断肿瘤外泌体的传播,并且通过携带低氧肿瘤过表达的CA IX酶的抑制剂来减轻体内低氧肿瘤微环境,从而干扰外泌体通讯,特别是针对T细胞相关的信号通路,调节外泌体货物中的微小RNA,增强CD8+ T细胞的浸润,减轻转移部位的炎症性单核细胞。因此,PepABS-py作为一种有前途的肿瘤膜靶向治疗工具,可以对抗肿瘤在免疫微环境中的适应性,并推进传统化疗的效果。论文强调了在常规肿瘤治疗过程中干扰外泌体通讯的重要性,这可能限制了恶性肿瘤信号的传播效果,从而减轻了肿瘤对低氧微环境的适应性。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c07603#
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#肿瘤治疗# #外泌体阻断# #低氧微环境#
32