韩国MFDS批准抗COVID-19单克隆抗体CT-P59的II / III期关键试验
2020-09-18 Allan MedSci原创
Celltrion集团今天宣布,韩国食品药品安全部(MFDS)批准了该公司的研究性新药(IND)申请。
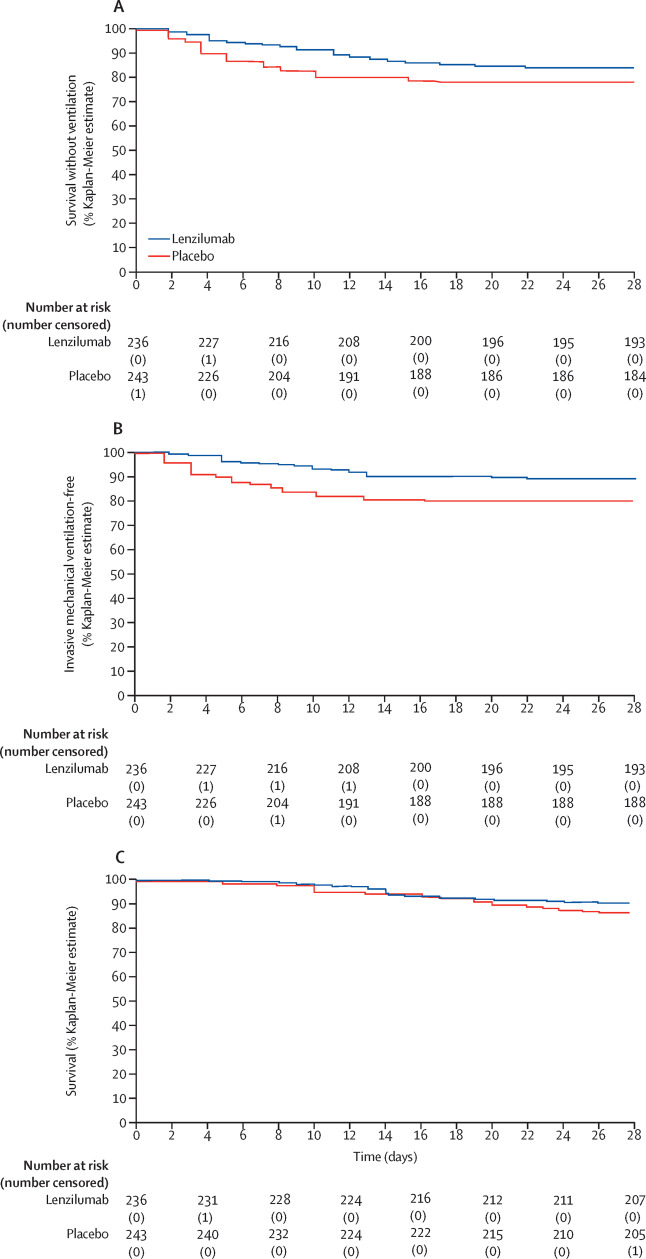
Celltrion集团今天宣布,韩国食品药品安全部(MFDS)批准了该公司的研究性新药(IND)申请,允许开展抗COVID-19单克隆抗体CT-P59治疗COVID-19患者的II / III期关键临床试验。这项全球性试验将评估CT-P59在轻度至中度COVID-19患者中的安全性和有效性。Celltrion有望在今年年底之前获得主要结果。
Celltrion已在包括韩国、美国和西班牙在内的6个国家/地区提交了IND,并计划招募来自12个国家/地区的1,000多名患者。该公司希望能够根据关键试验的结果申请紧急使用授权(EUA)。
Celltrion已开始制造CT-P59,并计划提高制造能力,以满足当前全球对抗COVID-19单克隆抗体药物的需求。
Celltrion高级执行副总裁Sang Joon Lee博士说:“鉴于COVID-19对生命的重大威胁,迫切需要找到可以帮助我们应对大流行的治疗方法。CT-P59的全球II / III期关键性临床试验的启动是向前迈出的重要一步”。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#克隆#
51
#III#
37
学习
77
#韩国#
45
#III期#
33