HER2阳性乳腺癌按FISH结果细分,靶向治疗获益分层
2024-12-18 苏州绘真医学 苏州绘真医学 发表于陕西省
这些发现提供了有价值的关于不同 HER2 FISH 阳性亚组的临床病理学见解,可能为未来解读 HER2 FISH 结果的标准提供信息。
人表皮生长因子受体 2(HER2)阳性乳腺癌(BC)包含一系列分子亚型,其特征是 HER2/CEP17 比值和 HER2 拷贝数不同,影响对抗 HER2 治疗的反应。本研究将 HER2 荧光原位杂交(FISH)阳性患者分为 3 个不同的组:拷贝数较高的组1(G1-HC:比值 ≥2,拷贝数 ≥6),拷贝数较低的组1(G1-LC:比值 ≥2,拷贝数 ≥4 且 <6),和组3(G3:比值 <2.0,拷贝数 ≥6.0),并评估了他们的临床病理特征、对抗 HER2 治疗的反应和结局。在 2702 例连续原发性 BC 队列中,G1-HC BCs 占 304 例(11.3%),G1-LC 占 37 例(1.4%),G3 占 75 例(2.8%)。与 G1-LC BCs 相比,G1-HC BCs 与年龄较小、肿瘤分级较高和雌激素受体阴性相关。此外,与 G1-LC 和 G3 BC 相比,G1-HC BCs 中孕激素受体阴性和 HER2 免疫组化 3+ 的患者比例较高。对 HER2 免疫组化 2+ 病例亚组(n = 166)的分析显示了类似的结果。值得注意的是,与 G1-LC 和 G3 患者相比,G1-HC 患者对抗 HER2 新辅助化疗的反应显著较高。相反,与 G1-HC 和 G3 患者相比,G1-LC 患者表现出较低的无病状态可能性,尽管各组间的总生存期、远处转移或局部复发没有显著差异。这些发现提供了有价值的关于不同 HER2 FISH 阳性亚组的临床病理学见解,可能为未来解读 HER2 FISH 结果的标准提供信息。
研究背景
致癌人表皮生长因子受体-2(HER2)是一种受体酪氨酸蛋白激酶,由 ERBB2 基因(也称为 HER2)编码,位于染色体 17q12 处。研究一致表明,HER2 基因扩增存在于 15% 至 20% 的乳腺癌(BC),强调了其临床意义。值得注意的是,HER2 靶向治疗,尤其是单克隆抗体曲妥珠单抗,极大地改变了 HER2 阳性 BC 患者的预后。尽管抗 HER2 治疗有效,但不同患者之间 HER2 表达或扩增水平的差异会产生不同的治疗反应。因此,了解不同的 HER2 阳性状态与对抗 HER2 治疗反应的关系至关重要。
确定 BC 中 HER2 状态的标准化方法和检测指南由美国临床肿瘤学会和美国病理学家学会(ASCO/CAP)最初于 2007 年制定,随后于 2013 年和 2018 年更新。这些指南的主要目的是准确识别适合 HER2 靶向治疗的患者,同时最大限度地减少假阳性或假阴性结果的发生。目前,已确立的标准检测方法包括免疫组织化学(IHC)评估蛋白表达以及原位杂交(特别是荧光原位杂交(FISH))评估 HER2 基因扩增(拷贝数和/或 HER2/CEP17 比值)。HER2 IHC 结果根据膜染色的完整性、染色强度和显示染色的肿瘤细胞的百分比分为阳性(3+ 染色)、模棱两可(2+ 染色)或阴性(1+ 或 0 染色)。模棱两可的 HER2 标本进一步进行 ISH 检测来明确 HER2 状态为阳性或阴性。通过整合 IHC 和 FISH 结果,HER 阳性状态目前定义为 IHC 3+ 或 IHC 2+/ISH+,而 HER 阴性状态定义为 IHC 0、IHC 1+ 或 IHC 2+/ISH-。根据 2018 年 ASCO/CAP 指南 HER2 FISH 结果将患者分为 5 组。HER2 IHC 2/3+ 的第 1 组(G1:HER2/CEP17 比值 ≥2.0,平均 HER2 拷贝数/细胞 ≥4.0)和第 3 组(G3:HER2/CEP17 比值 <2.0,平均 HER2 拷贝数/细胞 ≥6.0),以及 HER2 IHC 3+ 的其他组被认为是 HER2 阳性患者。
然而,抗 HER2 治疗对 2018 版 ASCO/CAP 定义的不同 FISH 模式的 HER2 阳性 BC 的有效性,仍未得到充分探索,大多数研究未能捕获真实世界数据。最近的研究表明,HER2 FISH G1 中的一部分患者,其特征是 HER2/CEP17 比值 ≥2.0,HER2 拷贝数 ≥4.0 且 <6.0,可能无法从当前的抗 HER2 治疗中取得与其他 FISH 阳性模式患者相同水平的获益。在本研究中,我们进一步将 HER2 FISH G1 细分为 2 个不同的亚组:拷贝数较高的 G1(G1-HC:比值 ≥2,拷贝数/细胞 ≥6)和拷贝数较低的 G1(G1-LC:比值 ≥2,拷贝数/细胞 ≥4 且 <6;表 1)。

表1
本研究利用来自单个机构的大型真实世界队列,描述了不同 HER2 FISH 阳性类别(G1-HC、G1-LC 和 G3)的临床病理特征、对抗 HER2 治疗的反应(新辅助和辅助)和临床结局。本研究结果为在具有不同 FISH 结果的 BC 患者中使用抗 HER2 治疗提供了重要见解,可能导致重新评估用于评估 HER2 FISH 结果的标准。
研究结果
不同HER2 FISH模式的浸润性乳腺癌的分布
研究队列包括包括 2018 年 1 月至 2022 年 12 月期间在俄亥俄州立大学韦克斯纳医学中心诊断的 2702 例连续原发性浸润性 BC 病例。每个病例都同时接受了 HER2 IHC 和 HER2 FISH 评估。细分揭示了不同比例的不同 HER2 FISH 组:341 例(12.7%)属于 G1,包括 304 例(11.3%)高拷贝数(G1-HC:拷贝数/细胞 ≥6)病例和 37 例(1.4%)低拷贝数(G1-LC:拷贝数/细胞 ≥4 且 <6)病例。G2 有 5 例(0.2%),G3 有 75 例(2.8%),G4 有 229 例(8.5%),G5 有 2052 例(75.9%),占比最高。表 2 详细展示了该综合评估,阐明了不同 HER2 FISH 模式在队列中的异质性分布。
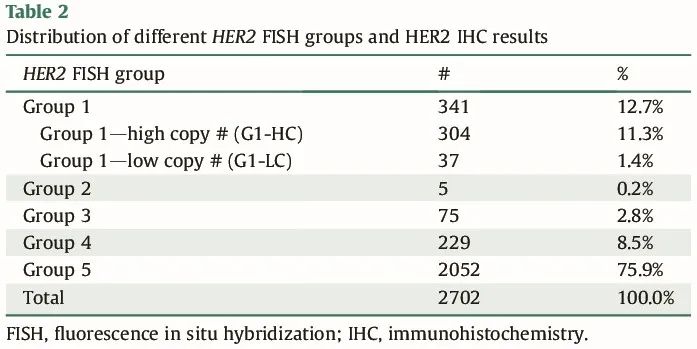
表2
G1-HC、G1-LC和G3乳腺癌临床病理特征和临床结局比较(n = 416)
G1-HC、G1-LC 和 G3 BCs 之间临床病理特征的比较为 HER2 阳性 BC 的图谱提供了重要的见解。值得注意的是,G1-HC 患者表现出不同的年龄特征,通常比 G1-LC 患者年轻。3 组之间的组织学类型没有显著差异,G1-LC 肿瘤的 3 级肿瘤比例低于 G1-HC 肿瘤,提示肿瘤侵袭性的潜在差异。此外,G1-HC 肿瘤的 ER 阴性频率高于 G1-LC 肿瘤,提示这些亚型之间的激素受体状态存在差异。此外,G1-HC 肿瘤的 PR 阴性频率高于 G1-LC 或 G3 肿瘤。特别值得注意的是,相较于 G1-LC 和 G3 肿瘤,G1-HC 肿瘤的 HER2 IHC 3+ 率显著更高,突出了不同 HER2 FISH 组之间 HER2 表达水平的不同。这些发现在表 3 中详细说明,为 HER2 阳性 BC 的临床病理特征提供了有价值的见解。
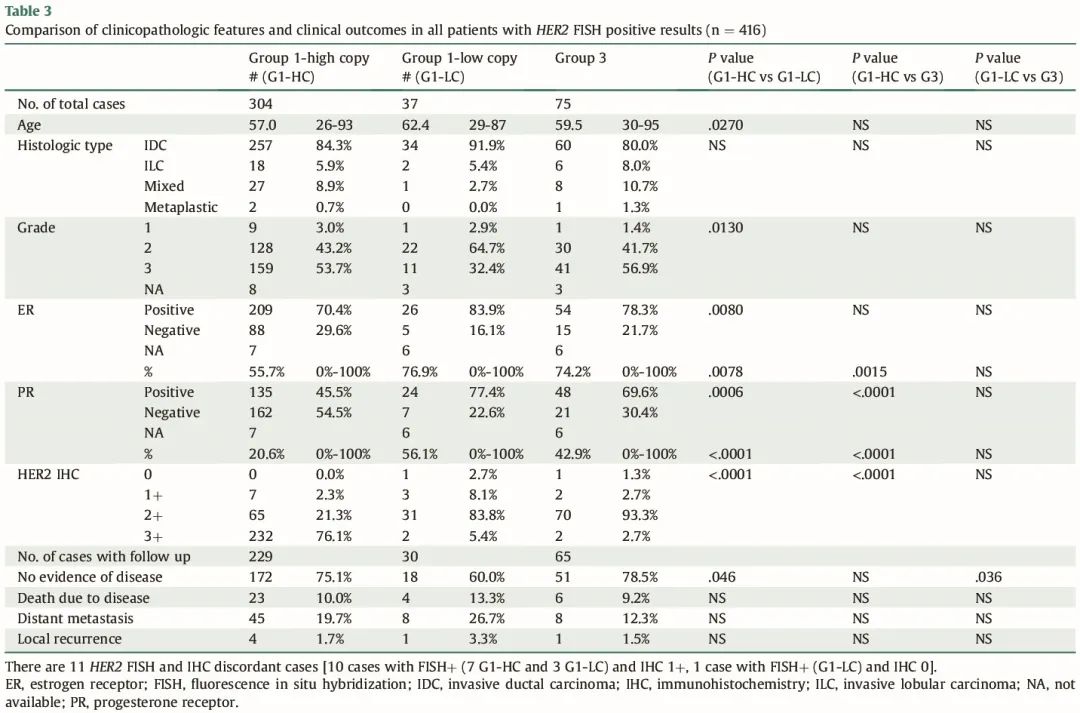
表3
11 例患者的 HER2 IHC 和 FISH 结果不一致,包括 7 例 G1-HC 和 4 例 G1-LC。值得注意的是,G1-LC 病例的不一致发生率较高(10.8%)。此外,3 例 G3 病例显示 HER2 IHC 0/1+ 结果。
我们继续分析具有临床随访结果的病例,并将其与临床病理特征相关联。该亚组中的所有患者(n = 324)均接受 HER2 靶向治疗(辅助和/或新辅助)。G1-LC 患者的无病生存率低于 G1-HC 和 G3 患者。3 组患者在总生存期、远处转移和局部复发方面没有显著差异(表 3 和图 1)。
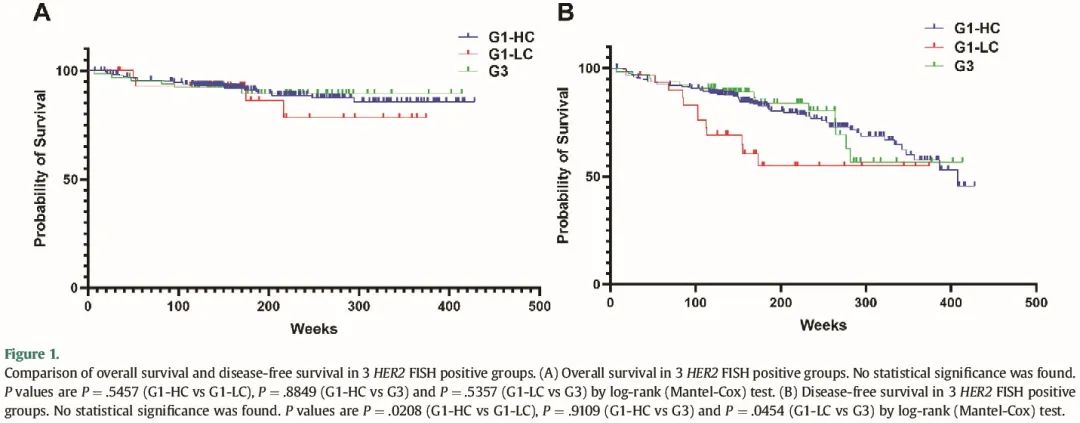
图1
HER2 IHC2+乳腺癌临床病理特征和临床结局比较(n = 166)
接下来,我们将 HER2 IHC 2+ 病例分为 G1-HC、G1-LC 和 G3 亚组(G1-HC 65 例、G1-LC 31 例和G3 70 例),并相应地分析其临床病理特征和临床结局。值得注意的是,HER2 IHC 2+ G1-LC 肿瘤的 3 级肿瘤比例低于 IHC 2+ G1-HC 或 G3 肿瘤。此外,IHC 2+ G1-LC 肿瘤的 PR 阴性率低于 G1-HC 肿瘤。我们进一步分析了具有临床随访结果的病例,并将其与临床病理特征相关联。IHC 2+ G1-LC 患者的无病生存率低于 G1-HC 患者(有统计学意义)或 G3 患者(无统计学意义,可能是由于病例数有限)。与所有 HER2 IHC 病例的分析结果一样,在 HER2 IHC 2+ 病例中,在总生存期、远处转移和局部复发方面没有观察到显著差异。14 例 G1-HC/IHC 2+ 病例接受新辅助化疗,4 例(28.6%)获得病理完全缓解(PCR)(3 例 PCR 病例 ER/PR 阴性)。8 例 G1-LC/IHC 2+ 病例接受新辅助化疗,均未获得 PCR。26 例 G3/IHC 2+ 病例接受新辅助化疗,4 例(15.4%)获得 PCR(3 例 PCR 病例 ER/PR 阴性)。由于样本量有限,统计分析未显示 3 组之间的 PCR 或残留癌症负荷存在显著差异(表 4)。
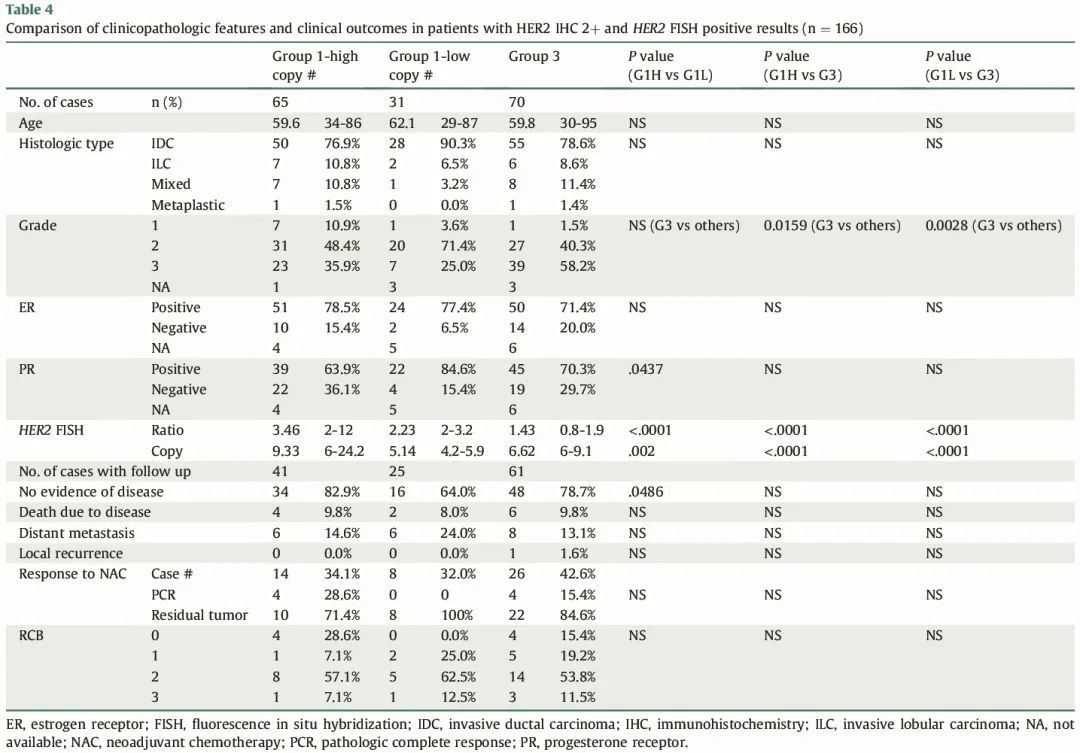
表4
接受抗HER2新辅助化疗的G1-HC、G1-LC和G3 乳腺癌患者的临床病理特征比较(n = 158)
接下来,我们分析了所有接受抗 HER2 新辅助治疗的病例,将其与临床病理特征相关联。与 G1-LC 或 G3 患者相比,G1-HC 患者对抗 HER2 新辅助治疗的反应显著较高,其特征是 PCR 患者更多,残留癌症负荷值更低。此外,G1-HC 患者(新辅助化疗后)的 yT0 肿瘤比例高于 G3 患者,但非 G1-LC 患者(由于数量有限)。此外,G1-HC 患者的 yN0 肿瘤比例高于 G1-LC 患者。3 组在年龄、组织学类型、肿瘤分级或雌激素 ER 阳性率方面无明显差异。类似地,与 G1-LC 或 G3 肿瘤相比,G1-HC 肿瘤表现出更高的 PR 阴性率和 HER2 IHC 3+ 阳性率(表 5)。
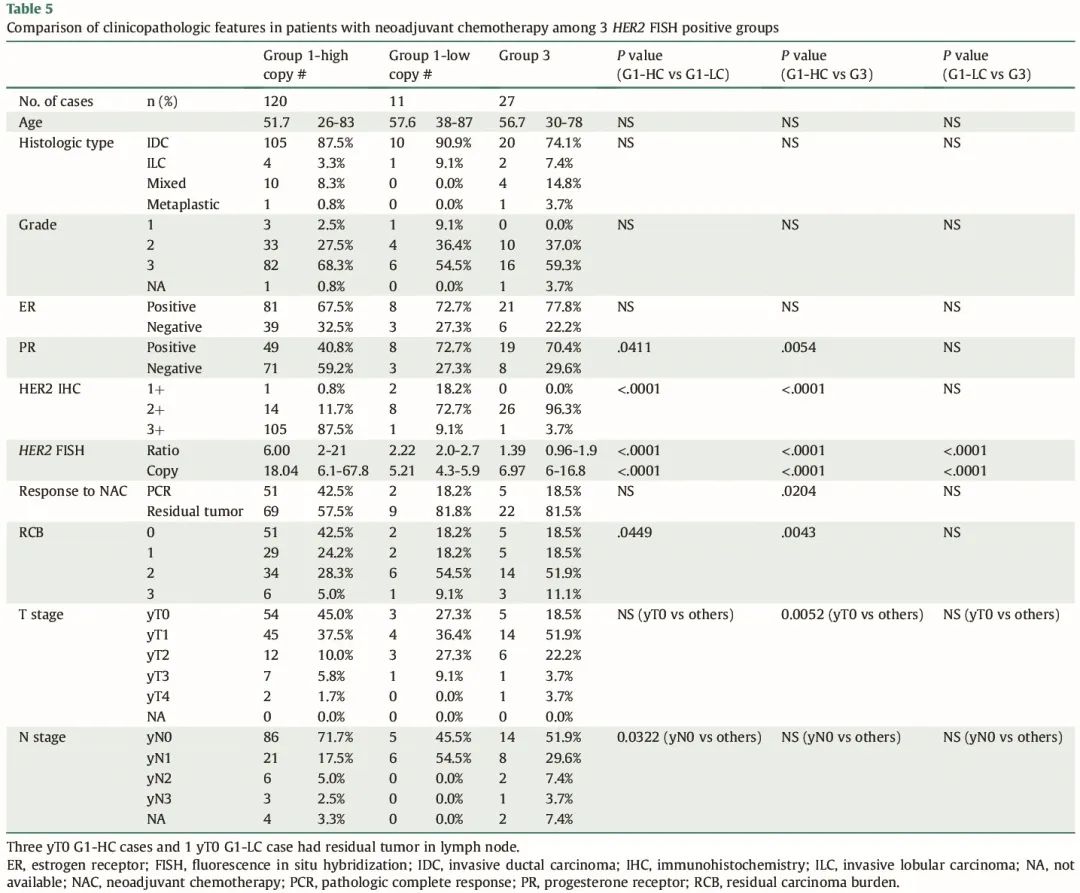
表5
讨 论
2018 年 ASCO/CAP 指南将 HER2 FISH 结果分为 5 组,其中 G1 和 G3 为阳性。在本研究中,我们进一步将 G1 分为 2 个子类别:高拷贝数的 G1(G1-HC:比值 ≥2,拷贝数 ≥6)和低拷贝数的 G1(G1-LC:比值 ≥2,拷贝数 ≥4 且 <6)。最近的研究结果表明,与其他 FISH 阳性患者相比,归类为 G1-LC 的患者可能无法从抗 HER2 新辅助化疗中取得类似获益。本研究涉及来自单个机构的真实世界大队列,我们观察到 G1-LC 和 G3 占病例的一小部分(分别占 1.4% 和 2.8%)。我们研究中 G3 肿瘤的比例与之前的研究一致,范围为 0.4% 至 3.0%。
在许多已发表的研究中,HER2 FISH 通常作为 HER2 IHC 2+ 病例的补充检测,由此产生的结果可能无法完全代表不同 HER2 FISH 组的潜在生物学。然而,在我们机构,HER2 FISH 与 HER2 IHC 一起系统地用于所有原发性浸润性 BC,包括 HER2 IHC 0/1+/3+ 病例。尽管在 HER2 IHC 0/1+/3+ 病例中进行 FISH 通常是不必要的,也不是推荐的做法,但这种独特的检测方法使我们能够全面探索不同 HER2 FISH 组的临床病理特征,包括 HER2 IHC 结果。我们的数据揭示了 G1-HC 肿瘤和 G1-LC 肿瘤之间的显著差别,G1-HC 肿瘤年龄较低、3 级肿瘤比例较高、ER 阴性频率较高。此外,与 G1-LC 和 G3 肿瘤相比,G1-HC 肿瘤表现出更高的 PR 阴性率和 HER2 IHC 3+ 率。这些发现强调了同时评估 HER2 FISH 和 IHC 结果的重要性,以便更细致地了解 BC 亚型及其相关的临床病理特征。
Wilcock 等人的研究纳入了 142 例 G3 病例,发现 36.6% 的病例 HER2 IHC 阴性(0/1+),60.6% 的病例 IHC 2+,2.8% 的病例 IHC 3+。另一项研究仅纳入了 6 例 G3 病例,其中 2 例 IHC 0/1+,3 例 IHC 2+,1 例 IHC 3+。在我们的 75 例 G3 病例中,HER2 IHC 2+ 占比高达 93.3%,HER2 IHC 0/1+ 和 IHC 3+ 分别仅占 4% 和 3%。在 Wilcock 等人的研究中观察到类似的趋势,42.3% 的 G3 肿瘤为 3 级,86.6% 为激素受体阳性(ER 和/或 PR 阳性)。我们的研究结果与这些结果相呼应,57% 的 G3 肿瘤为 3 级,78.3% 为 ER 阳性。抗 HER2 靶向治疗对 HER2 G3 BC 患者的疗效仍不确定。几项研究表明,G3 BC 患者抗 HER2 新辅助化疗后 PCR 率相对较低(10% - 33%)。这与 Neoadjuvant Breast Registry Symphony Trial结果形成对比,该试验显示,在分类为 HER2 分子型(G1)的 161 例肿瘤中,PCR 率为 65% 。在本研究中,G3 BC 患者抗 HER2 新辅助化疗后的缓解率显著低于 G1-HC BC 患者(18.5% vs 42.5%), 提示该亚组的抗 HER2 靶向治疗获益显著较低。
与 G3 BCs 相比,对 G1-LC BCs 的研究相对较少。G1-LC 肿瘤的发生率仍不确定。在我们的研究中,G1-LC 肿瘤非常罕见,仅占所有 BC 的 1.4%。之前一项研究分析了 5 例 G1-LC BC,发现这些病例普遍存在 HER2 IHC 2+ 模式(4/5,80%)。与该研究结果一致,我们的数据显示 HER2 IHC 2+ 占 G1-LC BC 的 83.8%。然而,显著比例(高达 11%)的 G1-LC 病例具有 HER2 IHC 0/1+ 结果,根据当前的 HER2 指南,将其归类为不一致的 HER2 IHC 和 FISH 结果。与 G3 BC 患者类似,G1-LC 患者抗 HER2 新辅助化疗后的缓解率也显著低于 G1-HC BC 患者(18.2% vs 42.5%)。这一观察结果强调了 G1-LC BC 患者的抗 HER2 靶向治疗获益显著较低。Lv 等人最近的研究报道, G1-LC BC 患者的 PCR 率为 5%,低于我们队列的 PCR 率。此外,Alhamar 等人分析了 3 个 G1 BCs 亚组的临床结局(低扩增 [HER2/CEP17 比值 ≥2.0-2.99,平均 HER2/细胞 4.0-5.9],扩增 [HER2/CEP17 比值 ≥2.0-2.99,平均 HER2/细胞 ≥6],和过度扩增 [HER2/CEP17 比值 ≥3.0,平均 HER2/细胞 ≥4.0]),发现在 G1 BCs 中,高水平 HER2 扩增与更长的总生存期和无病生存期显著相关。与 Alhamar 的发现一致,我们的数据也表明,与 G1-HC 和 G3 患者相比,G1-LC 患者无病的可能性较低。这提示在 G1 BCs 中,HER2 扩增水平可能对临床结局有重要影响,较高的扩增水平与较高的总生存率和无病生存率相关。
本研究最显著的优势在于较大的队列规模,由来自单个机构的连续原发性 BC 病例组成(n = 2702),这些病例进行了平行的 HER2 IHC 和 FISH 检测。这导致能够全面探索具有不同 HER2 FISH 阳性模式的 BC 的详细临床病理特征和随访结果。我们的数据显示,G1-LC 和 G3 BCs 在生物学和临床上与 G1-HC BCs 不同,从抗 HER2 靶向治疗中的获益显著较低。值得注意的是,我们研究队列中采用的抗 HER2 靶向疗法主要包括曲妥珠单抗,单独使用或与帕妥珠单抗联合使用。随着靶向 HER2 的抗体-药物偶联物(如德曲妥珠单抗)的最新进展,BCs(包括 HER2 低 BCs)的临床治疗格局发生了极大改变。值得探索靶向 HER2 的抗体-药物偶联物能否为 G1-LC 和 G3 BCs 患者带来显著获益,从而为这些亚组更有效的治疗干预开辟潜在新途径。
本研究受到其回顾性设计固有的一些限制以及 G1-LC 和 G3 BC 相对较小的样本量的限制。G1-LC 和 G3 BC 是罕见的实体,未来需要进行更大队列的多机构研究,来验证本研究结果。此外,本研究中的治疗决策不是随机的,且随访期相对较短。然而,尽管存在这些局限性,本研究的优势是来自单个机构的最大队列,包括连续原发性 BC 病例(n = 2702),这些病例同时进行了 HER2 IHC 和 FISH 检测,因此能够对 G1-HC、G1-LC 和 G3 BC 的详细临床、病理和随访结果信息进行深入研究。本研究提供了有价值的信息,但更大队列和更长随访时间的进一步研究对于证实和扩展我们的结果很重要。此外,有必要开展临床试验来评估 HER2 靶向治疗对这些罕见群体是否有效。
总之,本研究表明,G1-LC 和 G3 BCs 的生物学和临床特征与 G1-HC BCs 不同,从抗 HER2 靶向治疗中取得的获益显著较低。这些发现为理解这些罕见的 HER2 FISH 组提供了重要的见解,并倡导未来在制定评估 HER2 FISH 结果的标准时,将这些纳入考量范围。
参考文献:
Li Z, Hu Y, Jones D, Zhao W, Tozbikian G, Parwani AV. Clinicopathologic Characteristics and Follow-Up Outcomes of Invasive Breast Carcinoma With Different Positive HER2 Fluorescence In Situ Hybridization Patterns: Experience From a Single Academic Institution. Mod Pathol. 2024 Oct 26;38(1):100637. doi: 10.1016/j.modpat.2024.100637. Epub ahead of print. PMID: 39490739.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#乳腺癌# #HER2#
11