Nature Medicine:在非临床人群中揭示稀有变异的累积效应:对认知和社会经济特征的影响
2024-04-24 生物探索 生物探索 发表于陕西省
该研究的核心在于揭示了罕见变异和常见变异如何共同作用,影响个体表型的表达性,并可能决定个体是否达到临床疾病的阈值。
引言
单基因发育障碍(DD)是一类通过单个基因的变异所引起的疾病,这些变异影响到个体的神经发展和身体功能。这类疾病通常在儿童早期表现出来,影响包括智力、运动能力和语言技能在内的多种功能。
罕见变异(稀有变异),尤其是那些在人群中频率极低的变异,已被证实在单基因发育障碍的形成中扮演着关键角色。这些变异包括无功能变异(loss-of-function, LoF)和有害错义变异(deleterious missense variants),它们可以直接破坏基因编码的蛋白质,从而干扰细胞功能和发育过程。临床表现方面,罕见遗传变异引发的发育障碍可以从轻微的学习障碍到严重的身体和智力发展问题。这些表现的差异性反映了遗传变异在生物体中的异质性以及它们如何与其他遗传和环境因素相互作用。
4月18日在Nature Genetics发表的研究“Genetic modifiers of rare variants in monogenic developmental disorder loci”,研究人员详细探讨了如何通过使用UK Biobank的数据,研究稀有有害变异在599个显性发育障碍(DD)基因中的累积效应,以及EA-PGS (Educational Attainment Polygenic Score)如何部分抵消这些效应。研究指出,携带2到5个稀有有害变异的个体在认知和社会经济特质上表现出加成的不利影响,这种表型的偏离可能由罕见DD变异的富集或耗尽部分解释。此外,研究还发现,具有DD相关临床诊断的罕见DD变异携带者,其EA-PGS显著低于没有临床诊断的携带者,表现出更严重的表型。
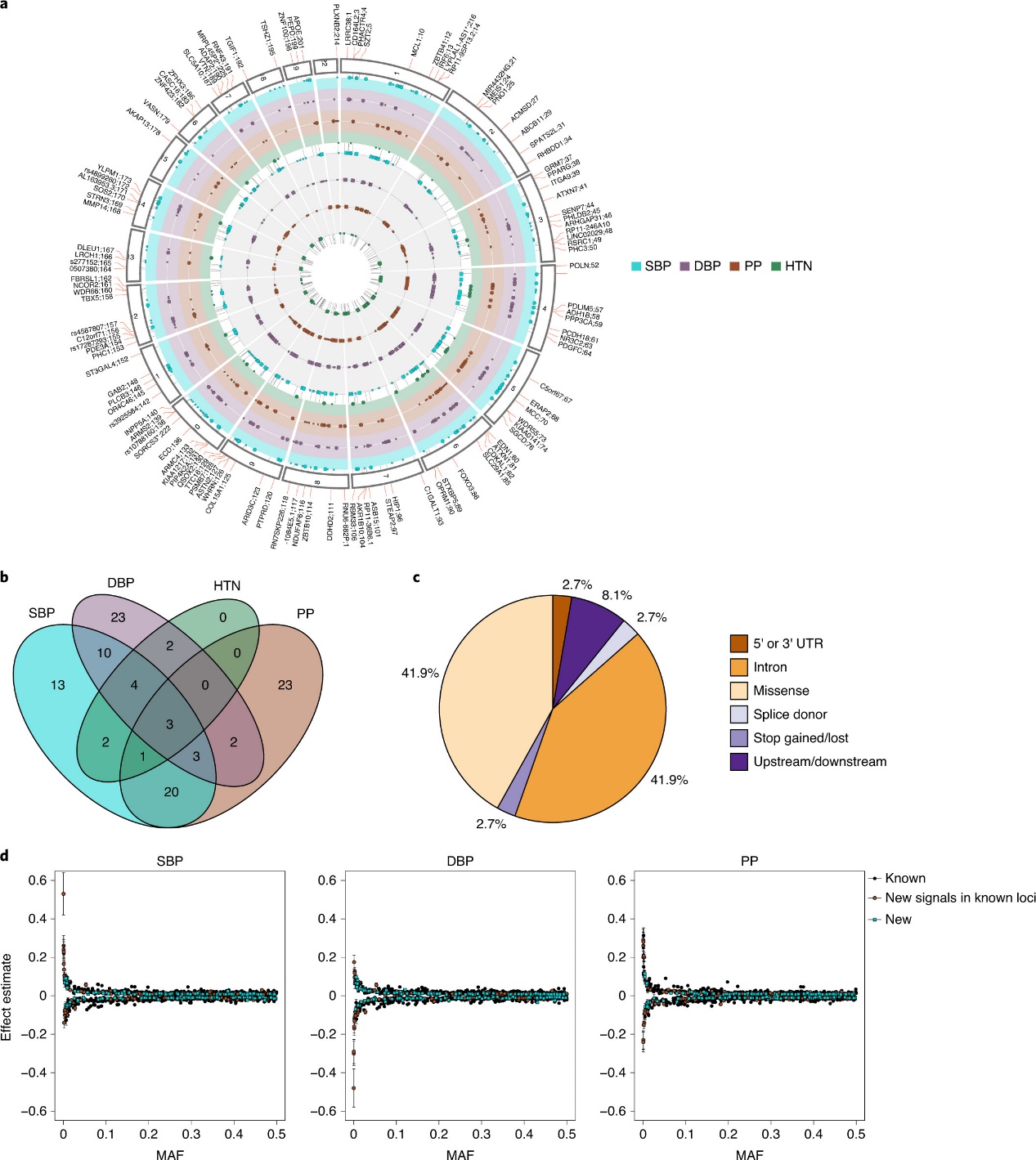
该研究利用的是UK Biobank的外显子测序和微阵列数据,涉及大约41.9万名具有遗传定义的欧洲血统的个体。通过这些数据,研究人员确定了在DDG2P(发育障碍基因型到表型数据库)中有记录的599个基因中,携带罕见的功能丧失(pLoF)变异或有害错义变异的个体。这些分析显示,增加的罕见变异负担与多种DD相关的表型和诊断有关。
该研究的核心在于揭示了罕见变异和常见变异如何共同作用,影响个体表型的表达性,并可能决定个体是否达到临床疾病的阈值。此外,这些发现也可能对预测个体疾病风险、制定个性化医疗策略等方面有重要意义。

Highlights
罕见变异的累积效应
该研究发现,多个罕见损伤变异在特定的显性发育障碍(Dominant Developmental Disorders, DD)基因中的累积,对认知和社会经济特征具有显著的叠加不良影响。这一点通过大数据集(UK Biobank)的分析得到了证实,强调了罕见基因变异对人群表型多样性的重要贡献。
教育成就多基因得分的调节作用
研究结果表明,教育成就多基因得分(Educational Attainment Polygenic Score, EA-PGS)可以部分抵消罕见DD基因变异的不利影响。这说明,除了罕见变异外,常见变异也在个体表型的形成中扮演重要角色,尤其是在教育和认知能力方面。
罕见变异与表型“偏离者”
研究进一步探讨了那些遗传易感性与实际表型不符的个体(表型“偏离者”),发现这些个体中罕见DD变异的携带率较高。这一发现对临床预测具有重要意义,尤其是在基因检测和罕见疾病的早期诊断中。
罕见与常见遗传变异的交互作用
该研究还展示了罕见和常见遗传变异如何共同作用影响非临床群体中的表型,揭示了健康人群中单基因疾病可能的病因变异携带者的存在。这一点强调了遗传背景在疾病表达和临床表型中的复杂性和多样性。
Strategies
罕见变异的识别与分析
在这项研究中,研究人员首先利用英国生物银行(UK Biobank, UKB)的数据,通过外显子测序(exome sequencing)和微阵列数据(microarray data),识别出携带罕见预测功能丧失(predicted loss-of-function, pLoF)变异和有害错义变异(deleterious missense variants)的个体。罕见变异是在参与者中出现频率极低的遗传变异,这些变异可能导致基因功能的丧失或改变。
多基因得分的应用
研究中应用了教育成就多基因得分(Educational Attainment Polygenic Score, EA-PGS)来评估个体的遗传倾向。EA-PGS是基于大量常见遗传变异的累积效应计算得出的,这些变异各自对教育成就的影响可能微小,但合并起来可以显著预测个体在教育领域的表现。
表型特征的评估
利用UK Biobank的丰富表型数据,研究团队评估了包括认知功能、教育年限、就业状态等在内的多种社会经济特征。这些表型数据使研究人员能够探索罕见变异和多基因得分如何共同影响这些复杂的人类特征。
统计分析
通过进行线性回归(linear regression)和逻辑回归(logistic regression)分析,研究人员评估了罕见变异负担(rare variant burden)与各种表型之间的关联。这些统计测试帮助确定了罕见变异数量增加对认知和社会经济结果的具体影响。
分层分析
研究还进行了分层分析,将UK Biobank的参与者根据他们的EA-PGS分为不同的五分位数(quintiles),并重复进行表型关联测试。这种方法使研究人员能够详细探讨不同遗传背景下表型表达的差异。
基因与表型的相关性
研究还探讨了教育成就全基因组关联研究(Genome-Wide Association Studies, GWAS)位点与发展性障碍基因(Developmental Disorders Gene-to-Phenotype Database, DDG2P)的关系,以评估这些基因是否与罕见疾病相关基因空间上接近,可能揭示罕见和常见变异通过重叠的生物途径作用。
Behind the Scenes
罕见变异的累积效应
罕见变异通常指在人群中频率极低的遗传变异,这些变异可能引起显著的遗传性疾病或对表型产生重大影响。在这项研究中,罕见变异主要包括预测的功能丧失变异(Predicted Loss-of-Function, pLoF)和有害的错义变异(Deleterious Missense Variants)。罕见变异的累积效应指的是个体中多个罕见变异相互作用,共同影响表型的现象,这在发育障碍(Developmental Disorders, DD)基因中表现得尤为明显。
累积效应的证据与数据
研究中使用英国生物银行(UK Biobank, UKB)的数据,涵盖了419,854名成人的遗传和表型信息。分析显示,在这些参与者中,约12%的个体携带至少一个罕见的可能有害变异。更进一步,研究发现携带多个罕见变异的个体,在多个认知和社会经济特征上表现出更显著的不利影响。例如,这些个体在流动智力测试中的得分较低,教育年限短,就业率低,收入较少,并且社会经济地位(通过Townsend Deprivation Index, TDI 测量)更低。
罕见变异与表型关联的统计分析
通过线性回归和逻辑回归模型,研究详细分析了罕见变异负担与特定表型间的关系。结果显示,随着罕见变异数的增加(特别是2个以上),与只携带一个罕见变异或不携带罕见变异的个体相比,多个罕见变异的携带者在流动智力、身高、教育年限、收入和社会经济地位上的表现显著下降。例如,拥有三个或更多罕见变异的个体,在得到儿童发展性疾病(Child DD)的诊断方面比非携带者的可能性高2.1倍(95% CI, 1.05–4.33; P = 0.03),在成人神经精神疾病(Adult Neuropsychiatric Conditions)方面高1.7倍(95% CI, 1.01–2.89; P = 0.04)。
罕见变异累积效应的生物学机制
罕见变异的累积效应可能通过多种生物学途径实现,包括基因间相互作用、表观遗传调控和蛋白质网络的干扰。这些复杂的交互作用可能导致基因表达的改变,影响细胞功能和代谢途径,从而在表型上产生累积的效应。
教育成就多基因得分(EA-PGS)的缓解作用
教育成就多基因得分(Educational Attainment Polygenic Score, EA-PGS)是一个基于大规模基因组关联研究(Genome-Wide Association Studies, GWAS)结果计算得出的得分,用以预测个体在教育领域的表现。该得分通过累加多个与教育成就相关的常见遗传变异的效应大小来评估个体的遗传倾向。在这项研究中,EA-PGS被用作一种工具,以探讨它是否能缓解由罕见变异引起的不利表型影响。
EA-PGS的缓解效应
通过对UK Biobank中成年人群的分析,研究发现,高EA-PGS分数与更好的认知功能、更长的教育年限、更高的就业率及更高的收入正相关。特别是在罕见变异携带者中,高EA-PGS能够部分抵消这些罕见变异对认知功能和社会经济地位的不利影响。例如,在具有至少一个罕见变异的个体中,那些EA-PGS在高分位数(70th percentile以上)的个体表现出与没有罕见变异的对照组相似的流动智力测试成绩。这表明EA-PGS可以在一定程度上抵消罕见变异的负面影响。
通过多变量回归分析,研究显示在控制了年龄、性别、主要成分分析(Principal Component Analysis, PCA)后,高EA-PGS的个体在多个认知和社会经济表型上表现得更好。具体来说,在拥有至少一个罕见DD变异的个体中,高EA-PGS与改善的认知能力和社会经济状态显著相关。这一结果不仅适用于具有单一罕见变异的个体,也适用于携带多个罕见变异的个体。
EA-PGS的生物学解释
从生物学角度解释,EA-PGS可能通过增强或调节与认知和学习相关的基因表达,间接影响个体的认知能力和学习能力。这可能涉及到神经发育和突触功能等关键生物学途径,这些途径与教育成就紧密相关。
EA-PGS的缓解作用强调了在罕见疾病和其他遗传性疾病的遗传咨询中,考虑个体的整体遗传背景的重要性。这一发现不仅提供了一种潜在的策略来减轻罕见遗传变异的负面影响,而且还为未来研究提供了方向,即进一步探索如何通过调节遗传背景来优化治疗策略,以及如何利用多基因得分来改善个体的生活质量和健康预后。
表型“偏离者”与遗传风险
表型“偏离者”(Phenotypic Deviators)是指那些基因遗传易感性预测与实际观察到的表型显著不符的个体。在该研究中,特别关注了那些教育成就多基因得分(Educational Attainment Polygenic Score, EA-PGS)较高但认知功能评分较低,以及EA-PGS较低但认知功能评分较高的个体。
使用UKB的大规模数据集,研究人员识别了表型“偏离者”,并分析了这些个体与罕见发育障碍(Developmental Disorders, DD)基因变异的相关性。例如,研究中发现,在EA-PGS处于最高十分位(top decile)但流动智力(fluid intelligence)评分最低(0或1分)的个体中,罕见DD变异的携带率显著高于同一EA-PGS分位但流动智力评分较高的个体。
罕见变异与表型偏离的关联
统计分析结果显示,高EA-PGS但低认知功能的个体罕见DD变异的携带概率是1.68倍(95% CI, 1.13–2.50; P = 0.01),而那些处于高EA-PGS分位但没有教育资格记录(educational qualifications)的个体,罕见变异的携带率是非携带者的1.22倍(95% CI, 1.10–1.35; P = 0.00006)。这些结果表明,罕见遗传变异可能是导致遗传易感性与表型表达不一致的一个重要因素。
生物学机制与影响
表型“偏离者”的存在可能与罕见变异影响特定的生物学路径有关,这些路径与认知功能和教育成就紧密相关。例如,罕见变异可能影响神经元的功能和突触连接,从而影响信息处理和学习能力。此外,这些变异可能通过改变脑部结构或神经化学信号传递的方式来影响个体的认知表现。
潜在的局限性
选择偏差与代表性问题
英国生物银行(UK Biobank, UKB)虽然是一个广泛使用的大型数据集,但它并不完全代表整个英国或更广泛人群的遗传和环境多样性。UKB的参与者通常具有更高的社会经济状态和更好的健康状况,这可能影响研究结果的推广性。此外,罕见疾病患者或具有严重遗传缺陷的个体可能在该队列中被低估。
遗传多样性的考虑不足
研究主要关注的是欧洲血统的个体,这限制了发现可广泛应用于其他种族或人群的遗传标记的能力。不同人群间的遗传差异可能导致罕见变异的频率和影响存在显著差异,因此,研究结果可能不适用于非欧洲血统的人群。
遗传与环境因素的交互作用
虽然研究考虑了遗传因素对表型的影响,但未能充分考虑环境因素与遗传因素的可能交互作用。环境因素,如教育机会、生活习惯和社会经济状况,均可能影响或修饰遗传变异的表型效应。不包括这些因素可能导致对遗传风险的估计不准确。
罕见变异的功能解释
该研究依赖于外显子测序来确定功能丧失(Loss-of-Function, LoF)和有害错义(Deleterious Missense)变异,但对于这些变异确切的生物学影响仍有限。一些罕见变异可能被错误归类为有害,而实际上它们可能是良性的或功能未知的。此外,对于非编码区域的罕见变异,其功能和影响通常更难预测和验证。
统计力和多重测试问题
由于罕见变异的本质,特别是那些极低频率的变异,研究在某些分析中可能缺乏足够的统计力来检测到真实的遗传效应。此外,考虑到进行了多种表型的多重比较,可能会增加发现假阳性结果的风险。尽管使用了Bonferroni校正等方法来控制家族误差率,但这些校正可能过于严格,导致一些真实的相关性未被识别。
潜在的研究方向
稀有变异与表型表达的关联性研究
该研究表明,携带多个稀有变异(multiple rare variants)在单基因发育障碍(monogenic developmental disorders, DDs)基因中的个体,其表型效应比单一变异携带者更为显著。未来研究可进一步探讨不同类型的稀有变异(如错义变异(missense)、丧失功能变异(LoF)在不同表型特征上的具体作用机制。
常见变异与稀有变异的相互作用
研究发现,教育成就多态性得分(EA-PGS)与稀有DD变异的表型表达具有累加效应。这表明常见变异可以通过调整表型阈值来影响稀有变异的表达。未来研究可以探索更多常见变异与稀有变异之间的交互作用,以及它们是如何共同影响疾病易感性和表型变异性的。
群体队列研究中稀有变异的识别和功能分析
在大规模群体队列如UK Biobank中,识别与表型相关的稀有变异是一大挑战。通过使用全外显子测序和微阵列数据,研究已经发现与DD相关的稀有变异在非临床人群中的表型影响。未来研究可以利用更广泛的群体数据,提高稀有变异检测的精度和功能分析的深度。
跨种族和地理群体的遗传研究
目前的研究主要基于欧洲血统的个体,未来可以扩展到其他种族和地理群体,研究遗传背景如何影响稀有和常见变异在不同人群中的表型表达,以及这些遗传差异如何影响疾病的全球分布和治疗策略。
原文链接
Kingdom R, Beaumont RN, Wood AR, Weedon MN, Wright CF. Genetic modifiers of rare variants in monogenic developmental disorder loci. Nat Genet. 2024 Apr 18. doi: 10.1038/s41588-024-01710-0. Epub ahead of print. PMID: 38637616.
https://www.nature.com/articles/s41588-024-01710-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#罕见变异# #单基因发育障碍#
77