梅斯盘点:2022年实体肿瘤领域十大临床研究进展
2022-12-28 MedSci原创 MedSci原创 发表于上海
肿瘤领域一直是研究热点,梅斯小编针对实体肿瘤,汇集2022年度十大临床研究进展,经飨读者。
肿瘤领域一直是研究热点,梅斯小编针对实体肿瘤,汇集2022年度十大临床研究进展,经飨读者。
1、DS-8201横空出世,能让60%的乳腺癌患者获益,在跨瘤种也有收获
DS-8201是一个新型的ADC药物,由人源化抗HER2抗体+伊立替康类化疗药物的偶联药物组成。可裂解的连接子在血液循环中结构稳定,药物脱落率低,从而降低毒副反应,且DS-8201具有高效的“旁观者效应”。DS-8201目前在乳腺癌、胃癌、结直肠癌中进行了若干研究,显示出良好的抗肿瘤活性。
2022年6月5日,《新英格兰医学杂志》(NEJM)在线发表DESTINY-Breast04 研究结果。DESTINY-Breast04研究是一项全球、随机、开放标签3期临床试验,评估曲妥珠单抗-deruxtecan与医生选择的治疗方案(TPC)相比,在 HER2低表达、既往接受过解救治疗(HR阳性患者要求接受过内分泌解救治疗)的不可切除和/或转移性乳腺癌患者中的疗效和安全性。结果显著,引发全球学者的关注,见:NEJM:新型HER2-ADC Enhertu打破HER2低表达的乳腺癌治疗困境(DESTINY-Breast04)。随后FDA加速批准其上市,见:FDA提前4个月加速批准DS-8201治疗HER2低表达乳腺癌,超6成乳腺癌患者均能受益
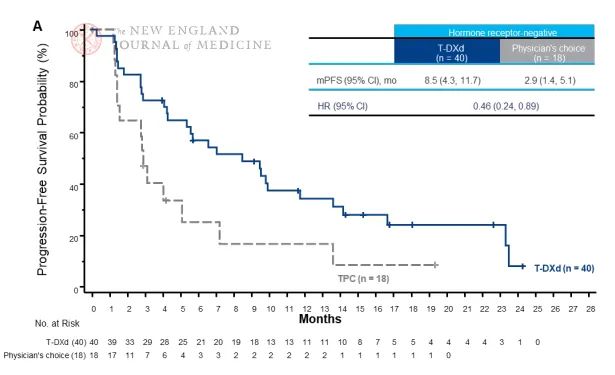
与T-DM1头对头对比中,又大获全胜。T-DXd治疗在无进展生存期方面比T-DM1有优势。T-DXd组的无进展生存期中位数未达到(95%CI,18.5至无法估计),T-DM1组为6.8个月(95%CI,5.6~8.2)。T-DXd组12个月后无进展生存率为75.8%,而T-DM1组为34.1%(全因死亡或疾病进展风险为0.28),详细见:Trastuzumab Deruxtecan治疗HER2阳性乳腺癌效果优于trastuzumab emtansine
同样,对于乳腺癌脑转移,一项2期结果也令人惊艳,详细见:Nat Med:临床研究证实,ADC药物可有效治疗乳腺癌的脑转移
曲妥珠单抗deruxtecan(原DS-8201) 是一种HER2抗体药物偶联物,其在HER2突变的NSCLC患者中的有效性和安全性尚未得到广泛研究。本研究是一项多中心、国际性的2期临床试验,旨在评估曲妥珠单抗deruxtecan(6.4 mg/kg)用于标准疗法难治性的转移性HER2突变型NSCLC患者的有效性和安全性。主要终点是通过独立集中审核判定的客观缓解率。次要终点包括缓解持续时间、无进展生存期、总生存期和安全性。共招募了91位患者。中位随访了13.1个月。55%的患者获得了客观缓解。中位缓解持续时间为9.3个月(95% CI 5.7-14.7)。中位无进展生存期为8.2个月(95% CI 6.0-11.9),中位总生存期为17.8个月(95% CI 13.8-22.1)。详细见:NEJM:采用Trastuzumab Deruxtecan治疗转移性HER2突变型非小细胞肺癌
HER2-低表达的胃或胃食管交界处腺癌方面同样获不错的效果。详细见:J Clin Oncol:Trastuzumab Deruxtecan治疗HER2低表达胃/胃食管交界癌的疗效和安全性
2、新型免疫治疗获极大关注
(1)新一代免疫检查点LAG-3初获成功
LAG-3(淋巴细胞激活基因3)和PD-1(程序性死亡受体1)均为 T 细胞上的导致 T 细胞耗竭的抑制性免疫检查点。之前的研究已经证明了 Relatlimab(抗LAG-3单抗)+Nivolumab(抗PD-1单抗)联合治疗对既往治疗过的黑色素瘤患者是安全且有效的,但对于先前未经治疗的黑色素瘤患者的安全性和治疗活性仍需调查。
美国得克萨斯大学MD安德森癌症中心 Hussein Tawbi 教授联合全世界数十家医疗机构在《新英格兰医学杂志》(NEJM)发表了题为:Relatlimab and Nivolumab versus Nivolumab in Untreated Advanced Melanoma 的临床实验论文。
这项II/III期双盲随机对照临床试验,共有714名晚期黑色素瘤患者参与,实验组接受 Relatlimab+Nivolumab联合治疗,对照组接受 Nivolumab 单药治疗。临床试验结果显示,与对照组相比,实验组的中位无进展生存期增加了一倍(10.1月VS4.6月),且安全可控。在12个月的随访中,实验组无进展生存率为47.7%,而对照组为36%,实验组疾病进展或死亡风险降低了25%。详细见:NEJM:第三代免疫检查点上场:LAG-3+PD-1,晚期癌症无进展生存期提高一倍。同时自然杂志也发表类似的报道,见:Nature:PD-1+LAG3新辅助治疗在黑色素瘤治疗中显威,57%患者完全缓解。
(2)、肿瘤浸润淋巴细胞治疗实体瘤重现光明
肿瘤浸润淋巴细胞(TIL)治疗历史很长,但是很多年没有突破,尤其是随着免疫检查点抑制剂的出现,甚至被人遗忘。然而最新一项研究让其重现光明。PD-1单抗,如Nivolumab或Pembrolizumab是转移性黑色素瘤患者常用的一线方法,但仅50%的患者可实现持续的治疗应答。临床上,CTLA-4单抗Ipilimumab联合PD-1单抗Nivolumab可提高患者治疗应答率,但严重不良事件风险较高,目前仅限于血清乳酸脱氢酶(LDH)水平高或肝脑转移的晚期患者。肿瘤浸润淋巴细胞(tumor infiltrating: lymphocytes,TIL),包括T细胞,NK 细胞等,对肿瘤细胞具有识别和杀伤作用。I-II期临床研究中,TIL细胞疗法对晚期转移性黑色素瘤患者表现出良好的治疗效果。
在意向治疗人群中,TIL组的中位无进展生存期为7.2个月,Ipilimumab组为3.1个月(进展或死亡风险比0.50)。49%TIL组以及和21%Ipilimumab组患者实现客观治疗应答。TIL组的中位总生存期为25.8个月, Ipilimumab组为18.9个月。详细见:NEJM:肿瘤浸润淋巴细胞疗法 vs Ipilimumab治疗晚期黑色素瘤
3、KRAS G12C抑制剂在多个实体瘤中初现战绩
近些年报道的KRAS G12C不可逆抑制剂(如AMG510、MRTX849)临床研究初步结果让整个医学界看到了抑制KRAS突变的曙光。与sotorasib相似,adagrasib是KRASG12C的选择性共价抑制剂;目前已报道的上述两种分子的药理学差异包括:sotorasib的药物半衰期为5小时,而adagrasib为23小时;adagrasib能够以剂量依赖性方式延长暴露时间;以及adagrasib可能可以穿透CNS。
KRYSTAL-1试验队列A结果(II期),评估了Adagrasib用于局部晚期或转移性KRAS p.G12C突变NSCLC患者的疗效和安全性。本研究显示,adagrasib治疗KRAS G12C的ORR为42.9%,PFS为6.5个月、OS为12.6个月。并且对大多数亚组(包括CNS转移患者)和大多数分子相关特征显示出临床疗效证据。不过对于CNS转移患者的疗效属于回顾性分析,目前针对未经治疗的活动性CNS转移患者的前瞻性Ib期队列研究正在进行中。详细见:NEJM丨肺癌,KRAS新药adagrasib再显锋芒,ORR高达42.9%。随后,FDA已加速批准adagrasib用于经FDA批准的检测方法确定的KRAS g12c突变局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗,这些患者之前至少接受过1次全身治疗。详细见:FDA批准adagrasib治疗局部晚期或转移性KRAS G12C+ NSCLC
在结直肠癌方面,在这项 1-2 期、开放标签、非随机临床试验中,我们分配接受过大量预处理的 KRAS G12C 突变型转移性结直肠癌患者接受Adagrasib单药治疗(600 毫克,每天两次口服)或Adagrasib(相同剂量)与 每周一次静脉注射西妥昔单抗(初始负荷剂量为每平方米体表面积 400 毫克,随后剂量为每平方米 250 毫克)或每 2 周一次(剂量为每平方米 500 毫克)。 主要终点是客观反应(完全或部分反应)和安全性。截至 2022 年 6 月 16 日,共有 44 名患者接受了Adagrasib,32 名患者接受了Adagrasib和西妥昔单抗的联合治疗,中位随访时间分别为 20.1 个月和 17.5 个月。 在单药治疗组(43 名可评估患者)中,19% 的患者有客观反应(95% 置信区间 [CI],8 至 33)。 中位反应持续时间为 4.3 个月(95% CI,2.3 至 8.3),中位无进展生存期为 5.6 个月(95% CI,4.1 至 8.3)。 在联合治疗组(28 名可评估患者)中,反应率为 46%(95% CI,28 至 66)。 中位反应持续时间为 7.6 个月(95% CI,5.7 至不可估计),中位无进展生存期为 6.9 个月(95% CI,5.4 至 8.1)。 单药治疗组 3 级或 4 级治疗相关不良事件的百分比为 34%,联合治疗组为 16%。 未观察到 5 级不良事件。详细见:NEJM:KRAS抑制剂Adagrasib联合或不联合西妥昔单抗对结直肠癌的疗效与安全性(KRYSTAL-1研究)
胰腺癌被人们称作“癌王”,因其超高的治疗难度以及恶性程度而令人闻风丧胆。美国国家癌症院的统计数据中,晚期胰腺癌患者的五年生存率,仅有2.9%,为常见癌症中最低。Sotorasib(AMG510)是一种G12C抑制剂,在KRAS G12C突变型非小细胞肺癌中具有良好的客观缓解率(ORR)为32.2%,但在结直肠癌和胰腺癌中作为单药治疗时,主要发挥稳定疾病进展的作用。 最新一项单组1-2期临床试验,评价 sotorasib 治疗在至少接受过一次全身治疗的 KRAS p.G12C 突变胰腺癌患者中的安全性和有效性。结果显示,Kaplan-Meier 估计的无进展生存期在 6 个月时为 31.6%(95% CI,16.7 至 47.7),在 9 个月时为 9.9%(95% CI,2.0 至 25.6)。 中位随访 16.8 个月(95% CI,9.5 至无法评估),中位总生存期为 6.9 个月(95% CI,5.0 至 9.1)(图 1D)。 Kaplan-Meier 估计的 12 个月总生存率为 19.6%(95% CI,7.2 至 36.3)。详细见:NEJM:KRAS抑制剂sotorasib治疗胰腺癌安全有效(CodeBreaK100研究)
4、PD-1免疫检查点抑制剂仍然老而弥坚!
(1)纳武单抗的新辅助治疗可切除的非小细胞肺癌有明显获益
对于可切除的非小细胞肺癌 (NSCLC),新辅助或辅助化疗比单纯手术有一定的益处。在早期试验中,基于纳武单抗的新辅助治疗方案已显示出有希望的临床活性;但是,还需要3期试验结果进一步验证。共招募了773位患者,其中358位被随机分至两组,最终每组有176位患者接受了研究治疗。最短随访了21个月,纳武单抗+化疗组和单化疗组的中位无事件生存期分别是31.6个月和20.8个月(疾病进展、复发或死亡的风险比[HR] 0.63,p=0.005);病理完全缓解率分别是24.0%和2.2%(优势比[OR] 13.94,p<0.001)。在大多数亚组分析中,联合组的无事件生存期和病理完全缓解结果均优于单化疗组。对于可切除的非小细胞肺癌患者,与单纯化疗相比,纳武单抗联合化疗新辅助治疗可显著延长无事件生存期,明显提高病理完全缓解率,且不提高副反应事件发生率。详细见:NEJM:纳武单抗+化疗作为可切除肺癌的新辅助治疗可大大改善患者预后
(2) 纳武单抗联合治疗对晚期食管鳞状细胞癌
晚期食管鳞状细胞癌的一线化疗效果不佳。纳武单抗在既往接受过治疗的晚期食管鳞状细胞癌患者治疗在总生存期方面优于化疗。在这项开放标签的3期试验中,研究人员以1:1:1的比例将既往未治疗、不可切除的晚期、复发性或转移性食管鳞状细胞癌成人随机分配接受纳武单抗联合化疗、纳武单抗联合单克隆抗体易普利姆玛治疗或化疗。该研究的主要终点是总生存期和无进展生存期,由盲法独立的审查组来确定。首先在肿瘤细胞程序性死亡配体1(PD-L1)表达为1%或更高的患者中进行分层测试,然后在整个人群(所有随机分配的患者)中进行。
该研究共有970名患者接受了随机分组。在至少13个月的随访中,在肿瘤细胞PD-L1表达为1%或更高的患者(中位数为15.4个月 vs. 9.1个月;风险比为0.54;99.5%置信区间[CI]为0.37至0.80;P<0.001)和总体人群(中位数为13.2个月 vs. 10.7个月;风险比为0.74;99.1%CI为0.58至0.96;P=0.002)中,纳武单抗联合化疗组的总生存期显著长于单独化疗组。在肿瘤细胞PD-L1表达为1%或更高的患者(中位数,13.7个月 vs. 9.1个月;风险比为0.64;98.6%CI为0.46至0.90;P=0.001)和总体人群(中位数为12.7个月 vs. 10.7个月;风险比为0.78;98.2%CI为0.62至0.98;P=0.01)中,纳武单抗联合易普利姆玛的总生存期也显著长于化疗组。详细见:NEJM:纳武单抗联合治疗对晚期食管鳞状细胞癌的疗效分析
(3) 帕博利珠单抗治疗晚期三阴性乳腺癌获得最终证据支持
在这项3期临床试验的中期分析中,在化疗中加入帕博利珠单抗(pembrolizumab,K药)比单独化疗治疗晚期三阴性乳腺癌患具有更长的无进展生存期,这些患者的肿瘤表达程序性死亡配体1(PD-L1)且联合阳性分数(CPS)为10或以上。最终结果显示在肿瘤表达PD-L1且CPS为10或更高的晚期三阴性乳腺癌患者中,相比单独化疗,在化疗中加入帕博利珠单抗带来了总生存期的明显延长。详细见:NEJM重磅:K药一线治疗三阴乳腺癌OS结果终现!,随后FDA也批准了K药的新适应症。
(4) 乐伐替尼加派姆单抗治疗晚期子宫内膜癌
在这项3期试验中,研究人员以1:1的比例将先前接受过至少一种含铂化疗方案的晚期子宫内膜癌患者随机分配接受乐伐替尼(20mg,每天口服一次)联合派姆单抗(200mg,每3周静脉内给药)或主治医师选择的化疗方案(阿霉素60mg/m2,每3周静脉内给药,或紫杉醇80mg/m2,每周静脉给药)治疗。该研究的两个主要终点是由盲法的独立审查者根据实体瘤疗效评估标准1.1版来评估的无进展生存期和总生存期。在错配修复熟练(pMMR)疾病患者和所有患者中评估终点,此外,研究人员还评估了该疗法的安全性。
该研究共纳入了827名患者(697名pMMR疾病和130名错配修复缺陷疾病),他们被随机分配接受乐伐替尼加派姆单抗(411名患者)或化疗(416名患者)。乐伐替尼加派姆单抗治疗组的中位无进展生存期比化疗组要长(pMMR人群:6.6个月 vs. 3.8个月;进展或死亡的风险比为0.60;95%置信区间[CI]为0.50至0.72;P<0.001;总体而言:7.2 vs. 3.8个月;风险比为0.56;95%CI为0.47至0.66;P<0.001)。
乐伐替尼加派姆单抗治疗组的中位总生存期比化疗组长(pMMR人群:17.4个月 vs. 12.0个月;死亡风险比为0.68;95%CI为0.56至0.84;P<0.001;总体:18.3个月 vs. 11.4个月;风险比为0.62;95%CI为0.51至0.75;P<0.001)。88.9%接受乐伐替尼联合派姆单抗治疗的患者和72.7%接受化疗的患者发生3级或更高级别的不良事件。详细见:NEJM:乐伐替尼加派姆单抗治疗晚期子宫内膜癌
(5) Cemiplimab用于皮肤鳞状细胞癌新辅助治疗获突破
Cemiplimab(西米普利单抗) 是一种抗程序性细胞死亡 1 (PD-1) 单克隆抗体,已被批准用于治疗没有局部治疗方案的转移性或局部晚期皮肤鳞状细胞癌。这项 2 期、多中心、单组、非随机研究在澳大利亚、德国和美国招募了患者。研究的第一部分评估了 cemiplimab 作为术前新辅助治疗的疗效,用于符合条件的可切除皮肤鳞状细胞癌患者。新辅助西米普利单抗(cemiplimab),每 3 周一次,最多 4 剂,每 3 周给药一次,最多 4 剂,以治愈为目的,与 51% 的 II、III 或 IV 期(M0)皮肤鳞状细胞癌患者的病理完全缓解相关。在基于影像学的反应评估中,根据 RECIST 1.1 定义并根据研究者评估确定的反应,在 68% 的患者中观察到客观反应。详细见:NEJM:Cemiplimab用于II 至 IV 期可切除的皮肤鳞状细胞癌的新辅助治疗
(6)Cemiplimab治疗复发性宫颈癌
复发性宫颈癌患者的预后往往很差。Cemiplimab是一种全人源PD-1抗体,现已获得FDA批准用于一线治疗肿瘤高表达PD-L1(TPS≥50%)、有转移性或局部晚期肿瘤、不适合手术切除或根治性放化疗、肿瘤无EGFR、ALK或ROS1畸变的非小细胞肺癌和皮肤癌。已有研究显示,Cemiplimab在复发性宫颈癌患者中有一定的抗肿瘤活性。共招募了608位患者(每组各304位)。在总试验人群中,Cemiplimab组的中位总生存期明显长于化疗组(12.0 vs 8.5个月,死亡的风险比 0.69,p<0.001)。这种生存效益在两种病理亚组(鳞状细胞癌和腺癌[包括腺鳞癌])中均保持一致。Cemiplimab组的无进展生存期也明显长于化疗组(疾病进展或死亡的风险比 0.75,p<0.001)。Cemiplimab组和化疗组的客观缓解率分别是16.4%和6.3%。Cemiplimab组PD-L1表达≥1%的患者的客观缓解率是18%,PD-L1表达<1%的患者的是11%。详细见:NEJM:采用Cemiplimab治疗复发性宫颈癌
5、溶瘤病毒在脑胶质瘤领域初现效果
弥漫性脑桥脑胶质瘤 (DIPG) 是一种通常与组蛋白 H3 基因突变相关的疾病,是儿童期脑肿瘤相关死亡的主要原因。 由于位置、浸润性和侵袭性,治疗选择有限 肿瘤的行为。 尽管标准放疗有短暂的益处,但预后很差,神经功能进行性恶化,中位生存期不到 1 年,2 年生存期低于 10%。
溶瘤病毒 HSV-G207 已用于一项涉及大脑半球高级别胶质瘤儿科患者的 1 期试验。 条件复制溶瘤腺病毒 DNX-2401(tasadenoturev,或 Delta-24-RGD [精氨酸-甘氨酸-天冬氨酸])已在一项涉及复发性恶性神经胶质瘤成年患者的剂量递增研究中进行了评估。该研究的结果表明,单次肿瘤内剂量的 DNX-2401 在肿瘤微环境中引起免疫细胞浸润,诱导可变肿瘤反应,并可能导致 25 名患者中的 3 名延长生存期。也有不良事件,其中大多数为 3 级或以下。在临床前模型中,DNX-2401 显示对 DIPG 细胞具有直接溶瘤活性,引发抗肿瘤免疫反应,并显示出与放疗的协同作用。
从 2017 年 12 月到 2020 年 1 月,共有 12 名新诊断为 DIPG 的患者(7 名女性和 5 名男性)参加了研究(图 1)。患者的中位年龄为 9 岁(范围为 3 至 18 岁)。12 名患者中有 9 名(75%)观察到肿瘤横截面积减少,并且与 DNX-2401 的剂量没有明显相关性。详细见:NEJM:溶瘤病毒DNX-2401治疗小儿弥漫性脑桥脑胶质瘤
6、癌症疫苗多点开花,初获成果
癌症疫苗为治疗癌症提供了希望,然而,经过50年的发展和临床试验,癌症疫苗并没有获得实质性成功,没有一种癌症疫苗能够比当前的单药治疗提供更好的无复发生存期益处。随着对免疫机制的理解和癌症生物学的发展,个性化癌症疫苗为癌症治疗带来了新的机会。
(1)通用型癌症肽基疫苗 (UCPVax) 在NSCLC中初获疗效
通用型癌症肽基疫苗 (UCPVax) 是一种治疗性癌症疫苗,由两种高选择性的辅助肽组成,可诱导靶向端粒酶的CD4+ T 辅助细胞1反应。该Ib/IIa期临床试验旨在评估UCPVax三种剂量方案在转移性非小细胞肺癌 (NSCLC) 患者中的安全性、免疫原性和有效性。
根据基于贝叶斯的Ib期和IIa期降级设计,难治性NSCLC患者被分配接受三种剂量的UCPVax疫苗(0.25mg、0.5mg和1mg)。主要终点是剂量限制性毒性和免疫反应。次要终点是1年时的总生存期和无进展生存期。
共59位患者接受了UCPVax治疗;95%的患者接受过三线系统治疗。在Ib期15位患者中未观察到剂量限制性毒性。最大耐受剂量是1mg。51位患者被纳入IIa期。第3剂和第6剂UCPVax后的特异性CD4+ T 辅助细胞1 反应率分别是56%和87.2%,三种剂量水平之间无明显差异。21位(39%)患者获得了疾病控制(疾病稳定,n=20;完全缓解,n=1)。一年总生存率是34.1%,中位总生存期是9.7个月,各剂量水平之间无显著差异。免疫应答者的一年无进展生存率是17.2%,中位总生存期是11.6个月;无应答者的分别是4.5%和5.6个月。详细见:J Clin Oncol:通用型癌症疫苗在晚期非小细胞肺癌中的免疫原性和疗效
(2)标准疗法加用自体肿瘤裂解物负载树突状细胞疫苗治疗胶质母细胞瘤
胶质母细胞瘤是最致命的一种原发性脑癌。目前,胶质母细胞瘤的临床结果仍然很差,亟要新的治疗方法。该研究目的是探讨在标准疗法 (SOC) 中加入自体肿瘤裂解物负载树突状细胞疫苗(DCVax-L) 是否能延长胶质母细胞瘤患者的生存期。这是一项前瞻性、外部对照的非随机3期临床试验,评估了采用DCVax-L+SOC(替莫唑胺)治疗的新确诊的胶质母细胞瘤(nGBM)和复发性胶质母细胞瘤(rGBM)患者的总生存期(OS),并与同时间接受SOC治疗的匹配的外部对照患者进行对比。主要终点是总生存期(OS)。共招募了331位患者,其中232位被随机分至DCVax-L组,99位被分至安慰剂组。接受DCVax-L治疗或安慰剂的nGBM患者的从随机分组起的中位OS(mOS)分别为19.3个月和16.5个月(HR 0.80, P=0.002),48个月时的生存率分别是15.7%和9.9%,60个月时的生存率分别是13.0%和5.7%。接受DCVax-L或安慰剂的rGBM患者复发后的mOS分别是13.2个月和7.8个月(HR 0.58,p<0.001),24个月的生存率分别是20.7%和9.6%;30个月的生存率分别是11.1%和5.1%。与外部对照患者相比,MGMT甲基化的nGBM患者接受DCVax-L治疗的生存率有所提高(HR 0.74, P=0.03)。 综上,与同期仅接受标准疗法的匹配的外部对照相比,在标准疗法中加用DCVax-L可使新诊断的和复发的胶质细胞瘤患者的生存期延长,具有临床意义和统计学意义。详细见:JAMA Oncol:标准疗法加用自体肿瘤裂解物负载树突状细胞疫苗治疗胶质母细胞瘤
(3)mRNA疫苗两巨头探索癌症疫苗
2022年10月,默沙东宣布向Moderna支付2.5亿美元,合作开发个性化mRNA癌症疫苗mRNA-4157(编码至多34个肿瘤新抗原),将其与默沙东的抗PD-1单抗Keytruda(K药)联用,进行治疗高危黑色素瘤患者的2期临床试验。
仅仅2个月后,Moderna日前宣布,个性化mRNA癌症疫苗mRNA-4157与Keytruda联用治疗黑色素瘤的2b期临床试验达到主要终点,黑色素瘤患者的复发或死亡风险降低了44%。Moderna表示,将在2023年开展3期临床试验,并将扩展到其他癌症类型的治疗。
详细见:mRNA癌症疫苗效果突出,2b期临床大幅降低癌症复发和死亡风险
同样,BNT也正在开发mRNA疫苗,基于 mRNA 的研究性癌症疫苗 BNT116 将联合 Libtayo (cemiplimab) 治疗非小细胞肺癌 (NSCLC)。 BNT116 是基于 BioNTech 的 FixVac 平台开发的,其具有 NSCLC 细胞经常表达的抗原。该研究报道了一项1b期临床试验,将个体化新抗原癌症疫苗 NEO-PV-01 联合化疗和抗PD-1药物派姆单抗(pembrolizumab)用于转移性非鳞状非小细胞肺癌的一线治疗,证明这种治疗方案具有良好的耐受性,并诱导具有效应表型的新抗原特异性CD4+ T细胞应答。在ITT组中,16例患者完成了疫苗接种,仅报告了轻微的相关不良事件,表明NEO-PV-01联合化疗和派姆单抗是安全的,耐受性良好。正如预期的那样,与野生型肽相比,患者对新抗原表位的反应通常更强,39%和31%的疫苗多肽分别观察到CD4+和CD8+ T细胞应答。40周后,对测试的34个表位中的85%观察到疫苗诱导的免疫反应的长期持久性。详细见:研究性癌症疫苗BNT116联合Libtayo (cemiplimab) 治疗非小细胞肺癌、Cancer Cell:BioNTech新论文——肿瘤新抗原疫苗+化疗+PD-1,三管齐下治肺癌
(4)其它mRNA疫苗也有突破
这项1/2期临床研究(NCT03639714)表明,以个性化、异源黑猩猩腺病毒(ChAd68)和自扩增mRNA(samRNA)为基础的新抗原疫苗,可以诱导强烈、持久且有效的肿瘤新抗原特异性CD4+和CD8+T细胞应答,增强免疫检查点抑制剂的疗效,在晚期转移性实体瘤患者的治疗中表现优异。目前,该临床试验已经推进到2/3期。1期临床试验的次要终点包括免疫原性、制造可行性和患者的总生存期(OS)。试验结果表明,该疫苗的生产是可行的,并且该疫苗可以诱导持久的新抗原特异性CD8 T细胞应答。一些微卫星稳定型结直肠癌(MSS-CRC)患者的总生存期得到改善。此外,探索性生物标志物分析显示,总生存期延长的患者循环肿瘤DNA(ctDNA)降低。详细见:Nature Medicine:黑猩猩腺病毒+自扩增mRNA癌症疫苗,在临床试验中延长晚期实体瘤患者总生存期
(5)新靶点疫苗,有望应用于临床
美国哈佛大学的研究人员开发了一种新型更通用的疫苗,设计了一种全新的癌症疫苗,该疫苗可帮助免疫系消除肿瘤防御系统来摧毁癌症,可以诱导不同的T细胞和自然杀伤细胞进行协同攻击,这样能发挥更广泛的免疫功能。研究人员认为,该疫苗可用于治疗多种癌症。该疫苗针对的是肿瘤表面的MICA和MICB应激蛋白,当人体由于癌症而受到过多DNA损伤时,会大量产生这两种应激蛋白,但在健康细胞中几乎检测不到。研究人员还在非人类灵长类动物恒河猴中测试了疫苗安全性和免疫原性。研究显示,所有四只恒河猴在免疫后都产生了抗MICA和抗MICB抗体,并且随着随后的加强免疫,滴度增加了100-1000倍,免疫后没有发现临床副作用,为疫苗的安全性提供了初步证据。详细见:Nature:哈佛大学开发出通用型癌症疫苗,激发保护性免疫
7、二次肿瘤细胞减灭术对复发性卵巢癌患者治疗价值显现
卵巢癌患者的主要治疗方法是手术切除,随后进行卡铂和紫杉醇联合化疗。新近的研究发现,额外进行贝伐单抗或PARP抑制剂全身治疗可改善患者无进展生存。目前复发性卵巢癌的标准治疗手段为全身治疗,但仅有少数证据表明全身治疗对复发性卵巢癌患者总生存期有益。近日研究人员评估了二次肿瘤细胞减灭术对复发性卵巢癌患者的临床意义。
复发性卵巢癌患者参与研究,患者接受不含铂类化疗至少6个月后首次复发,随机接受二次细胞减灭术(手术组)或对照(单纯铂化疗),随后接受铂类化疗。患者的AGO评分阳性,ECOG评分为0,腹水少于500mL,并且在首次手术时可见病灶完全切除。研究的主要终点是总生存率,同时评估了生存质量和预后因素。
407名患者参与研究,其中206名患者接受细胞减灭术联合化疗,201名患者接受单纯化疗。手术组75.5%的患者实现了完全切除。手术组的中位总生存期为53.7个月,非手术组为46.0个月(死亡风险比为0.75)。实现完全切除患者的预后最好,中位总生存期为61.9个月。所有亚组分析中手术均更具优势。两组随访1年后的生活质量指标无显著差异,未发生术后30天内围手术期死亡事件。
研究认为,对于复发性卵巢癌患者,相比于单纯化疗,细胞减灭术后化疗可显著延长患者总生存期。详细见:NEJM:细胞减灭术后化疗可显著改善复发性卵巢癌患者预后
另一项荟萃分析也证实了这个结论,见:J Clin Oncol:二次细胞减灭术对铂敏感的复发性卵巢癌患者生存期的影响
8、激素敏感性肿瘤,新药显示出治疗优势
(1)达洛鲁胺改善转移性激素敏感性前列腺癌生存率
达洛鲁胺是一种有效的雄激素受体抑制剂,与非转移性去势抵抗性前列腺癌患者的总生存期增加相关。达洛鲁胺、雄激素剥夺疗法和多西他赛的组合是否会增加转移性、激素敏感性前列腺癌患者的生存率尚未明确。在这项国际3期试验中,研究人员将转移性激素敏感性前列腺癌患者以1:1的比例随机分配接受达洛鲁胺(剂量为600mg[两片300mg片剂],每天两次)或匹配的安慰剂治疗,均与雄激素剥夺疗法和多西他赛联合使用。该研究的主要终点是总生存期。
该研究主要分析涉及1306名患者(达洛鲁胺组651名,安慰剂组655名);86.1%的患者在最初诊断时患有转移性疾病。在主要分析的数据截止日期(2021年10月25日),达洛鲁胺组的死亡风险显著低于安慰剂组32.5%(风险比为0.68;95%置信区间为0.57至0.80;P<0.001)。详细见:NEJM:达洛鲁胺对转移性激素敏感性前列腺癌生存率的影响
(2)瑞博西尼加来曲唑治疗晚期HR阳性乳腺癌的总体生存率
激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性疾病是转移性乳腺癌最常见的亚型,并且仍然无法治愈。在之前对该3期试验的分析中,在激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的绝经后患者中,与单独采用来曲唑治疗相比,晚期乳腺癌采用一线瑞博西尼加来曲唑治疗的无进展生存期显著延长。不知道瑞博西尼的总生存期是否也会更长。研究人员报告了方案指定的总生存期最终分析结果,这是一个关键的次要终点。患者以1:1的比例随机分配接受瑞博西尼或安慰剂联合来曲唑。
中位随访6.6年后,瑞博西尼组334名患者(54.2%)发生181例死亡病例,安慰剂组334例(65.6%)患者发生219例死亡病例。与安慰剂加来曲唑相比,瑞博西尼加来曲唑具有显著的总体生存获益。瑞博西尼加来曲唑的中位总生存期为63.9个月(95%CI为52.4至71.0),安慰剂加来曲唑为51.4个月(95%CI为47.2至59.7)(死亡风险比为0.76;95%CI为0.63至0.93;两侧P=0.008)。没有观察到新的安全性事件。
由此可见,在HR阳性、HER2阴性晚期乳腺癌患者中,与安慰剂加来曲唑相比,瑞博西尼加来曲唑的一线治疗能具有显著的总体生存获益。瑞博西尼的中位总生存期比安慰剂长12个月以上。详细见:NEJM:瑞博西尼加来曲唑治疗晚期乳腺癌的总体生存率
9、低危肿瘤,同样需要精准防治研究
(1)低危鼻咽癌可以减毒治疗
中山大学肿瘤防治中心马骏、孙颖团队牵头,联合佛山市第一人民医院,梧州市红十字会医院,中山大学附属第五医院,华中科技大学同济医学院附属协和医院共5家单位,共同完成了一项在低危鼻咽癌患者中单纯放疗对比同期放化疗的前瞻性III期临床研究,首次创新低危鼻咽癌患者“减毒”治疗策略,显著改善了鼻咽癌患者的生活质量。详细见:JAMA:马骏、孙颖团队发现低危鼻咽癌可单纯放疗
(2)低危导管原位癌 (DCIS) 保守手术后精准放疗
有研究发现,全乳照射 (WBI) 后强化肿瘤床治疗可显著降低大部分侵袭性乳腺癌患者的局部复发率,但尚无随机试验证实。该研究调查了 WBI 后强化肿瘤床放疗是否可以改善非低风险 DCIS 患者的预后,并评估了非低风险 DCIS 患者的放疗剂量分割敏感性。
这是一项在多个国家开展的国际性、随机、非盲的3期临床试验,招募了年满18岁的单侧的组织学明确诊断的接受保乳手术治疗的非低风险 DCIS 女性患者,随机(1:1:1:1)分成四组:无肿瘤床强化 vs 常规 WBI 后强化 vs 大分割 WBI 后强化,或随机(1:1)分至无强化 vs 每次常规 WBI 后强化 vs 每次大分割 WBI 后强化。常规 WBI 总剂量是 50Gy,分成25次,大分割 WBI总剂量是42.5Gy,分成16次。强化剂量是16Gy,分成8次。主要终点是局部复发的时间。
2007年6月25日-2014年6月30日,共1608位患者被随机分至无强化组(805位)或强化组(803位)。831位患者进行了常规 WBI,777位患者进行了大分割 WBI。中位随访了6.6年。无强化组和强化组的5年无局部复发生存率分别是92.7%和97.1%(HR 0.47,p<0.001)。强化组有更高的≥2级的乳腺疼痛(10% vs 14%)和硬结率(6% vs 14%,p<0.001)。
综上,对于切除后的非低危乳腺导管原位癌患者,全乳放疗后对肿瘤床进行强化放疗可减少局部复发率,但同时会增加 2 级及以上毒性的发生率。该研究是首个证实这类患者术后WBI后强化放疗可改善局部控制情况的随机试验。详细见:Lancet:非低风险乳腺导管原位癌的放疗剂量和分割方案
(3)积极预防上皮内病变有助于预防肛门癌
肛门癌风险在不同人群中差别很大,HIV阳性人群的风险最高,其他高危人群包括因实体器官移植接受免疫抑制治疗人群、有外阴或宫颈高级别鳞状上皮内病变或癌症病史的女性,其他危险因素包括性肛交史,生殖器疣史,肛裂或瘘管以及吸烟等。研究证实宫颈HSIL治疗可降低宫颈癌进展风险,但对于肛门HSIL,相关研究尚不充分。近日研究人员考察了肛门高级别鳞状上皮内病变干预对肛门癌风险的影响。
ANCHOR研究在美国25个临床中心开展,为III期临床研究,35岁以上且经活检证实存在肛门HSIL的HIV感染者参与研究,随机接受HSIL治疗或未经治疗的主动监测。治疗包括消融或切除,局部使用氟尿嘧啶或咪喹莫特,治疗组接受治疗直到HSIL完全消失。所有参与者至少每6个月接受一次高分辨率肛门镜检查。研究的主要结果是肛门癌进展。
4459名患者参与研究,其中4446名(99.7%)完成研究。中位随访期为25.8个月,HSIL治疗组9例确诊肛门癌(每100000患者随访年173例),主动监测组确诊21例(每100000患者随访年402例),治疗组进展为肛门癌的风险较主动监测组低57%。详细见:NEJM:积极的肛门高级别鳞状上皮内病变治疗可降低肛门癌进展风险
(4)低风险甲状腺癌患者的无放射性碘甲状腺切除术
在这项前瞻性、随机、3 期试验中,我们将接受甲状腺切除术的低风险分化型甲状腺癌患者分配为在注射重组人促甲状腺素后接受放射性碘 (1.1 GBq) 的消融术(放射性碘组)或不接受 术后放射性碘(无放射性碘组)。 主要目的是评估在 3 年时未出现包括功能、结构和生物学异常在内的复合终点时,没有放射性碘治疗是否不劣于放射性碘治疗。 非劣效性定义为在全身扫描中没有发生包括放射性碘摄取异常灶在内需要后续治疗的事件(仅在放射性碘组中)的患者百分比的组间差异小于 5 个百分点 ),颈部超声检查异常发现,或甲状腺球蛋白或甲状腺球蛋白抗体水平升高。 次要终点包括事件和分子特征的预后因素。
在随机分组后 3 年可以接受评估的 730 名患者中,未发生事件的患者百分比在无放射性碘组为 95.6%(95% 置信区间 [CI],93.0 至 97.5),95.9%(95% CI , 93.3 至 97.7) 在放射性碘组中,差异为 -0.3 个百分点(双侧 90% CI,-2.7 至 2.2),结果符合非劣效性标准。 事件包括 8 名患者的结构或功能异常和 23 名患者的生物学异常,共 25 起事件。 甲状腺激素治疗期间术后血清甲状腺球蛋白水平超过 1 ng/mL 的患者发生事件的频率更高。 发生或未发生事件的患者的分子变化相似。 没有报告与治疗相关的不良事件。
结果表明,在接受甲状腺切除术的低风险甲状腺癌患者中,不涉及使用放射性碘的随访策略在 3 年时发生功能、结构和生物学事件方面不劣于使用放射性碘的消融策略。
这项研究结果发表在NEJM上
10、肿瘤筛查、精准评估、诊断方法需要不断重新认识
(1)结肠镜筛查作用可能被高估
绝大多数结直肠癌是由良性息肉发展而来,也就是说可以通过内镜检查发现并切除。在当前的研究和临床实践中,结肠镜是结直肠癌筛查普遍应用的金标准。目前大部分指南操作工结直肠癌筛查指南/专家共识多推荐每10年进行一次结肠镜筛查。如2022 亚太共识建议:结直肠癌筛查和息肉切除术后监测
然而,2022年10月9日,《新英格兰医学杂志》(NEJM)最新发表的一项大规模、基于人群的随机试验结果指出,结肠镜筛查在降低结直肠癌发病风险方面的作用或许被高估了!随访10年后,筛查组受试者结直肠癌相关死亡风险为0.28%(72例死亡),常规组为0.31%(157例死亡)(RR=0.90;95%CI:0.64-1.16),风险下降10%,但不具有统计学显著性。论文指出,两组受试者结直肠癌相关死亡率均较低,这与过去10年中结直肠癌治疗方案的改善有关。此外,与未接受筛查的受试者相比,筛查组受试者的死亡率并没有发生显著降低。详细见:NEJM:结肠镜筛查在降低结直肠癌发病风险方面可能被高估(NordICC研究)
(2)循环肿瘤细胞评估有助于精准治疗
手术就能治愈80%以上的II期结肠癌患者,但对于临床病理特征高风险的II期结肠癌患者仍考虑辅助化疗,因此如何准确定义“高风险”人群十分关键。术后循环肿瘤DNA(ctDNA)阳性人群通常无复发生存率较低,反之患者复发风险较低。近日研究人员考察了结肠癌术后ctDNA阳性患者辅助化疗的收益。对于II期结肠癌患者,术后接受循环肿瘤DNA指导的辅助治疗可减少不必要化疗的使用,且不影响患者无复发生存率。详细见:NEJM:循环肿瘤DNA分析用于II期结肠癌患者术后治疗方案决策
(3)前列腺癌MRI 靶向活检可以降低过度诊断
我们邀请了 37,887 名 50 至 60 岁的男性接受定期前列腺特异性抗原 (PSA) 筛查。 PSA 水平为 3 ng/mL 或更高的参与者接受了前列腺磁共振成像 (MRI); 三分之一的参与者被随机分配到一个参考组,该参考组接受了系统活检以及 MRI 显示的可疑病变的靶向活检。 其余参与者被分配到实验组,仅接受 MRI 靶向活检。 主要结果是临床上无意义的前列腺癌,定义为格里森评分为 3+3。 次要结果是有临床意义的前列腺癌,定义为至少 3+4 的格里森评分。 还评估了安全性。
避免系统活检,转而采用 MRI 靶向活检,以便在 PSA 水平升高的人群中进行筛查和早期检测,从而将过度诊断的风险降低了一半,但代价是延迟了一小部分患者对中危肿瘤的检测。研究结果发表在NEJM上。
同样,当下很少在筛查背景下前列腺特异性抗原 (PSA) 检测与磁共振成像 (MRI) 相结合用于前列腺癌的检测进行评估。本文报告了采用MRI及后续联合靶向和标准活检的好处。发现与使用PSA和标准活检的传统筛查途径相比,PSA检测后进行MRI,随后结合靶向和标准活检,可能具有更高的成本效益。详细见:JAMA Oncol:采用MRI+活检进行前列腺癌筛查的成本-效果比
小结
肿瘤领域百花齐放,从治疗领域来看,多个瘤种在治疗方面都获得突破性发展;从药物类别上看,除免疫检查点抑制剂外,新型的免疫治疗药物,疫苗,都获得不少进展,另外,KRAS突变也令人瞩目。从创新的治疗方法来看,溶瘤病毒,肿瘤疫苗最能吸引关注。梅斯小编希望通过上述的回顾,帮助大家更好地展望未来!
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言