Science Advances:支持阿尔茨海默病的淀粉样蛋白假说,但建议替代治疗
2023-04-13 brainnew神内神外 网络 发表于上海
这种药物对神经元没有毒性,而且可以穿过血脑屏障,所以这对未来的药物开发是个好兆头。”
对人类脑细胞的分析提供了支持“淀粉样蛋白假说”的新证据,该假说是一种流行的观点,即阿尔茨海默病是由大脑中 β-淀粉样蛋白的积累引起的。

哥伦比亚大学欧文医学中心
3月31日消息
哥伦比亚大学的研究人员发现,淀粉样蛋白引发了大脑神经元中两种蛋白质之间的联盟(蛋白质对),这种蛋白质对与已知在疾病中发生的大约一半的基因变化有关,触发了 tau 蛋白的快速积累,而 tau 蛋白积累是疾病中神经变性的主要驱动因素。研究结果近日发表在《科学进展》(Science Advances)杂志上。

研究于2023年3月3日发表在《Science Advances》(最影响因子:14.957)杂志上
该研究的资深作者 Ulrich Hengst 博士说:“这对蛋白质似乎对疾病非常重要,因为它似乎在大脑中没有其他功能,所以它是一个新的治疗靶点。” Ulrich Hengst 博士是哥伦比亚大学(Columbia University)医学院(Taub 阿尔茨海默病和大脑老化研究所)的病理学和细胞生物学的副教授。

要点:
-
淀粉样蛋白触发神经元内两种蛋白质的结合
-
这对蛋白质可以解释阿尔茨海默病中 50% 的基因表达变化
-
干扰蛋白质对可防止神经元变性
-
已经存在一种能部分逆转蛋白质对作用的药物
蛋白质对隐藏在以前的研究中
研究人员在寻找蛋白质时发现了这对蛋白质,这些蛋白质会引发阿尔茨海默病期间脑细胞中发生的数百种基因表达变化。“我们的想法是,如果我们能够干扰蛋白质对并阻止这些变化,我们就可以预防这种疾病,” Hengst 实验室的副研究员 Cláudio Gouveia Roque 博士说,他是这项研究的负责人。

研究人员没有寻找单独起作用的蛋白质,而是寻找成对的一起起作用的不同蛋白质。
“我们知道这种类型的蛋白质必然成对起作用,但之前的阿尔茨海默病研究并没有寻找特定的蛋白质对。因此,我们对阿尔茨海默病进展背后的变化的理解是支离破碎和不完整的,” Hengst 说,“正因为如此,我们很可能错过了治疗机会。”

淀粉样蛋白导致蛋白质粘在一起
Hengst 和 Gouveia Roque 以及 Hengst 实验室之前的副研究员 Jimena Baleriola 进行的搜索发现了两种蛋白质(ATF4 和 CREB3L2),它们之间的结合是由淀粉样蛋白触发的,它们一起作用于阿尔茨海默病期间脑细胞中大约 50% 的基因表达变化。
一旦形成,CREB3L2-ATF4 蛋白质对会激活其他蛋白质网络,导致致命的 tau 沉积物在神经元内积聚。这对蛋白质还使清除神经元中旧的和有害蛋白质的细胞机制失效,这是阿尔茨海默病的另一个标志。

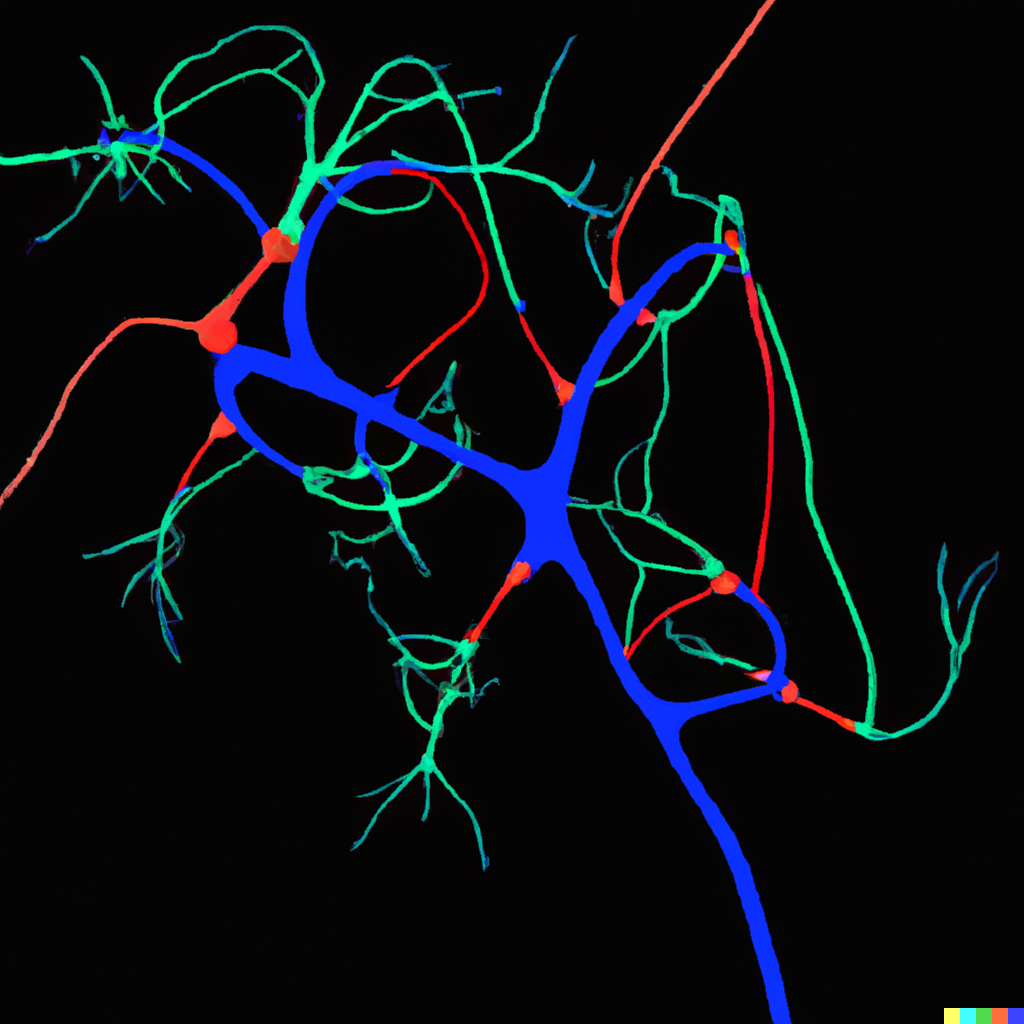
不同神经元内的 CREB3L2-ATF4 蛋白质对(红色)
研究人员发现,虽然 CREB3L2 和 ATF4 也单独存在于健康的神经元中,但在存在类似过度淀粉样蛋白的应激时,它们的结合会大大增加。
“这两种蛋白质就像两个十几岁的男孩儿,” Hengst 说,“单独来看,他们可能是相对无害的。但如果你把他们放在一起,而房间里没有一个负责任的成年人,他们很可能不会做好事。”

新的治疗方法
研究结果表明,可以通过干扰 CREB3L2-ATF4 对来治疗阿尔茨海默病。
“通常,控制基因活性的蛋白质是很差的药物靶点,因为它们控制了太多的基因。但通过靶向这一对蛋白质,我们可能能够保留两个单独蛋白质的功能,同时防止它们结合在一起的不良影响,” Hengst 说。
Hengst 和 Gouveia Roque 已经发现了一种药物多韦替尼(Dovitinib,多靶点酪氨酸激酶抑制剂),它可以干扰蛋白质对的作用。Dovitinib 已被 FDA 批准用于治疗肾癌,但尚未测试其用于治疗阿尔茨海默病。Hengst 说:“尽管如此,这种药物对神经元没有毒性,而且可以穿过血脑屏障,所以这对未来的药物开发是个好兆头。”
Gouveia Roque 补充说:“我们不是在谈论用这种方法消除淀粉样蛋白。如果我们能干扰蛋白质对,我们就能减缓甚至阻止疾病的进展。是的,大脑中仍然会有淀粉样蛋白,但神经元对它的反应会小得多。人们可以假设,这种药物可以与减少淀粉样蛋白的药物联合使用,从而产生更大的效果。”


创立于1754年的哥伦比亚大学
Source:Columbia University
Alzheimer’s: New Study Supports Amyloid Hypothesis But Suggests Alternative Treatment
Reference:
Gouveia Roque C, Chung KM, McCurdy EP, Jagannathan R, Randolph LK, Herline-Killian K, Baleriola J, Hengst U. CREB3L2-ATF4 heterodimerization defines a transcriptional hub of Alzheimer's disease gene expression linked to neuropathology. Sci Adv. 2023 Mar 3;9(9):eadd2671. doi: 10.1126/sciadv.add2671. Epub 2023 Mar 3. PMID: 36867706; PMCID: PMC9984184.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







👍
73
好
74