5岁女童罹患重症脑炎,谁是幕后黑手?
2022-10-27 罗晶晶,张佳等 四川大学华西第二医院 “检验医学”公众号
本文报道1例以长时间头痛起病就诊的5岁女性儿童患者,初期诊断为皮炎外瓶霉神经系统感染,后经全外显子测序确诊为遗传性CARD9缺乏症,旨在提高临床医生对本病的认识,同时提高微生物室人员对少见菌的了解。
前言
遗传性CARD9(caspaserecruitment domain-containing protein 9)缺乏症是一种常染色体隐性遗传的原发性免疫缺陷病,该疾病患者由于免疫缺陷极易合并深部皮肤真菌感染。皮炎外瓶霉(Exophialadermatitidis,E.d)是一种皮肤癣菌[1],属于暗色的双相型真菌[2],在自然环境和人类生活环境中广泛分布,在正常人群中较少致病,但是在免疫力受损人群中,易引起系统性暗色丝孢霉病感染,累及中枢神经系统后预后较差[2,4],死亡率可高达80%。
本文报道1例以长时间头痛起病就诊的5岁女性儿童患者,初期诊断为皮炎外瓶霉神经系统感染,后经全外显子测序确诊为遗传性CARD9缺乏症,旨在提高临床医生对本病的认识,同时提高微生物室人员对少见菌的了解,减少误诊和漏诊。
案例经过
一般资料:患儿,女性,5岁11月,因“反复头痛4+月,加重1+月”入院,入院前5天,监测体温有短暂发热,波动于37.5~38.5℃,外院颅脑增强核磁共振示:右侧基底节区、丘脑区、枕叶及双侧小脑半球多发异常信号,以右侧枕叶为重,考虑炎性脱髓鞘病变可能性大,倾向于血管炎或急性播散性脑脊髓炎。为进一步明确原因,门诊以“颅内病变原因待诊”收入我院儿童神经内科治疗。患者平素体健,无疾病家族史和既往手术史。
检查:患儿入院时偶诉头痛,精神、食欲尚可,无头晕、吐泻、抽搐、意识障碍及肢体活动障碍,大小便未见异常。入院查体:体温36.6℃,心率86次/分,呼吸21次/分,血压90/58mmHg。神志清楚,步态正常,心肺腹部查体无特殊;四肢肌力、肌张力正常,共济运动阴性,病理征、脑膜刺激征阴性。入院辅助检查:血常规示嗜酸性粒细胞百分比0.1%~15%,嗜酸性粒细胞绝对值0.01~1.27×109/L,余正常;自身抗体示抗核抗体1:1000,抗组蛋白抗体146(+),其余抗体均阴性。常规脑电图示右枕、后颞叶区慢波频繁发放。临床考虑自身免疫性脑炎可能性大,行腰椎穿刺完善脑脊液检查。脑脊液细胞学示有核细胞125×106/L,脑脊液生化:蛋白674.5mg/L,糖2.48mmol/L,需警惕颅内感染。
入院后5天,患儿有低热,体温37.5~38.5℃,仍有阵发性头痛。MRI脑肿瘤多模态增强扫描示右侧颞顶叶、右侧基底节及右侧丘脑病变,考虑炎症可能性大。第一次脑脊液病原体宏基因检测结果回示置信等级为A的微生物片段有:温和气单胞菌;置信等级为B的微生物片段有:普利茅斯沙雷菌、少动鞘氨醇单胞菌、洋葱伯克霍尔德菌、鲍曼不动杆菌、表皮葡萄球菌;大肠埃希菌。同时复查自身抗体示抗核抗体(+,1:1000),抗组蛋白抗体97.9(+),抗线粒体抗体M2型26.6(+),抗Ro~52抗体89.7(+),抗SS~A(Ro)抗体68.8(+)。考虑该患儿颅内感染伴自身免疫性脑炎可能,外送自身免疫性脑炎+副肿瘤综合征相关抗体+中枢神经系统脱髓鞘相关抗体+寡克隆IgG检测均未见明显异常。
入院后18天,检验科报脑脊液危急值:脑脊液培养查见酵母样真菌,鉴定结果为皮炎外瓶霉,真菌G试验:1-3-β-D葡聚糖333pg/ml。由于患儿病程长,目前存在皮炎外瓶霉感染,需警惕免疫功能缺陷,送全基因外显子检查,结果显示CARD9基因有1个纯合突变。
脑脊液培养标本采用美国BD公司全自动血培养系统BACTECFX和仪器配套儿童血培养瓶进行检测。脑脊液培养报阳后,革兰氏染色显微镜下可见椭圆形真菌孢子(放大倍率10*100)见图1,阳性标本采用沙保弱培养基进行传代培养,沙保弱培养基购自安图生物科技有限公司,培养基上的菌落形态见图2,对菌落进行荧光染色并在光学显微镜下观察见图3,对菌落进行棉兰染色并在光学显微镜下观察见图4。菌落鉴定采用VITEKMS全自动微生物质谱检测系统(法国生物梅里埃),鉴定结果为Exophialadermatitidis,鉴定结果可信度为99.9%,采用VITEK2COMPACT系统(法国生物梅里埃)系统和YST鉴定卡进行菌种鉴定,显示鉴定准确度低,需要附加试验进行验证。采用天地人生物科技有限公司TDRFUNGUS药敏试剂条进行药敏试验,结果见表1。
入院后36天,再次查脑脊液培养和脑脊液宏基因均报告检出皮炎外瓶霉。该患儿最终诊断为:1.重症脑炎:皮炎外瓶霉感染;2.遗传性CARD9缺乏症。

图1 皮炎外瓶霉,脑脊液培养报阳后,革兰氏染色,光学显微镜10×100
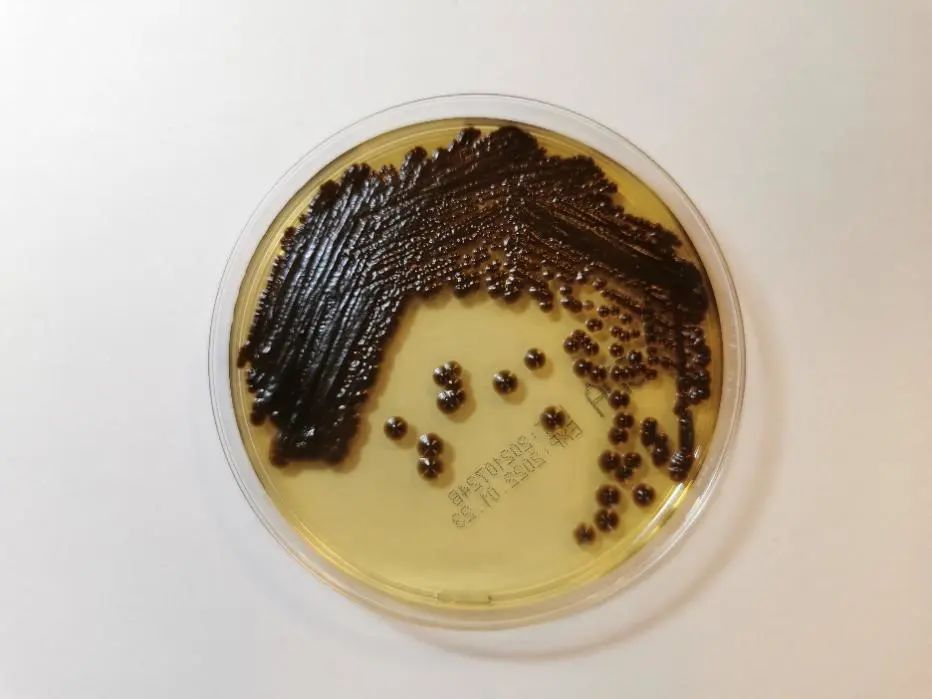
图2皮炎外瓶霉,沙保弱培养基,35℃48小时
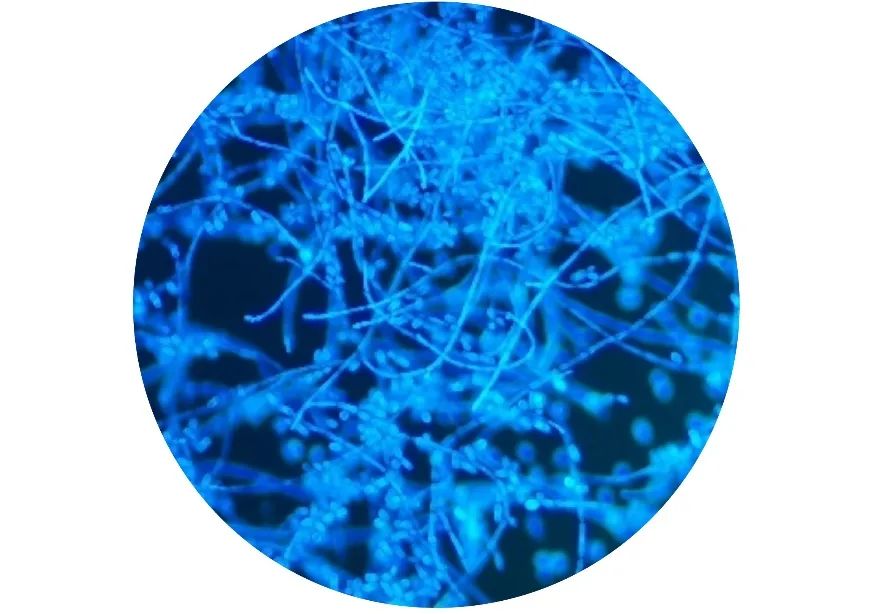
图3 皮炎外瓶霉,真菌荧光染色,荧光显微镜10×100倍
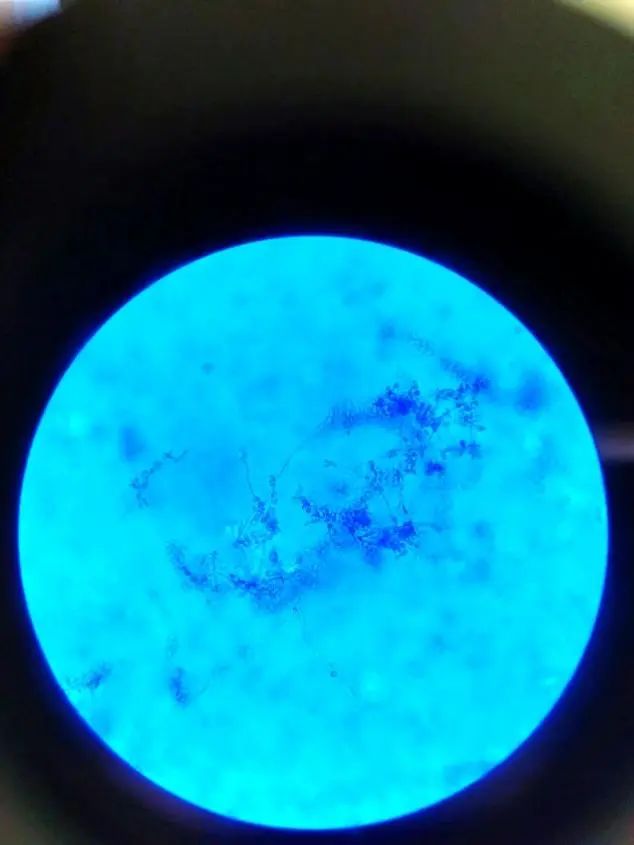
图4 皮炎外瓶霉,棉兰染色,光学显微镜10×40倍
治疗:检验科报脑脊液真菌鉴定结果为皮炎外瓶霉,由于皮炎外瓶霉目前无折点,根据体外药敏试验判断对伏立康唑和两性霉素的MIC值较低。用伏立康唑(200mg×6片,200mg,口服Q12h)抗真菌治疗。
入院后20天,患儿出现惊厥发作,表现为双眼球稍向上凝视、呼之无应答,持续时间约10多分钟后缓解,缓解后患儿精神差、不能对答,双瞳孔对光反射迟钝,颈抵抗,四肢肌张力较高,氧饱和度维持欠佳,故转转儿童重症监护室继续治疗。入PICU后,结合患儿合并急性肾损伤Ⅱ期,予两性霉素B脂质体(10mg/瓶,10mgivgtt Qd)、伏立康唑(0.1g/支,0.1givgtt Q12h)、氟胞嘧啶(0.5g×50片,0.5g管喂Q6h)三联用药抗真菌。
入院后34天,在持续监测肝肾功能的情况下,两性霉素B脂质体剂量逐渐上调至60mgivgtt Qd,患儿仍昏迷状态,反复发热,脑脊液有核细胞高达520×106/L,糖最低0.06mmol/L复查头部核磁共振提示脑部病变范围进行性扩大,提示目前抗真菌治疗效果欠佳,故调整抗真菌治疗方案,停伏立康唑,予泊沙康唑18~24mg/kg.dtid,两性霉素B调整为鞘内注射,首剂0.05~0.1mg,以后逐渐加量至0.5~1mg,每周2~3次、5-氟胞嘧啶使用继续同前。
治疗结果、随访及转归:继续抗真菌治疗8个月,期间行“OMAYA囊植入术”,定期引流,患儿持续昏迷状态且反复发热,真菌G试验波动于232~259pg/ml,并在入院后10个月出现呼吸衰竭,最终患儿家属放弃治疗自动出院。
案例分析
临床案例分析
皮炎外瓶霉中枢神经系统感染如何治疗?
无论来源(环境或临床和分离株类型(侵入性或粘膜性),其抗真菌活性均无显着差异。据报道,伏立康唑和泊沙康唑等三唑类抗真菌药对皮炎外瓶霉抗感染作用可能是比较有效的;泊沙康唑可用于治疗皮炎外瓶霉所致的肺囊性纤维化,并且已经证明泊沙康唑与两性霉素B联合治疗更有效[2]。欧洲临床微生物与感染性疾病学会(ESCMID)联合欧洲医学真菌学联盟(ECMM)联合临床指南中推荐伏利康唑和泊沙康唑治疗皮炎外瓶霉中枢神经系统浸润性感染,考虑伏立康唑脑组织渗透性好。当手术不可行时,三唑类和氟胞嘧啶的联合治疗可能是一线治疗[14]。因氟胞嘧啶单药治疗易产生耐药,临床上常与两性霉素B联用,虽然两性霉素B及其脂质体中枢神经系统渗透性较低,但当存在中枢神经系统真菌感染时,两性霉素B和氟胞嘧啶的结合也是一种有效的治疗中枢神经系统真菌感染的方法,并且在体外对皮炎外瓶霉分离株表现出高度协同作用[15]。
本例患儿先后予伏立康唑、泊沙康唑联合两性霉素B脂质体、氟胞嘧啶三联用药抗真菌治疗,效果仍差,分析原因可能与患儿CARD9基因变异相关。研究认为CARD9缺乏患者可能表现出血脑屏障处的单核细胞、巨噬细胞和/或小胶质细胞对真菌的清除功能受损。另一方面,CARD9缺陷细胞被证明需要通过血清进行真菌调理以有效杀死真菌,而血浆蛋白进入中枢神经系统的有限性可能是CARD9缺陷患者中枢神经系统真菌杀死功能受损的原因[16]。累及中枢神经系统的皮炎外瓶霉感染预后差,感染呈慢性进展性,目前报道仅几例,且仅在亚洲报道了死亡病例,具体机制尚不清楚,可能与不平等的暴露于真菌和参与不同(免疫)宿主因素相关。
检验案例分析
对于侵袭性真菌感染,真菌培养仍然是感染性疾病诊断的金标准。
该病例患儿因“反复头痛4个多月”入院,一直没找到病因,直到入院后18天,检验科报脑脊液危急值:脑脊液培养查见酵母样真菌,鉴定结果为皮炎外瓶霉。加上真菌G试验:1-3-β-D葡聚糖333pg/ml,这才明确了该患儿为皮炎外瓶霉感染所致脑炎。
真菌培养等病原学检查方法是目前临床确诊皮炎外瓶霉感染的主要技术手段。由于皮炎外瓶霉体外培养生长较慢,在培养过程中易被曲霉等生长较快的真菌掩盖,常导致临床漏诊,早期诊断较为困难,推荐延长实验室培养时间并尽量选择沙保弱培养基等特殊培养基,以有效提高临床微生物学实验室对皮炎外瓶霉的检出率[2,15]。分子鉴定技术尤其是DNA测序是临床真菌实验室鉴定皮炎外瓶霉感染的重要依据,基于ITS序列的系统发育分析可以较好地将外瓶霉属内的菌株鉴定至种的水平[4,16-17]。另外,本病例显示MALDI~TOF也是一种值得推荐的鉴定方法。
该患儿存在CARD9基因缺失,该基因缺失导致患儿对真菌易感
本病例中的患儿由于病程长,且对罕见菌易感,所以我们外送了全基因外显子检查,发现该患儿存在原发性免疫缺陷,即遗传性CARD9缺乏。这是一种常染色体隐性遗传疾病,该蛋白的缺乏患者极易合并深部皮肤真菌感染,Lanternier,Fanny和Pathan,Saad等人[1]关于深部皮肤癣菌病和遗传性CARD9缺乏症的相关性研究显示,被研究的17例深部皮肤真菌病患者均存在常染色体隐性CARD9缺陷。本病例中的患儿存在遗传性CARD9缺乏的同时,合并了皮炎外瓶霉的中枢系统感染,符合该免疫缺陷病的临床特征。
为什么第一次病原学宏基因组检测未检出皮炎外瓶霉?
宏基因组测序以无需纯化培养、能够快速全面地展示序列信息的优势,逐步在临床上受到重视。但是这个病例为什么没有检测出来呢?我们认为有可能是以下3个原因:1、真菌细胞壁厚,提取DNA破壁困难,导致假阴性;2、标本存放不当,导致核酸降解;3、菌量太少所以没有检测出来该真菌。所以我们在追逐新的检测方法的时候,一定不能忘记传统经典的检测手段,病原菌培养依然是感染性疾病诊断的金标准。
知识拓展
皮炎外瓶霉是一种菌体为暗色的双相型真菌[2],以往曾被命名为王氏外瓶霉(Wangielladermatitidis),目前在分类学上被归于子囊菌门(Ascomycota)、盘菌亚门(Pezizomycotina)、虎耳草科(Herpotrichiellaceae)、外瓶霉属(Exophiala)。皮炎外瓶霉在自然环境中广泛分布于潮湿、腐烂的泥土、植物等腐生物中;近年来也有从洗碗机、桑拿浴室等人类生活环境中分离到的报道[3]。
皮炎外瓶霉是一种机会性致病真菌,主要侵犯器官移植、长期使用糖皮质激素等免疫受损的人群,引起暗色丝孢霉病,部分病例可引起系统性感染,累及中枢神经系统后预后较差[2,4]。
皮炎外瓶霉最早于1937年分离自一名日本女性患者的面部皮疹[5]。既往认为其主要发生于日本、中国为主的东亚地区,但近年来相关病例报道在全球范围内呈上升趋势,尤其以欧洲和北美为主,提示该菌并非一种地域性病原真菌。目前,皮炎外瓶霉在自然环境中的生态龛位分布特征还不清楚,有研究认为可能存在于热带雨林的树木腐生物中[2]。一般认为,皮肤等浅表组织的感染可能与外伤后菌体种植有关,而系统感染可能由孢子通过呼吸道吸入进入血液循环后感染导致[2]。另外,肠道及周围组织感染的报道近年来也逐渐增多,提示饮食摄入也是可能的传播途径之一[6]。
已发表的病例报道主要位于北美、欧洲及东亚地区,肺部是最常报道的受累器官(27.90%),但不同地域的病例常见感染部位存在差异[6]。笔者查阅已发表的皮炎外瓶霉相关病例报道,8例[7-14]中枢神经系统感染病例全部来自亚洲地区,皮炎外瓶霉这种嗜中枢神经性表现在我国表现尤为突出,其病死率甚至高达80%。这种临床表现及预后的差异可能与不同地域皮炎外瓶霉菌株的毒力及当地临床诊治水平的差异有关。
真菌培养等病原学检查方法是目前临床确诊皮炎外瓶霉感染的主要技术手段。由于皮炎外瓶霉体外培养生长较慢,在培养过程中易被曲霉等生长较快的真菌掩盖,常导致临床漏诊,早期诊断较为困难,推荐延长实验室培养时间并尽量选择沙保弱培养基等特殊培养基,以有效提高临床微生物学实验室对皮炎外瓶霉的检出率[2,15]。分子鉴定技术尤其是DNA测序是临床真菌实验室鉴定皮炎外瓶霉感染的重要依据,基于ITS序列的系统发育分析可以较好地将外瓶霉属内的菌株鉴定至种的水平[4,16-17]。另外,本病例显示MALDI-TOF也是一种值得推荐的鉴定方法。
皮炎外瓶霉感染性疾病的抗真菌治疗方案较为多样。一般认为,如果皮炎外瓶霉感染部位较局限且具备手术指征,手术切除病灶后再行抗真菌治疗可改善预后。对皮炎外瓶霉导致的侵袭性感染尤其是血流播散性感染,系统性应用抗真菌药物是主要的治疗手段[18]。但即使经过了正规的抗真菌治疗,皮炎外瓶霉感染依然具有较高的死亡率(37.70%)。
皮炎外瓶霉好发于免疫缺陷病人,致死率高,治疗难度大,因此相关菌株的药敏监测和分子流行病学研究需要尽快加强,否则不利于提高皮炎外瓶霉感染的临床诊治水平。
案例总结
该患儿为5岁女性,因“反复头痛4+月,体温升高5天”入院。入院后脑脊液培养检出皮炎外瓶霉,经全基因外显子检查发现患儿为遗传性CARD9基因缺乏。皮炎外瓶霉是一种机会性致病真菌,主要侵犯器官移植、长期使用糖皮质激素等免疫受损的人群,引起暗色丝孢霉病,部分病例可引起系统性感染,累及中枢神经系统后预后较差。CARD9基因编码的胱天蛋白酶募集域蛋9是一种重要的衔接蛋白。其在真菌、细菌、病毒等感染中主要介导炎症反应和早期固有免疫应答发挥抗感染免疫作用。因此当CARD9基因缺陷时免疫反应遭到抑制,机体易受到真菌感染侵袭。
本病例具有非特异性临床表现、导致我们早期诊断困难,而该病病情进展迅速、病死率极高的特点,也加大了治疗的难度。对于这个病例的诊疗我们获得了一些经验:1、传统的方法依然经典给力,普通培养仍然是感染性疾病诊断的经标准;2、对于罕见菌感染,我们应该追根溯源。比如此病例我们找到了罪魁祸首:遗传性CARD9基因缺乏。3、建立有效的临床和实验室沟通,多次多学科讨论、临床与实验室密切协作更能更好的找准病因。我们也反省了不足之处:1、目前对少见真菌的鉴定和认识程度还不够;2、我们应该辩证看待新检测方法,传统的培养技术不能丢,新的分子诊断技术如宏基因组测序技术等都应该运用好并发挥的恰到好处,这样才能更好助力临床的诊断。
专家点评
甘靖,四川大学华西第二医院小儿神经科副主任
中枢神经系统真菌感染起病常隐匿,表现为慢性或亚急性过程,临床表现并无特异性,但颅内压增高随病情进展更为突出。此外,病情常呈波动性,有时仅对症处理后,也会出现病情缓解的假象,但这种改善往往只能短期维持。中枢神经系统真菌感染颅内病灶的数目和形态不定,主要取决于机体免疫抑制的程度和感染途径明确。诊断后足量使用抗真菌药物,是治愈中枢神经系统真菌感染的重要手段,目前主要抗真菌治疗药物包括:多烯类(两性霉素B制剂)、三唑类(伏立康唑、伊沙康唑、伊曲康唑、泊沙康唑)、棘白菌素(卡泊芬净、米卡芬净、阿尼洛芬)和氟胞嘧啶。以上药物在脑脊液中的分布完全不同:氟康唑、氟胞嘧啶、伏立康唑中枢神经系统渗透性高;两性霉素B及其脂质体中枢神经系统渗透性较低,但仍可在脑脊液中测及,并且在脑膜炎时有效,且当存在不能耐受两性霉素剂量或治疗无效或肾功能不全时,推荐使用两性霉素脂质体。另外,对于有明确手术指针的患者推荐外科手术治疗,术后继续早期、足量、足够疗程、联合用药抗真菌治疗,残留和复发的中枢神经系统真菌肉芽肿需要长期治疗。
顽固性颅内高压是导致真菌性脑膜炎患者死亡和发生各种并发症的一个重要原因,长期药物降颅压效果欠佳,多需脑脊液引流降压,可以重复行腰椎穿刺术缓慢引流脑脊液;但对于短期内频繁腰椎穿刺不能控制脑脊液压力者,择需采用脑脊液外引流术。对于难治性颅内压增高患者,Ommaya囊植入引流是一种更方便、安全的操作,患者痛苦少且无脑疝发生,同样需要注意避免继发感染。如果经充分抗真菌治疗且其他控制颅内压方法无效时,若条件允许,则建议尽早给予脑室分流术。
皮炎外瓶霉中枢神经系统感染诊断困难,且易误诊,但皮炎外瓶霉与其他真菌感染导致的中枢神经系统病变亦有共同之处,常表现为发热、头痛、呕吐、惊厥、意识障碍及局部神经系统体征等表现,头颅影像可表现为颅内增殖性病变。皮炎外瓶霉所致的中枢神经系统感染的头颅影像表现多种多样,脑脊液可出现糖的降低及蛋白的升高,但真菌G实验可有异常的发现,这些表现在本例患儿中均有相应体现,但最终确诊仍有赖于真菌培养,故建议如有条件及在病情允许的情况下可进行反复多次的培养以期获得阳性的结果。此外,本病尚无明确的治疗标准,研究提示联合两性霉素B及其脂质体,5-氟胞嘧啶及伊曲康唑或伏立康唑有一定的疗效,但累及中枢神经系统感染者预后差。
参考文献
Fanny L, Saad P, Quentin B, et al. Deep Dermatophytosis and Inherited CARD9 Deficiency[J]. The new england journal o f medicine, 2013, 369(18):1704-1714.
Kirchhoff L, Olsowski M, Rath PM , et al. Exophiala dermatitidis: Key issues of an opportunistic fungal pathogen[J]. Virulence, 2019, 10(1):984-998..
Zupani J, Babi MN, Zalar P, et al. The Black Yeast Exophiala dermatitidis and Other Selected Opportunistic Human Fungal Pathogens Spread from Dishwashers to Kitchens[J]. PLoS ONE, 2016, 11(2):e0148166.
Seyedmousavi S, Netea MG, Mouton JW, et al. Black yeasts and their filamentous relatives: Principles of pathogenesis and host defense[J]. Clinical microbiology reviews, 2014, 27(3):527, 27(3):527-42.
Hohl PE, Holley HP, Jr, et al. Infections Due to Wangiella dermatitidis in Humans: Report of the First Documented Case from the United States and a Review of the Literature[J]. Clin Infect Dis, 1983, 5(5):854-64.
王芳, 穆超, 赵静雅, 等. 临床皮炎外瓶霉荧光定量PCR检测方法的建立[J]. 中国真菌学杂志, 2013, 008(006):321-324.
Wang C, H Xing, Jiang X, et al. Cerebral Phaeohyphomycosis Caused by Exophiala dermatitidis in a Chinese CARD9-Deficient Patient: A Case Report and Literature Review[J]. Frontiers in Neurology, 2019, 10:938-45.
Sood S, Vaid V, Sharma M, et al. Cerebral phaeohyphomycosis by Exophiala dermatitidis.[J]. Indian Journal of Medical Microbiology, 2014, 32(2):188-190.
Chang CL, Kim DS, Dong JP, et al. Acute Cerebral Phaeohyphomycosis due to Wangiella dermatitidis Accompanied by Cerebrospinal Fluid Eosinophilia[J]. Journal of Clinical Microbiology, 2000, 38(5):1965-1966.
Nadya A, Mehboob A, Kenneth H, et al. Brain Abscess Caused by Wangiella dermatitidis: Case Report[J]. Clinical Infectious Diseases, 1996(1):197-198.
Raclavsky V, Novotny R. Burkholderia cepacia selective agar can be useful for recovery of Exophiala dermatitidis from sputum samples of cystic fibrosis patients.[J]. Journal of Cystic Fibrosis Official Journal of the European Cystic Fibrosis Society, 2016, 113(2):221-2.
Silva WC, Gon Alves SS, Santos D , et al. Species diversity, antifungal susceptibility and phenotypic and genotypic characterisation of Exophiala spp. infecting patients in different medical centres in Brazil[J]. Mycoses, 2017, 60(5):328-337.
Kaplan, Engin, Hoog D, et al. Comparison of the rolling circle amplification and ligase-dependent reaction methods for the identification of opportunistic Exophiala species[J]. MedMycol, 201, 56(6):759-769.
Chowdhary A, Meis JF, Guarro J, et al. ESCMID and ECMM joint clinical guidelines for the diagnosis and management of systemic phaeohyphomycosis: diseases caused by black fungi[J]. Clinical Microbiology & Infection, 2014, 20(s3):47-75.
Deng S, Pan W, Liao W, et al. Combination of amphotericin B and flucytosine against neurotropic species of melanized fungi causing primary cerebral Pphaeohyphomycosis. Antimicrob Agents Chemother.2016;60:2346–2351.
Corvilain E, Casanova JL, Puel A. Inherited CARD9 Deficiency: Invasive Disease Caused by Ascomycete Fungi in Previously Healthy Children and Adults. J Clin Immunol. 2018, 38(6):656-693.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







