【Nat Cancer】把控CAR-T细胞疗法的长期并发症:感染和第二肿瘤
2024-12-26 聊聊血液 聊聊血液 发表于陕西省
《Nature Cancer》近日发表文章,讨论了CAR-T细胞疗法长期并发症的临床挑战。
CAR-T
嵌合抗原受体(CAR)-T细胞已经彻底改变了血液系统恶性肿瘤的治疗,但也存在感染和继发恶性肿瘤的长期安全问题。《Nature Cancer》近日发表文章,讨论了CAR-T细胞疗法长期并发症的临床挑战。

CAR-T是血液肿瘤治疗中的游戏规则改变者,其疗效得到关键临床试验的证实,并广泛应用于临床实践。最初对不良反应的关注主要集中在急性特异性毒性,如细胞因子释放综合征或免疫效应细胞相关神经毒性综合征。在开发出对这些毒性的有效管理后,可以认为CAR-T是安全的,然而最近的分析和病例报告也强调了CAR-T细胞治疗应答者中显著的发病率和死亡率,主要为感染和继发恶性肿瘤(包括T细胞恶性肿瘤)。
在一项纳入7604例接受CAR-T细胞治疗的淋巴瘤和多发性骨髓瘤患者的系统评价和荟萃分析中,总体非复发死亡率(NRM)为6.8%,且不同疾病之间存在显著差异。此外在LBCL患者中,与基于4-1BB相比,在接受CD28共刺激CAR治疗的患者中观察到更高的NRM风险;而既往治疗线数和强度对NRM没有影响。在BCMA CAR-T细胞疗法中,ciltacabtagene autoleucel的NRM高于idecabtagene autopeuel(15.2% vs 6.3%)。NRM的主要原因为感染,与疾病或CAR-T细胞产品无关。虽然这些致命感染中有半数是由COVID-19感染引起(随着全球卫生紧急情况得到控制,这些感染现在应该大幅减少),但细菌和真菌也各占感染相关死亡的20%。尽管无法直接对比,但这些数字与自体造血干细胞移植后观察到的数字相似或略高,包括大B细胞淋巴瘤(1年NRM为4.4%)或多发性骨髓瘤(2年NRM为2.5%)。当直接比较完全缓解时接受auto-HSCT或CAR-T治疗的LBCL患者时,NRM并无显著差异。
感染和NRM的发生率在研究和患者群体中并不均匀,并且与CAR-T细胞治疗后的血液毒性相关。EBMT推荐的免疫效应细胞相关血液毒性(ICAHT)的新分级与1年NRM率密切相关(重度ICAHT患者为14%,而非重度ICAHT患者为4.5%),且NRM的主要原因为感染。此外,CAR-HEMATOTOX评分可以预测血液毒性和重度感染的风险,该评分是根据与造血储备相关的标志物(包括绝对中性粒细胞计数、血红蛋白和血小板计数)和基线炎症(如CRP和铁蛋白水平)计算。CAR-HEMATOTOX评分较低的患者大多出现轻度或中度感染,而评分较高的患者出现长时间中性粒细胞减少、入住ICU和严重感染的风险较高。该评分可用于指导CAR-T细胞治疗后的抗感染预防。只有在得分高的患者中,使用抗生素预防才能显著降低细菌感染的发生率;此外危及生命或致命的真菌感染仅发生在CAR-HEMATOTOX评分高的患者中。总的来说,感染是CAR-T细胞治疗后的主要问题,而使用预测评分调整预防措施和定期监测免疫重建可能有助于减少严重感染的发生率。
CAR-T细胞在免疫功能受损中的确切作用仍是重要的考虑因素。由于既往治疗,许多患者在使用CAR-T细胞之前仍免疫功能低下。此外,CAR-T细胞治疗前的造血储备(通过CAR-HEMATOTOX评分测量)是CAR-T后血细胞减少的重要危险因素。在治疗早期使用CAR-T细胞可以减少多种化疗对骨髓的累积压力,从而潜在地降低ICAHT的风险。炎症也有重要作用,在CAR-T细胞治疗前减少肿瘤负荷可能有助于减轻CAR-T细胞治疗前和后的炎症以及相关并发症(图1)。
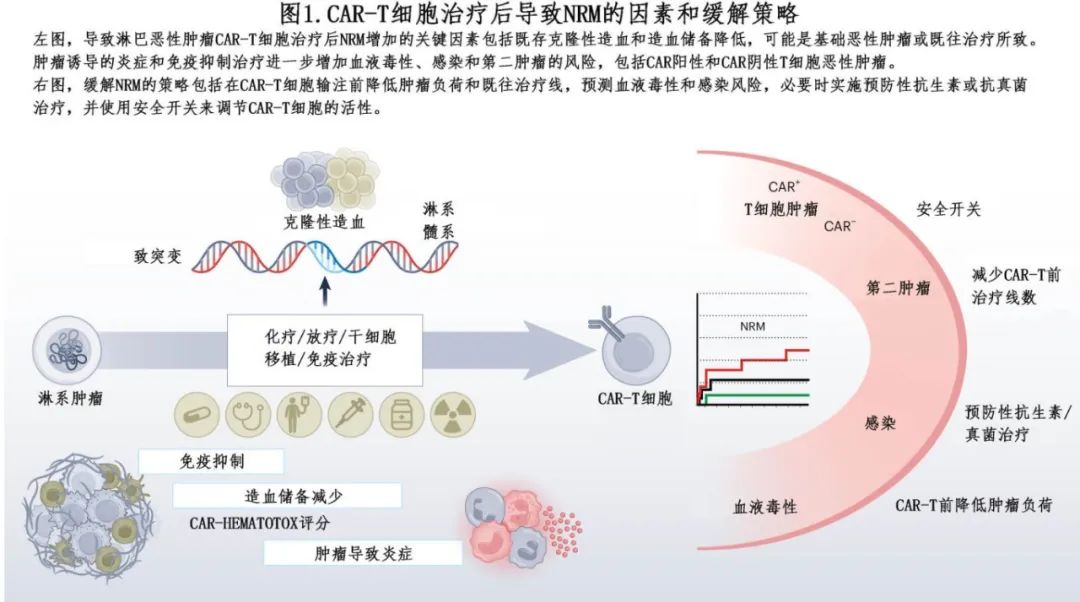
在前文讨论的荟萃分析中,NRM的第二个原因为第二肿瘤,主要为骨髓增生异常综合征(MDS)和/或急性髓性白血病(AML)(33.3%),其次为癌(carcinoma,22.2%)。CAR-T细胞可以诱导明显的炎症,可能是克隆性造血的驱动因素。然而在接受CAR-T治疗之前,患者通常经历了多次化疗,在许多情况下还进行了自体造血干细胞移植。这些疗法是继发恶性肿瘤的已知危险因素,包括治疗相关MDS和AML(图1)。据报道,CAR-T细胞输注前克隆性造血的患病率高达56%,但与CAR-T细胞治疗后长期血细胞减少的风险增加无关。CAR-T细胞在多大程度上促进继发恶性肿瘤的发展,这个问题仍具有挑战性。一项纳入5517例患者的荟萃分析证实,CAR-T细胞治疗后第二原恶性肿瘤的风险随着既往治疗的数量而增加;CAR-T细胞组和标准治疗组之间第二原发恶性肿瘤的发生率在四项可获得数据的随机临床试验中均相似。更长的随访时间和在既往治疗较少的患者中使用CAR-T细胞将为因果关系的存在提供有价值的见解。将CAR-T细胞治疗后长期幸存者的长期肿瘤发病率和总生存率与其他方式治疗的匹配人群进行比较,将有助于评估继发恶性肿瘤实际增加的风险。
CAR-T引起的恶性肿瘤的风险提出了一个独特的挑战。尽管上述荟萃分析中很少有与T细胞恶性肿瘤相关的死亡报告,但CAR-T细胞治疗后也出现几例T细胞恶性肿瘤。然而到目前为止,CAR插入部位与T细胞恶性肿瘤的发展之间还没有直接的因果关系。美国FDA在2024年报告了22例T细胞恶性肿瘤后发出警告,其中包括3例患者在恶性克隆中检测到CAR转基因。事实上,B细胞淋巴瘤患者发生T细胞淋巴瘤的风险本身就会增加,在某些情况下,在CAR-T细胞输注之前就可以检测到单克隆T细胞群。一例EBV+大B细胞淋巴瘤患者在接受axicabtagene ciloleucel治疗后发生EBV+ T细胞淋巴瘤,也说明了这种风险增加背后的一些机制,淋巴瘤是在治疗银屑病和嗜酸性筋膜炎的几种药物引起免疫抑制的情况下发生的。详细评估后排除了恶性 T 细胞中 CAR 插入相关突变,但确定由突变型 DNMT3A 和 TET2 驱动的淋巴克隆造血作用是 B 细胞和 T 细胞恶性肿瘤的根本原因,免疫抑制和 EBV 感染进一步促进两种恶性肿瘤的发展。
然而,尽管极其罕见,但CAR阳性克隆也可能是T细胞淋巴瘤的起源,正如新英格兰医学杂志近期报道的一例胃肠道惰性T细胞淋巴瘤,在ciltacabtagene autoleucel治疗多发性骨髓瘤4个月后起源于细胞毒性CD4+ CAR-T细胞。肿瘤活检显示出克隆性和高水平的CAR-RNA,进一步的外周血分析发现相同的循环克隆,约占T细胞库的10%。值得注意的是,8年前在该患者中检测到少量T细胞克隆,但克隆序列对比显示出不同的克隆性;但并无输注产品可用来确定克隆是否存在于输注的CAR-T细胞产品中。口服环磷酰胺治疗后内窥镜显示改善,但患者仍需肠外营养,表明生活质量仍有显著影响。
在2023年美国ASH年会上报道了另一例ciltacabtagene autoleucel治疗后发生的双阴性(CD4−CD8−)CAR阳性T细胞淋巴瘤,涉及皮肤和淋巴结。尽管CAR-T细胞群最初遵循经典动力学特征(即在第14天达到峰值,然后降低),但在T细胞淋巴瘤诊断前后观察到显著的再扩增,其水平超过最初的峰值。T细胞受体(TCR)测序确定输注产品中已经存在克隆,尽管频率较低。患者化疗后完全缓解但早期复发,后续异基因造血干细胞移植后也早期复发。
CAR-T细胞插入部位发生恶性转化的可能性也一直是病毒和非病毒CAR-T细胞疗法关注的问题,尽管尚未有病例报道。有一个报道中,克隆CAR-T细胞扩增与单等位基因CAR插入T细胞克隆的TET2位点有关,该T细胞克隆也携带一个次形的第二等位基因;该患者完全缓解,无恶性转化。在另一个报道中,CAR插入原癌基因CBL位点也导致克隆扩增而没有恶性转化。在前述多发性骨髓瘤ciltacabtagene autoleucel治疗后的胃肠道惰性T细胞淋巴瘤病例中,CAR插入到SSU72的第二个内含子中,SSU72是一种参与CD4-T细胞炎症和调节功能之间稳态平衡的基因。未观察到SSU72 mRNA表达或剪接的明显改变,表明CAR的基因破坏不太可能是癌症发展的原因,但也不能排除对SSU72蛋白功能的影响。在ciltacabtagene autoleucel第二个病例中检测到显性插入到PBX2的3 '非翻译区,但肿瘤活检的全外显子测序发现2年前收集的骨髓样本中未检测到的杂合TET2突变。此外该患者携带胚系杂合JAK3变异,该变异与抗原诱导的T细胞淋巴瘤有关。这些因素是否导致T细胞淋巴瘤的发生尚不清楚。重要的是,在一项使用piggyBac转座子系统的临床试验中报道了两例CAR-T细胞治疗来源的淋巴瘤,具有高转基因拷贝数,表明多个基因的破坏可能会带来风险。由此可见,CAR基因插入引起的插入突变目前尚未见报道。
总的来说,CAR-T细胞疗法的收益-风险平衡在很大程度上仍是有利的。尽管大剂量化疗和造血干细胞移植与许多短期和长期毒性有关,但CAR-T细胞似乎仍是获得治愈且毒性有限的最佳机会。CAR-T治疗后的许多并发症可能至少部分归因于既往治疗(图1)。尽管如此,了解和监测CAR-T相关风险仍至关重要。临床试验和登记组应系统地报告不良事件,如感染、继发恶性肿瘤和非复发死亡率。预测性评分(类似于HSCT中使用的评分)可以帮助临床医生为患者选择最佳治疗方案。CAR-T细胞疗法可能更适合年轻患者,他们通常能够更好地耐受其相关的毒性,而老年或衰弱患者可能受益于其他免疫治疗方案,这些方案具有较低的危及生命的副作用风险。对接受CAR-T细胞治疗的患者进行长期随访,包括那些在ZUMA-23 (评估一线axicabtagene ciloleucel与标准免疫化疗在高危疾病患者中的有效性)等试验中的患者,将有助于区分CAR-T细胞的真正毒性与既往治疗的残留效应。
尽管CAR阳性T细胞淋巴瘤在目前的商业化产品中极为罕见,但最近的观察结果也强调需要系统地报告所有第二恶性肿瘤,并在血液肿瘤病例中彻底研究CAR的表达/插入。此外,虽然进一步的基因修饰有望增强CAR-T细胞的功能,但应该谨慎对待。为了提高患者的安全性,安全开关可以整合到CAR-T细胞疗法中。例如CAR与截断EGFR共表达,其可以使用治疗性单克隆EGFR抗体(如西妥昔单抗)进行靶向和消除。这种策略能够选择性地去除克隆性、潜在的恶性CAR-T细胞扩增。另外,安全开关可以通过共表达诱导性caspase系统来激活CAR工程细胞中的细胞死亡(图1)。
CAR-T细胞疗法持续为血液肿瘤患者提供变革性的潜力,具有可控的风险和有希望的长期益处。随着研究的进步和安全措施的改进,这种疗法带来挽救生命的效果的能力只会越来越强。持续的监测加上个性化的治疗方法,将确保CAR-T细胞对更广泛的患者来说仍是一个强大且越来越安全的选择。
参考文献
Grégoire, C., Melenhorst, J.J. Navigating CAR-T cell therapy long-term complications. Nat Cancer (2024). https://doi.org/10.1038/s43018-024-00867-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#并发症# #Car-T细胞疗法#
24