JCI:肿瘤微环境对肿瘤转移的影响:FBXW7蛋白新功能被发现
2015-01-05 MedSci MedSci原创
宿主微环境中缺失FBXW7可促进肿瘤转移 肿瘤发生转移是导致肿瘤患者死亡的重要原因。而且肿瘤转移的原因复杂,发生机制尚未明确。目前肿瘤与宿主微环境之间的相互作用与关系成为了研究的热点之一。骨髓来源的细胞(BMDCs)包括了T细胞、B细胞、巨噬细胞等,它们在促进肿瘤发生、发展、侵袭、转移、血管生成中发挥了重要作用。 F-box蛋白家族成员之一FBXW7是一种泛素连接酶,是c-MYC、NOTC
宿主微环境中缺失FBXW7可促进肿瘤转移
肿瘤发生转移是导致肿瘤患者死亡的重要原因。而且肿瘤转移的原因复杂,发生机制尚未明确。目前肿瘤与宿主微环境之间的相互作用与关系成为了研究的热点之一。骨髓来源的细胞(BMDCs)包括了T细胞、B细胞、巨噬细胞等,它们在促进肿瘤发生、发展、侵袭、转移、血管生成中发挥了重要作用。
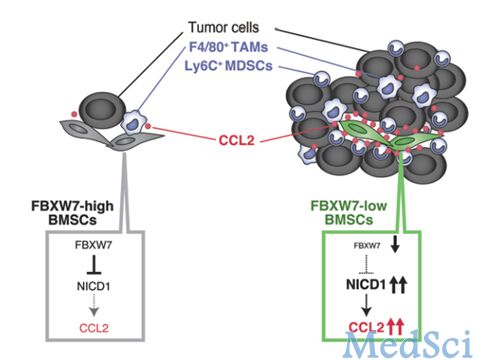
F-box蛋白家族成员之一FBXW7是一种泛素连接酶,是c-MYC、NOTCH、cyclin E、c-JUN、KLF5等重要转录因子的识别受体之一,因此它被认为是一种抑癌分子。它的编码基因在大多人类肿瘤中发生突变。多数前人的研究都将目光聚集在了FBXW7如何在肿瘤细胞中发挥抑癌作用,本研究另辟蹊径,在宿主微环境中验证了FBXW7抑制肿瘤转移的能力。该研究结果发表于2015年1月4日的The Journal of Clinical Investigation杂志。
研究人员在鼠源骨髓间充质干细胞中敲除Fbxw7,发现可以诱导NOTCH的积累并随后转录活化Ccl2。FBXW7缺陷小鼠表现出了血清趋化因子CCL2水平的上升,并导致了单核细胞髓源性抑制细胞和巨噬细胞在肿瘤位点的募集,以上是促进肿瘤转移的重要因素。对FBXW7缺陷小鼠给予CCL2受体拮抗剂可以阻断肿瘤转移的上升。此外,芯片结果显示,在乳腺癌的患者中,外周血的FBXW7与血清CCL2水平和疾病预后水平相关。
以上结果综合表明,FBXW7不仅能够通过细胞自主方式,还能够通过一种非细胞自发性方式(即对肿瘤微环境的作用)抑制肿瘤发展。同时,FBXW7/NOTCH/CCL2通路的调节可能成为抑制肿瘤转移的潜在靶点。
原始出处
Kanae Yumimoto1, Sayuri Akiyoshi2, Hiroki Ueo2, Yasuaki Sagara3, Ichiro Onoyama1, Hiroaki Ueo4, Shinji Ohno5, Masaki Mori6, Koshi Mimori2 and Keiichi I. Nakayama1.F-box protein FBXW7 inhibits cancer metastasis in a non-cell-autonomous manner.JCI.2014
本文是MedSci原创,转载请注明出处,非常感谢!
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#JCI#
0
#新功能#
102
#FBXW7#
75
#肿瘤转移#
96