单抗III期临床试验失败案例及原因分析
2020-10-11 抗体圈 抗体圈
新药研发的失败率很高,据统计,肿瘤和非肿瘤药物从I期到II期的成功率分别为62.8%和63.5%;II期到III期分别为24.6%和34.3%;III期到NDA/BLA为40.1%和63.7%;NDA
新药研发的失败率很高,据统计,肿瘤和非肿瘤药物从I期到II期的成功率分别为62.8%和63.5%;II期到III期分别为24.6%和34.3%;III期到NDA/BLA为40.1%和63.7%;NDA/BLA到批准为82.4%和85.9%,I期到批准为5.1%和11.9%。临床试验的每一个阶段都存在失败的风险,从II期到III期的失败率最高,而肿瘤药物的失败率高于非肿瘤。药物临床研发需要验证几个因素,正确的靶点,正确的药物,正确的人群和正确的剂量。药物临床试验前疾病生物学是否已经研究深入,已经清晰?药物是否作用于靶点?Right target but wrong drug? 是否选择错误的人群入组?剂量过高或过低?任何一个方面的不足或缺陷都可能增加临床试验失败的风险。
以两个单抗的临床试验为例,一个是肿瘤领域礼来公司的血小板衍生生长因子受体a (PDGFR)抗体-Olaratumab,失败的主要原因为III期研究缺乏疗效;另一个是非肿瘤领域辉瑞公司的PCSK-9单抗,失败的主要原因是产生过多的抗药抗体和中和抗体,影响其长期的疗效和安全性。Olaratumab是一种人源化IgG1单克隆抗体,能够以高亲和力选择性的结合血小板衍生生长因子受体a(PDGFRa)。PDGFR/PDGFRa信号传导对间质细胞生长、血管生成和伤口愈合等具有重要作用。肉瘤是间叶细胞来源的恶性肿瘤,PDGFRa可过度表达。发生转移的软组织肉瘤患者预后差,致死率高,生存时间为1年左右。多柔比星是四十年来的标准治疗,但疗效十分有限,RR为10-30%, PFS为2-5个月,OS为12个月左右。研究表明,Olaratumab可以通过阻断PDGF与PDGRFR结合,直接抑制肉瘤细胞的生长,还可以抑制肿瘤血管生成。临床前研究对PDGFR这个靶点进行了验证,Olartatumab可以抑制PDGF诱导的WS-1成纤维细胞增殖, 抑制该受体介导的AKT和MAPK信号的传导及肉瘤细胞生长。Ib/II期临床研究入住133例受试者,在软组织肉瘤显示突出疗效:OS长达26.5个月,比多柔比星延长11.8个月;PFS为6个月,而多柔比星为4.1个月;ORR为18%, 多柔比星12%;DOR8.3个月,多柔比星8.2个月。见下图表。基于II期结果,美国和欧盟批准它上市。FDA授予它快速通道认定,孤儿药认定,突破性治疗认定,优先审评认定。而EMA授予它加速审评认定,孤儿药认定。完全批准将基于III期临床研究结果。而NMPA在2018年5月的Pre-NDA会议上,礼来申请基于境外数据有条件批准上市。NMPA同意申请人的申请。同时考虑软组织肉瘤病理类型的多样性,II期临床样本量小,申请人仍需要承诺上市后研究;全球III期临床研究JGDJ正在进行,NMPA希望申请人在上市申请审评过程中获得该III期研究的结果。最后,II期研究亚组分析显示未能延长脂肪肉瘤患者的OS,未来可能根据III期数据考虑限制其适应症。
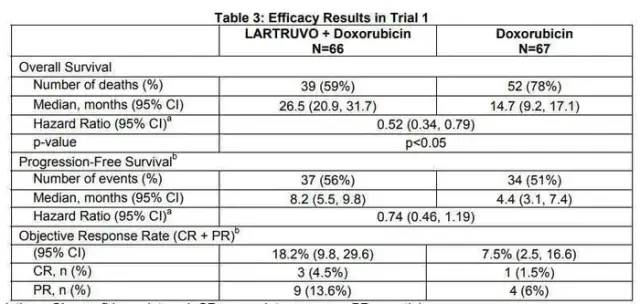
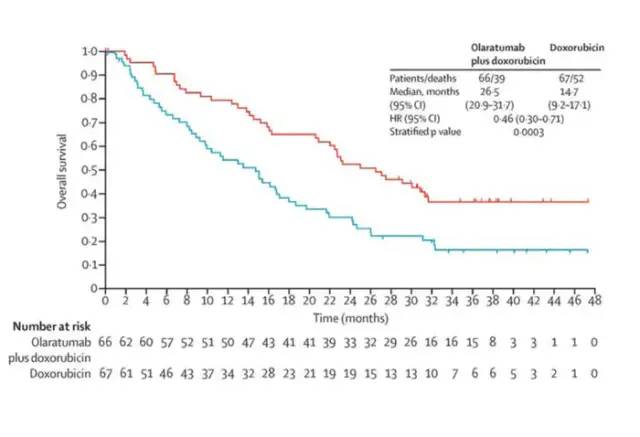

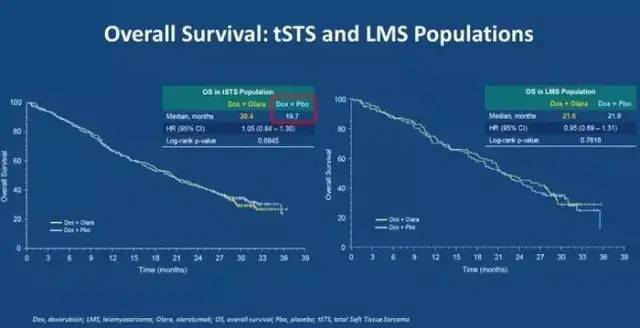
失败的原因何在?分析如下:1)II期和III期研究设计和实施上存在差别。II期为开放设计,无安慰剂对照;而III期为双盲安慰剂对照;首要终点前者为PFS,后者为OS;前者无预设的亚组分析,而后者了STS和LMS的结局;前者为美国10个中心的研究,后者为110个中心的国际研究;前者无负荷剂量,后者的负荷剂量为20mg/m2等。2)软组织瘤是高度异质性的疾病,各种病理类型在发生部位,比如平滑肌纤维,脂肪组织,筋膜,淋巴和血管等多种组织,有的比较惰性的,而有的反应性比较高,转化细胞类型和组织病理学特征等方面具有鲜明的异质性。II期和III期入组的患者在病理亚型上存在区别。选择的亚型过多,有的有10多例,有的只有1到2例,这也是导致疗效不同的原因;3)Olaratumab联合协同作用机制不清晰,它与多柔比星联合,也许对于某些亚型有作用,但是对于其他亚型也许没有作用;4)多柔比星为基础的化疗药物,或者说作为对照,它的作用也可能有提高 5)作用机制和生物标记物尚未得到验证。真实世界的数据也显示疗效并不理想。以有限的数据以获得优先审评,是存在风险的。这就是它撤市的原因。
Olaratumab的主要失败原因是缺乏疗效,而另一个案例,辉瑞的PCSK-9单抗Bococizumab,则是由于在III期临床中出现过多的ADA和Nab,长期疗效受到影响,而注射部位不良反应也较竞品多,尽管6个III期临床都满足临床首要终点,但是辉瑞仍决定终止它。PCSK9抑制剂是一类单抗药物,靶标是一种名为前蛋白转化酶枯草溶菌素9(PCSK9)的蛋白,该蛋白可降低肝脏从血液中清除低密度脂蛋白胆固醇(LDL-C)的能力,而LDL-C被公认为心血管疾病(CVD)的主要风险因子。PCSK9抑制剂提供了一种全新的治疗模式来对抗LDL-C,被视为他汀类(如Lipitor和Zocor)之后降脂领域取得的最大进步。免疫原性是治疗性蛋白或多肽对自身或相关蛋白产生的免疫应答,或诱导免疫相关不良事件的倾向。一般会使用抗药抗体或中和抗体去评估。几乎所有生物药都会产生抗药抗体,或多或少,但不一定影响疗效和安全性。但患者免疫应答的临床效果是高度可变的,有些对患者健康完全没有影响,有些会造成极其有害的影响。中和抗体是指由B淋巴细胞产生的,能识别抗原特异性部位而使抗原失去活性,抑制其功能的抗体。Bococizumab是97%人源化单抗,3%为鼠源,位于与PCSK-9结合的互补决定区(complementarity determining region,CDR)。综合Bococizumab的6个III期SPIRE研究共入组4300例使用bococizumab 150mg Q2W 患者的疗效,安全性和免疫原性数据,并根据治疗期间是否产生了ADA进行分层分析。研究结果显示,48%的受试者在治疗1年产生ADA,大部分在12周后产生,其中29%产生了中和抗体。随着时间的推移,低密度脂蛋白胆固醇(LDL-C)降低的减弱,12周时LDL-C下降为50%,52周变为40%。并且产生了更高的注射部位反应(12.7% vs 安慰剂组1.6%)。
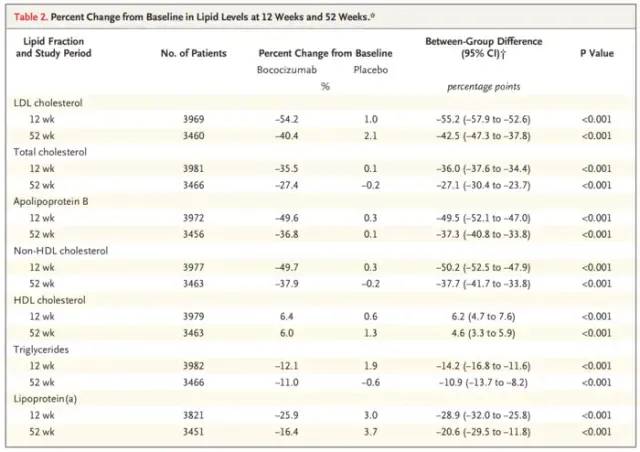
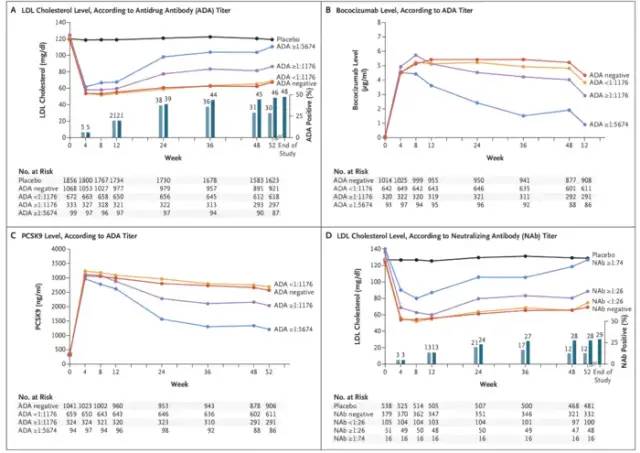
市场方面,安进和Regeneron已有的两个新上市的PCSK-9单抗,作为第三个上市的同类药物Bococizumab必须有明显优势才有市场前景,但是,除免疫原性,它每两周给药1次也不具优势,竞品是每月给药1次。作为后来者,几乎没有任何优势而言,终止是最优选择。不过,这个终止来得过迟,6项III期床(包括CVOT研究),一共入组了大约27000人,耗时耗力耗钱。问题是为何到多个III期都结束后才发现抗体的问题?是否忽视了它的严重性?为何不能早发现,早终止?
研究临床试验失败有很多原因,包括难以避免的,以及通过严格的科学把控可以避免的失败。1. 由于缺乏足够的科学进展或证据而导致的失败是难以避免的,其中包括:1)缺乏可预测的临床前体内和体外有关安全性的转化医学模型,特别是在肝脏毒性和神经毒性方面。2)缺乏可预测的临床前体内和体外有效性模型,特别是在神经科学和肿瘤(实体瘤)方面。3)对于疾病复杂的病因没有充分的了解。举个例子,阿尔茨海默病,beta-淀粉样斑块以及Tau蛋白被认为与阿尔茨海默病相关。尽管Bapineuzumab等的III期临床研究显示可以降低beta-淀粉样斑块,但是未能改善临床结局。因此,beta-淀粉样斑块增加和神经纤维缠结可能不是认知功能下降的原因,而只是与其相关。再比如心血管疾病的研究药物胆固醇酯转运蛋白抑制剂(CETP)在临床II期和III期研究中发现其可以增加HDL,但是未能改善心血管结局,因此,HDL降低并不是高脂血症的主要原因。这些被认为与疾病相关的生物标志物,都未能预测临床结局。2. 通过严格的,原则性的科学层面把控,是可以避免的失败。这包括:1)III期临床的候选药物的剂量以及受试者选择不佳。由II期临床中受试者剂量暴露与临床反应的关系没有充分建立,在III期临床中由于剂量不足或过高而导致失败;由于III期临床的患者群选择不当,只有部分受试者有效,从而稀释了药物的有效性,如Olaratumab;缺乏为III期临床研究选择正确人群以及研究设计的基于模型的荟萃分析和临床试验模拟;2)由于在II期临床研究过程中对照组的样本量不足,导致假阳性结果,因此在III期研究中结果没能复制。这包括,II期临床研究的样本量较小,特别是在研究终点较为主观的,安慰剂的作用较大的疾病,比如抑郁, 系统性红斑狼疮(SLE)以及风湿性关节炎(RA);3)在II期临床研究中过度的依赖未验证的替代终点或生物标志物终点,从而无法预测III期研究的结局。4)对异常的有效性和安全性数据分析不充分。比如辉瑞的PCSK9单抗,尽管Fab段的CDR区与PCSK-9结合的部位有3%的序列是鼠源,但对I期和II期的抗体生成的信号没有充分的分析,迅速并机会同时开展了六个III期。产品本身有缺陷,即使有强大的销售能力,也无法使产品在临床中得到认可。肝脏毒性是后期临床研究失败的重要原因。目前的方法是检测ALT,AST和胆红素水平。但是这些肝酶水平的增加不足以预示肝脏毒性。如TAK-875-GPR-40激动剂,在303例的II期临床研究中,只有1例受试者出现肝酶异常,但是III期临床研究对肝脏毒性使用Hy’s法则来评估,发现了严重的肝脏毒性,从而导致开发终止。
减少III期临床试验的风险,有时候是可能的,但有时候是无法避免的。我们可以做的是减少或最小化那些可以避免的错误。需深入的了解研究资料,靶点,临床前数据,早期数据和安全性等。合理的开展I期和II期临床研究,客观的分析所获得的数据,SMART的设计,选择合适的病人,剂量,首要终点,关注安全性包括免疫原性。此外,高效高质量的开展临床试验也可以降低失败的风险。
参考资料:
1. Lancet. 2016 July 30; 388(10043): 488–497.
2. Olaratumab phase III study. ASCO 2019
3. N Engl J Med . 2017 Apr 20;376(16):1517-1526.
4. 陈晓媛2020年同写意《临床试验失败案例》
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#I期临床#
0
#III#
59
#I期临床试验#
54
#II期临床试验#
66
#II期临床#
63
#III期临床试验#
51
#III期#
46