脱机与否:以患者为中心的实用呼吸机脱机指南
2023-06-03 陈艺清 重症医学 发表于上海
作为重症监护医生,当我们处理这个问题时:脱机与否,请让我们的病人成为我们最好的向导。
引言/历史
脱机是一项复杂的干预措施,需要重症监护专家的关注和专业知识。70年前,Ibsen博士在哥本哈根小儿麻痹症流行期间引入了革命性的正压通气技术,挽救了无数人的生命[1,2]。1955年,Carl-GunnarEngström博士推出了第一台定容呼吸机。1961年,HenrikBendixin和HenningPontoppidan博士在马萨诸塞州总医院建立了第一个呼吸重症监护室(ICU),并进行了呼吸机脱机的研究[4]。到 1977年,HenningShubin和Weil使用食道球囊导管对呼吸功进行了详细的测量。在20世纪70年代,同步间歇指令通气(SIMV)成为大多数ICU的首选脱机模式。在应用SIMV之前,脱机技术包括每30分钟将患者与呼吸机断开3-4分钟,并确定他们对突然中断的耐受性。在20世纪80年代,病人与呼吸机相互作用的研究表明SIMV作为一种脱机模式的局限性。到了20世纪90年代中期,重症医学家们开始比较各种脱机机械通气的模式。
定义和分类
脱机被定义为呼吸衰竭的根本原因正在改善的病人逐渐减少呼吸支持,应该被认为是一个连续的过程[6,7]。最初,患者需要充分的呼吸支持来控制急性呼吸衰竭。此后,PaO2/FiO2比值的恢复、较低的FiO2要求和较低的呼吸机设置可能表明开始进行脱机准备的评估。必须满足各种临床和客观的准备评估标准[8]。病人在规定的时间内进行自主呼吸试验(SBT)时,要进行脱机预测因素的测量。拔管成功的定义是拔管后48小时内没有呼吸支持。相反,拔管失败的定义是无法通过SBT或拔管后48小时内需要重新插管。
脱机可分为简单的、困难的或长时间的。简单脱机与较高的成功率(30-60%)和较低的死亡率(5- 10%)有关。这一组的主要目标是尽快确定准备脱机,并确保有系统地停止使用呼吸机[8]。 在困难脱机中,病人需要多达三次SBT或长达七天的时间才能脱机。对于难以脱机的病人,一个主要目标是识别和解决SBT 失败的可逆原因。最后,当病人超过三次SBT失败或需要超过7天才能从机械通气中解放出来时,就会发生长时间的脱机。综合来看,困难和延长脱机组与较低的成功率(15-40%)和较高的死亡率(10-30%)有关[7,9]。对于长期脱机的病人,预防措施如鼓励早期自主呼吸、控制好使用镇静剂和早期动员可能有帮助。
脱机失败的病理生理学
|
表一、脱机失败的病理生理学 |
|
|
脱机失败的原因 |
干预措施 |
|
呼吸道和肺功能障碍 |
吸入支气管扩张剂 |
|
吸气闭合 |
|
|
计算内源性peep |
|
|
SBT期间的诊断性支气管镜检查 |
|
|
利尿剂 |
|
|
胸腔穿刺术 |
|
|
衰竭性心功能障碍 |
SBT期间行ECG检查 |
|
SBT前后进行超声心动图检查 |
|
|
床边心脏POCUS |
|
|
后负荷减少策略 |
|
|
认知功能障碍 |
谵妄筛查工具 |
|
定向能力 |
|
|
早期活动 |
|
|
减少睡眠时的噪音/光线刺激 |
|
|
行为疗法 |
|
|
抗焦虑药物 |
|
|
内分泌代谢功能障碍 |
电解质和血气分析监测 |
|
血浆皮质醇和甲状腺素水平监测 |
|
|
膈肌功能障碍 |
早期活动 |
|
膈肌EMG |
|
|
胃和食管球囊导管经膈肌加压 |
|
|
膈肌活检 |
|
|
营养 |
间接量热卡 |
为了解决脱机失败的可逆性原因,可以用简单的结构化方法对脱机失败的病理生理学进行系统回顾(表1)。脱机失败可能取决于几个因素,而且往往是由一个以上的原因造成的。无论导致需要中压的潜在疾病是什么,最常见的机制通常是呼吸肌的发力能力与中压停止后必须面对的负荷之间的失衡。
ECG=心电图、peep=呼气末正压、SBT=自主呼吸试验、POCUS=床边即时超声、EMG=肌电图。
气道和肺功能障碍
气道和肺功能障碍可以通过增加气道阻力的疾病和减少顺应性的疾病的棱镜来广泛看待。 导致上气道阻力的原因有气管导管的存在,气管损伤,如气管狭窄,气管瘤,肉芽组织形成, 以及小气道疾病,如哮喘和慢性阻塞性肺病(COPD)。事实上,机械通气5.5天以上的病人在拔管后的呼吸工作量增加,这可能是上气道水肿的结果。在一项对SBT失败的COPD患者的研究中,气道阻力明显增加(9士2 cmH2O到15+2 cmH2O;P<0.05),而成功断气的患者,气道阻力保持不变。PEEPi的形成可能是由于流动阻力的增加、呼气流量的限制、高呼吸频率和肺部弹性反冲力的丧失。PEEPi导致的肺部过度膨胀使膈肌在长度-张力曲线上处于次佳位置,影响了产生负压的能力。PEEPi与病人-呼吸机的不同步有关,特别是与无效的触发有关(图1)。
导致顺应性降低的原因包括:肺水肿、胸腔积液、腹水、腹压升高、肥胖、肺炎、肺间质疾病(ILD)和肺水肿[10]。呼吸系统的顺应性(Cs)取决于PEEP和高原压力(Pplat),并按以下方式计算。Vt/(Pplat- PEEPtotal)。非插管患者的正常静态肺顺应性为200ML/cmH2O,需要机械通气的患者为60ML/cmH2O或更低。

图1.呼吸机无效触发:气道压力和流量波形。
柔性支气管镜检查是诊断评估上气道阻力潜在原因的金标准,如气管损伤、气管造口术错位、气管瘤和浓稠的呼吸道分泌物。无创通气和气管内支架等干预措施可用于缓解阻力。[17, 18] 。此外,对于小气道疾病患者,应用的PEEP应与呼气闭塞技术估计的PEEPi水平一致。常规使用支气管扩张剂可以减少支气管收缩。利尿剂可以减轻肺部和胸壁水肿,[20,21]而胸腔穿刺和腹腔穿刺可以分别解决胸腔积液和腹水[11, 13,22] ,并有助于改善腹腔积液,从而提高依从性并促进脱机。
喉部水肿与插管时间过长有关。并诱发拔管后的声嘶力竭,从而增加了重新插管的风险。袖带泄漏测试可作为喉部水肿的替代指标,并指导对患者进行拔管或继续机械通气的关键决定。最近的一项荟萃分析和系统综述指出,袖带泄漏测试在预测拔管后气道梗阻方面具有很好的针对性和适度的敏感性。拔管后呼吸困难最突出的风险因素包括创伤性插管、插管时间超过6天、气管导管过大、女性、以及意外拔管后再次插管[23]。 袖带泄漏试验是拔管决策中的一个有用工具,但其低敏感性表明,阴性试验不能完全排除拔管后气道梗阻,仍需密切
监测拔管后患者。
此外,全身性的类固醇治疗可以降低再插管率和拔管后喘息(PES)率[23]。ATS/ACCP临床实践指南建议对符合拔管标准并被认为是PES高风险的机械通气成人进行袖带漏气试验,并建议对袖带漏气试验失败但已准备好拔管的成人,应在拔管前至少4小时给予全身类固醇。[11, 18,23-25]
在独特的原发性呼吸系统疾病方面,如慢性阻塞性肺病、囊性纤维化。肥胖通气不足综合征、神经肌肉疾病和容易出现慢性高碳酸血症呼吸衰竭的小儿疾病,IMV和无创通气已经成为一种成熟的治疗选择[17]。.在试图脱机时,管理这些病人时需要考虑到特殊因素,德国呼吸学会已经提出了治疗慢性呼吸衰竭的完善算法。[17]
脱机诱发的心脏功能紊乱
研究人员使用简单的心脏床边操作来研究在脱机阶段可能有充血性心力衰竭、心肌缺血或冠状动脉疾病的通气病人。有许多关于心功能不全和脱机引起的左心室(LV)功能障碍的机制建议(图2)。[21] 胸内压明显下降、肾上腺素能的激活、低氧血症、高碳酸血症和呼吸功的增加是脱机不成功的重要后果,最终可能导致左心室舒张末期压力(LVEDP)的急性升高和心源性肺水肿。[20,21,26]
怀疑由心血管因素引起的脱机失败可能会促使早期使用诊断技术来确定具体的病因。床边经胸超声心动图(TTE)和肺部超声造影可以诊断出舒张功能障碍。TTE也可以可靠地显示左心室松弛(e′波),并通过计算E/e′比值来确定左心室舒张功能障碍的等级。容量状态和心脏功能的生物标志物,主要是血清B型钠尿肽(BNP)和/或N-末端(NT)-proBNP,已被用作心脑血管功能障碍的代用标志物。[26]在SBTs期间检测到肺动脉闭塞压(PAOP)增加的患者,通常在SBTs期间混合静脉血氧饱和度大幅下降,表明心血管功能障碍对氧气输送和耗氧量增加之间的严重失衡的贡献。在SBT期间,血浆蛋白或血红蛋白浓度的急性上升(均大于5%),反映了肺水肿形成所引起的容量对比,与PAOP增加到18mmHg有关。[27,28]
对于怀疑或证实的心功能不全,有效的缓解和管理策略包括利尿剂、硝酸盐和其他血管活性药物。20,26 利尿剂可以通过减少左心室舒张末期容积(LVEDV)来减少整体容积过载。事实上,LVEDV的小幅下降将导致LVEDP的明显下降。
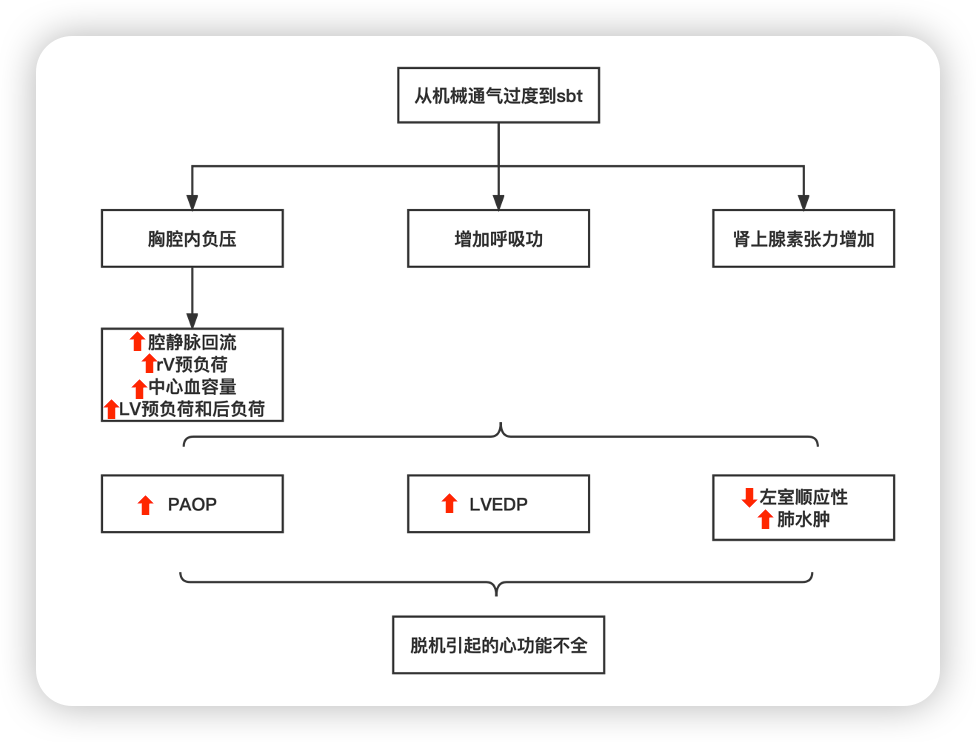
图2.SBT期间的血液动力学和心肺相互作用。
呋塞米与液体负平衡有关,机械通气持续时间较短,对左心室收缩功能障碍的患者影响更大。[27,29]硝酸盐类药物引起全身静脉扩张,导致中心血量减少,动脉血管扩张,从而降低LV后负荷,冠状动脉血管扩张,改善心肌供氧。[21,30]
钙敏感剂和ATP敏感钾通道开放剂,左西门旦和磷酸二酯酶-3抑制剂,如米力农、氨力农和依诺西蒙,在降低RV后负荷和减少RV衰竭方面具有血管扩张作用,而且它们已显示出改善LV功能导致成功脱机的证据。[20,21,26]磷酸二酯酶-5抑制剂,如西地那非,对COPD和肺动脉高压患者有疗效。[20]贝特类药物如阿替洛尔和艾司洛尔已与血管紧张素转换酶抑制剂和钙通道阻滞剂一起用于SBT期间未被掩盖的心源性肺水肿患者的亚组治疗[21]。
认知功能紊乱
谵妄、抑郁、焦虑和睡眠障碍构成了入院时间过长的ICU患者脱机失败的主要原因。[31,32] 重要的是,治疗和病人因素导致昼夜节律失调,并导致难以脱机的病人出现认知功能障碍。频繁的监测,如实验室检查、放射学研究和院内运送手术,都会导致睡眠断层。阿片类药物和苯二氮卓类药物等药物以及中枢神经系统本身也会导致睡眠结构紊乱和认知功能障碍。年龄大了,温度调节失调,合并症和某些潜在的精神疾病也会对脱机产生不利影响。[32]
膈肌功能紊乱
膈肌功能障碍的常见原因包括慢性阻塞性肺病、ICU获得性虚弱(ICUAW),如重症多发性神经病和重症多发性肌病、神经肌肉疾病,如重症肌无力症、呼吸机引起的膈肌功能
障碍和膈神经损伤。[8,33,34]
为了了解膈肌功能障碍,测量方法如最大吸气压力(MIP)、经膈肌压力(Pdi)、膈肌超声测量和膈肌肌电图(EMG)可能是有用的。[11,22,34]MIP和最大呼气压力(MEP)是
对整体呼吸肌力量的测试,可以使用连接到人工气道的手持设备进行测量。11MIP高于30cm H2O与成功拔管的时间较短有关。使用专用气球记录食管压力(Pes)和胃压力(Pga)可以计算出跨膈肌压力(ΔPdi= ΔPga- ΔPes),这是衡量膈肌收缩性的一个具体指标[13]。膈肌超声检查是一种实用和无创的评估工具。膈肌超声检查是一种实用和无创的工具,用于评估膈肌的摆动和厚度分数。膈肌厚度分数>30-36%与SBT后成功脱机的可能性增加有关。34 膈肌肌电图是膈肌神经呼吸驱动的良好指标,可以提供关于呼吸肌卸载、病人-呼吸机相互作用以及残余镇静对呼吸驱动影响的重要数据。[34]
最近,膈神经刺激装置缓解了膈神经引起的脱机失败。LungpacerDPT系统是通过一个临时的、一次性的、留置的多电极刺激导管(LIVECatheter)来电刺激病人的膈神经。有一个针对左膈肌神经的近端电极和针对右膈肌神经的远端电极。如RESCUE1 安全性和可行性试验所示,成功脱机者的MIP增加了105%(平均变化为19.7 ±17.9 cm H2O;p = 0.03),而平均快速浅呼吸指数(RSBI)提高了44% (平均变化为-63.5 ±64.4;p= 0.04)。35 在欧洲RESCUE2 随机对照试验中,MIP从基线的变化是显著的[差异15±4 cmH2O,p=0.0002];RSBI从基线的变化也是显著的[差异-30±15,p=0.049];这两个变量在临时经静脉短语神经刺激候选人中显示了刺激的剂量-反应关系。[36]
代谢和内分泌功能紊乱
低钾血症、低磷血症和低镁血症可导致脱机失败。肾上腺功能不全和甲状腺功能减退也与脱机失败有关。使用皮质类固醇和严格控制血糖可以减少脱机失败。[10, 13] 肾上腺功能不全患者拔管前补充应激剂量的皮质类固醇,可以显著提高脱离呼吸机的成功率,缩短脱机时间。[38]
胃肠道和肾脏功能紊乱
腹腔内情况和急性肾损伤(AKI)已显示出在将病人从MV中解放出来的同时,也会使结果恶化。[22,39 ] 腹腔内高血压、腹腔积气、腹腔积血、腹部创伤、胰腺炎、终末期肝病、肝脏移植都可以导致ARDS。由于压力-容积曲线向右移动,因为顺应性从膈肌的初始位置向上偏移而减少;呼吸工作量增加,通气所需的吸气压力也增加。[22 ] 此外,与没有AKI的患者相比,AKI患者不太可能脱机,而且容易出现解脱困难的情况。[39]他们也更有可能在重症监护室有更长的MV时间,在重症监护室的LOS也会增加。这些器官的功能障碍加剧了一些患者成功脱离MV的能力。
营养问题
脱机期包括两步策略,即准备好评估和SBT。为了评估准备情况,临床医生必须尽早在入院48-72小时内处理临床和客观标准。镇静假在准备情况评估中起着重要作用。导致呼吸衰竭的可逆因素(如电解质紊乱、容量超载、肺炎和其他病理生理学因素)应得到纠正。随后,应采用客观标准来进一步评估准备情况(表2)。
|
表2 准备状态评估的客观标准 |
|
1、改善呼吸衰竭的病因 |
|
2、在FiO2≤40%和PEEP≤5cmH2O的基础上,PaO2/ FiO2>150或SpO2>90%。 |
|
3、pH值>7.25 |
|
4、血流动力学稳定性(无或小剂量升压药物) |
|
5、启动吸气努力 |
|
6、血红蛋白≥7mg/dL |
|
7、核心温度 |
|
8、唤醒和警觉或容易唤醒 |
当这些标准得到满足时,就可以对病人进行预测脱机成功的参数评估。2012年,麦克马斯特大学评估了8个具有显著似然比的参数对预测呼吸机停用成功的作用(表3)。6,40尽管这些参数具有统计学上的显著性,但普遍较低的似然比表明,这些参数对个体患者的临床适用性并不重要。
|
表3、脱机时呼吸机参数的研究 |
||
|
参数 |
阈值 |
正值范围 可能性比率 |
|
呼吸机测量数值 |
||
|
VE |
10 ~15 L/min |
0.81~2.37 |
|
最大吸气负压(NIF) |
-20 ~ -30 cmH2O |
0.23~2.45 |
|
PImax |
-15 ~ -30 cmH2O |
0.98~3.01 |
|
P0.1/PImax |
0.30 |
2.14~25.3 |
|
CROP index |
13 |
1.05~19.74 |
|
SBT期间测量的参数 |
||
|
f/VT |
60~105 breaths/min/L |
0.84~4.67 |
VE=分钟通气量;PImax=最大吸气压力;P0.1=吸气开始后0.1秒口腔闭合压;CROP index=顺应性、心率、氧合和压力指数;RSBI (f/VT)=呼吸浅快指数;
在一项具有里程碑意义的研究中,RSBI< 105 与97%的成功拔管概率有关,而RSBI> 105则有64%的拔管失败概率。[41 ]然而,后续的荟萃分析显示,集合的敏感性和特异性要低得多,分别为84%和44%。此外,RSBI与临床决定断气的比较显示,不使用RSBI时,断气时间的中位数明显缩短(2.0天对3.0天,P= 0.04)。
自然呼吸试验
已经提出了各种不同类型的支持的SBT技术。压力支持通气(PSV)试验是在不切断患者与呼吸机连接的情况下,使用低水平的压力支持(PS5-8 cmH2O,PEEP ≤5cmH2O,FIO2≤0.4-0.5)。它可以补偿吸气和呼气时横跨气管导管的随流量变化的压力下降。ATC 的研究表明可以减少呼吸工作量,增加呼吸舒适度,并可以预测成功拔管[46]。ATC不是一个独立的通气模式,而是一个可以与所有常规通气模式相结合的流量比例压力支持的组成部分。
对30至120分钟的SBT的耐受性应促使人们考虑永久释放呼吸机。然而,如果病人根据特定的标准(表4)不能进行SBT,必须确定SBT失败的原因。一旦可逆的失败原因得到纠正,应每24小时重新尝试SBT,并与自发唤醒试验相匹配。在SBT失败后,患者应接受稳定的、不引起疲劳的、舒适的呼吸支持方式。
|
表4 SBT失败标准 |
|
1、呼吸频率>35次/分 |
|
2、辅助呼吸肌肉参与 |
|
3、在FiO2≤40%或者至少6L/min给氧的情况下,SpO2<92%(或在潜在慢性肺部疾病的情况下<88%) |
|
4、血流动力学不稳定,定义为HR≥140bpm或SBP≥180mmHg,有低灌注的迹象(出现紫绀或斑点) |
|
5、抑郁的精神状态或躁动 |
镇静、神经肌肉阻断、早期活动和呼吸机脱机
充分的镇静剂的目标是在机械通气期间将疼痛和焦虑降到最低,同时不影响患者的自主呼吸能力。8 常用的镇静剂包括丙泊酚、芬太尼、右美托咪定和苯二氮卓类药物。每天中断镇静剂并进行断药试验, 已被证明可以最大限度地提高病人的呼吸潜力,并减少花在MV上的时间、并发症的频率和费用。[18,24,25,47 ]2013年,ACCM/SCCM特别小组支持优先使用非苯二氮卓类镇静剂(丙泊酚或右美托咪定)而非苯二氮卓类(咪达唑仑或劳拉西泮)的镇静策略,以改善机械通气的成人ICU患者的临床结果(证据等级+2B)。[48,49]ATS/ACCP建议在急性住院通气超过24小时的病人中使用协议来尽量减少镇静。[18,24,25]
在ICU中使用神经肌肉阻断剂(NMBA)的限制之一是ICUAW的发生。在ARDS患者中,ICUAW的发生率为34%-60%。[50] 女性、多器官功能障碍(≥2)、MV的持续时间、
皮质类固醇的使用、血管收缩剂支持的时间、ICU住院时间(LOS)、高血糖、低血清白蛋白和神经衰竭都是ICUAW的独立风险因素。[51]此外,同时使用NMBA和皮质激素以及输注NMBA超过48小时有利于ICUAW的发生。[52] 然而,在最近一项关于ARDS中使用NMBA的荟萃分析中,顺丁橡胶与ICUAW的风险增加没有关系。[53]NMBA在使用时间较短且没有同时使用类固醇时,不会增加ICUAW的风险。[53]
早期动员已被证明可以减少ICUAW的发生率,改善功能能力,增加无呼吸机的天数,并减少谵妄、ICU再入院和ICU寿命。[54]在机械通气超过24小时的病人中, 已经推荐了以早期动员为目标的协议化康复。[18,24,25]ICU临床医生必须认识到早期动员的几个障碍,包括那些与病人和护理过程有关的障碍,不适当的康复医学和ICU工作人员, 以及 ICU和医疗机构的文化。[55]
脱机技术:证据是什么?
在20世纪90年代,两种类型的SBT (T-piece和PSV)几乎以相同的频率被使用。生理学研究表明,在T-piece期间测量的呼吸功与拔管后的呼吸功相似。相反,PSV试验时的呼吸功明显低于T-piece。因此,虽然PSV试验有可能加速拔管,但它也可能因为低估了拔管后所需的呼吸功而增加重新插管的风险。
一些开创性的试验已经评估了上述技术。在西班牙肺衰竭试验中,比较了四种脱机技术。SIMV、PSV、间歇性自主呼吸试验和每天一次的带T型片自主呼吸试验。在Cox比例危险模型中对基线特征进行调整后,每天一次的自主呼吸试验的成功脱机率是SIMV的2.83倍 (P< 0.006),是PSV的2.05倍(P< 0.04)。与SIMV/PSV组相比,间歇性和每天一次的试验组从开始脱机到成功拔管的时间更短。[56] 然而,在同一年,Brochard显示了截然相反的结果[44]。T型片和SIMV (8%PSV;43%T-件;42%SIMV;P= 0.05)。使用PSV时,继续使用MV的概率较低(P<0.03),而且断气时间和ICU寿命都较短(分别为P<0.05和P<0.001)。[44] 这些开创性的试验为我们目前的社会建议铺平了道路,对于通气时间超过24小时的急性住院患者,最初的SBT应该在吸气压力增加(5-8cmH2O)的情况下进行,而不是不进行(T-piece或CPAP)。[18,24,25 ] 然而,它们并没有告知如何在不成功的SBT之间对患者进行通气。[18]
在一项试验中,通过比较PSV或T型片作为断气技术,确定使用PSV的初始SBT是否可以提高拔管失败高风险患者的成功率,作者认为PSV可以加速拔管,但不会增加再插管的风险。[57] 此外,对于通气>24小时后拔管失败的高风险患者,如果成功完成了初始SBT,建议拔管为预防性无创通气(NIV)。[18,24,25]
为了增加患者保持拔管并成功从中枢神经断裂的机会,有人推测在SBT后让呼吸肌休息会防止拔管失败。然而,与直接拔管相比,在成功的SBT后重新连接到MV,并没有使MV患者重新插管的风险有统计学意义的减少(12.9%vs. 18.2%,95%CI[-2.49 to13. 12];p = 0. 18)[58]。
此外,最近的一项多中心试验调查了142个ICU的危重病人在三年内断绝和停止呼吸机的做法。[59 ]在参加研究的1868名患者中,68.7%的患者在进行SBT后存活并从MV中拔管。在SBT期间,49. 1%的人使用了低水平的PSV,25.4%的人使用了T型试验,10.8%
的人使用了CPAP。其余的患者(31.3%)没有进行呼吸试验就直接拔管。60 在美国,与其他国家相比,SBT被广泛使用。结果显示,接受SBT的患者比直接拔管的患者情况更差 (10.3%比4.7%),有创中枢神经持续时间更长(4. 1 天比2.9天),ICU寿命更长(8. 1 天比6.7天)。[60 ]所见的地区差异可能是由于筛选工具的使用、呼吸机管理和早期动员的不同。[59]
标准化的脱机协议
最初使用脱机协议是在三个随机对照试验后出现的,总共约有1000名患者。[61-63]1996年,一项针对内科和心脏重症监护室的研究表明,遵守脱机协议的组别减少了机械通气的时间,降低了成本,并减少了重新插管。[61]同样的结论在1997年得到了证实。2000年,在外科重症监护室的一部分创伤病人中,协议化断气与呼吸机相关肺炎的发生率降低有关。[63]在一项系统回顾和荟萃分析中,协议化脱机与常规护理相比,在内科、外科和混合型ICU中显示出良好的效果。然而,在大多数封闭式的ICU8,有大量的医生、呼吸治疗师和护士,并有结构化的多学科系统查房,临床上对协议指导下的脱机的价值和作用存在不同看法。[64]
结论
ICU团队必须尽早评估脱机的准备情况,减少脱机失败的风险因素。对于脱机试验失败的患者,详细的结构化方法对于试图确定潜在的原因和机制至关重要。如果这些原因是可逆的,必须及时采取纠正措施,使患者能够克服他们的临床情况,并达到足够的心肺耐受SBT的效果。对于大多数ICU来说,标准化的脱机方案是有吸引力的,也是令人信服的。在病人定制护理的时代,选择一个适合病人的脱机模式是非常重要的。最后,作为重症监护医生,当我们处理这个问题时:脱机与否,请让我们的病人成为我们最好的向导。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








脱机,拔管
77
学习了,谢谢分享
96