Nat rev Cardiol综述:心梗以及心肌重塑过程中的炎症反应
2014-05-08 iang dxy
心梗后炎症反应为心脏修复所必需,但炎症也参与心梗后心脏重塑和心衰等病理生理过程。梗死心肌内信号分子激活Toll样受体信号通路,而补体激活和活性氧产生诱导细胞因子和趋化因子表达上调,这些过程促进炎症的发生发展。本文主要阐述心梗后心肌损伤、修复和重塑中的炎症反应,并总结相关研究,展望炎症调节在心梗中的治疗价值。 前言: 70多年前,心脏病理学家发现心梗导致梗死心脏白细胞侵润,产生炎症反
心梗后炎症反应为心脏修复所必需,但炎症也参与心梗后心脏重塑和心衰等病理生理过程。梗死心肌内信号分子激活Toll样受体信号通路,而补体激活和活性氧产生诱导细胞因子和趋化因子表达上调,这些过程促进炎症的发生发展。本文主要阐述心梗后心肌损伤、修复和重塑中的炎症反应,并总结相关研究,展望炎症调节在心梗中的治疗价值。
前言:
70多年前,心脏病理学家发现心梗导致梗死心脏白细胞侵润,产生炎症反应。随后几十年的研究发现了白细胞的危害以及白细胞与梗死边界区心肌细胞之间的密切联系,这也意味着血液来源细胞亚群可以黏附存活的心肌细胞,并且可能产生毒性作用,进一步扩大缺血损伤。
20世纪80、90年代,实验研究表明心梗再灌注阶段靶向针对白细胞介导的炎症反应显著减少心梗面积,阻止缺血心肌损伤扩大。动物研究表明针对白细胞活化、黏附和渗出的靶向分子(如整合素、选择素等)可以缓解缺血损伤。
这些基础研究结果似乎给临床治疗带来了曙光,但不幸的是,研究人员未能将靶向白细胞治疗成功转化到心梗患者治疗上,临床研究也表明抗炎治疗不能减少梗死面积。
心梗后心衰与心梗后心室重塑关系错综复杂。梗死和非梗死区域结构、功能和几何形态的改变导致室腔扩大、心室变圆和心功能不全。另外,心脏重塑增加心律失常和存活患者的不良预后。
心梗后重塑程度依赖于梗死面积和修复质量。尽管炎症信号扩大缺血损伤受到质疑,但炎症通路无疑在梗死心脏扩大和纤维重塑中起着重要的作用,因此,也在心梗后心衰病理过程中 扮演者重要的角色。
本篇综述主要讨论炎症在调节梗死心脏修复和重塑中的作用以及明确治疗靶标所做的尝试。另外,随着对心脏重塑病生机制进一步的深入理解,本文试图阐述针对心梗后存活患者的抗炎治疗。
一、心梗后炎症反应:
成年心脏几乎不可再生,因此,梗死心肌愈合主要依赖瘢痕修复。梗死心肌修复可以分为三个互相交叉的时期:炎症期、增殖期和成熟期。
心肌梗死后迅速激活固有免疫产生强烈而短暂的炎症反应,清除梗死区域死亡细胞和细胞外基质碎片,随后进入增殖期。在增殖期,单核细胞和巨噬细胞亚群分泌生长因子,招募和激活间叶修复细胞(主要是肌成纤维细胞和血管细胞)。肌成纤维细胞分泌大量细胞外基质蛋白,从而保留左心室完整结构。大多数修复细胞凋亡意味着增殖期结束,胶原纤维瘢痕形成。
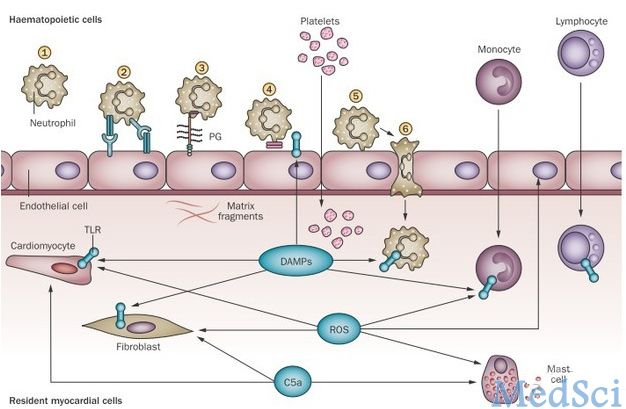
1. 坏死和固有免疫:
组织损伤产生内源性信号分子,从而激活固有免疫系统,这些信号分子属于危险相关模式分子(DAMPS)家族。高迁移率族蛋白B1 (HMGB1)就是其中一种,可能通过Toll样受体(TLR)和晚期糖基化终末产物受体(RAGE)介导心肌缺血后炎症损伤。由于危险介导信号在炎症和修复中的双重作用,HMGB1在梗死心肌中的“双刃剑”作用亦不足为奇。
另外,热休克蛋白和ATP等坏死细胞释放成分以及细胞外基质降解均可能激活梗死心脏固有免疫反应。小分子量透明质酸和纤连蛋白片段可以激活TLRs,作为促炎信号的重要启动因素。
固有免疫通过TLRs识别危险信号,而TLR家族中,TLR2和4在心梗后炎症反应中起着重要介导作用。另外,补体系统激活和活性氧(ROS)产生均在梗死心脏炎症激活中扮演着重要的角色。
2. 趋化因子和细胞因子:
危险介导信号激活诱导分子程序招募炎症细胞进入梗死修复区域。梗死心肌产生促炎趋化因子通过与相应的趋化因子受体招募白细胞亚群。促炎细胞因子(如肿瘤坏死因子、白介素-1等)上调诱导合成内皮细胞黏附分子,激活白细胞整合素,最终导致炎症细胞渗出至梗死心肌。
- 趋化因子作用
上述趋化因子作用具体机制尚不明确。系统性定义梗死心肌内侵润单核细胞亚群特性并了解介导这些细胞聚集的机制对指导治疗有着重要意义。
- 促炎细胞因子作用
例如TNF既可以促进炎症损伤也可以抑制心肌细胞凋亡,TNF通过TNF受体1和2介导的不同效应或许可以调节心梗后重塑,但是慢性心衰抗TNF治疗失败可能恰恰反映了TNF的多效性。同样如此,IL-1β促进炎症但是延迟肌成纤维细胞活化。
3. 心梗后炎症效应细胞:
梗死心肌炎症反应细胞往往发现心脏和新聚集细胞,但是,不同细胞类型相对作用尚不清楚。正常心肌巨噬细胞、肥大细胞和树突状细胞含量相对较少。心脏固有肥大细胞含有促炎细胞因子,心肌缺血损伤后可以迅速被激活,释放颗粒物质,促发炎症反应。ROS产生、腺苷和补体5a或许可以刺激肥大细胞脱颗粒。
心梗初期,白细胞(中性粒细胞和单核细胞)迅速侵润至梗死区域,循环中中性粒细胞通过趋化因子和细胞因子被招募到梗死区域,随后单核细胞侵润心肌组织, MCP-1诱导促炎单核细胞进入梗死区,有研究报道B淋巴细胞也促进促炎单核细胞进梗死区,之后修复单核细胞开始进去梗死区,但具体机制知之甚少。
促炎巨噬细胞亚群同样侵润梗死心肌,并持续发挥促炎作用。但是,心梗区侵润细胞远不止单核细胞和巨噬细胞,可能包含不同功能的细胞亚群。
成纤维细胞可能也在梗死心肌炎症反应中占有一席之地。研究表明梗死成纤维细胞可以激活炎性复合物。梗死后早期反应阶段,成纤维细胞具有促炎和降解基质表型。
心脏富含血管,因此,血管内皮细胞可能在合成的释放促炎细胞因子和趋化因子方面有重要的作用。研究表明血管内皮细胞是梗死心肌趋化因子重要来源, ROS和TLR信号通路激活可能介导梗死内皮炎症激活。血小板聚集也可能对炎症反应起重要作用。
最后,梗死的心肌细胞可以通过释放DAMPs促发炎症,但梗死边界区存活心肌细胞作为炎症介质的可能作用尚不清楚。
二、有效修复和炎症:
修复损伤组织有赖于及时抑制炎症,这一过程伴随着间叶细胞活化保留组织完整性。心肌功能和结构保留完整关系复杂,损伤心脏炎症抑制不足会带来灾难性结局。长期炎症可以导致心肌细胞丢失、收缩功能抑制、室腔扩大、心室壁完整性缺失和心脏破裂。
临床研究表明急性冠脉综合征患者1个月后血清炎症标记物持续升高增加无新发冠脉事件死亡率。这些患者不良预后可能反映抗炎通路激活不足加重心脏重塑和心肌损伤。
1. 抗炎信号:
心脏修复涉及的细胞类型似乎都参与心梗后炎症抑制,但是,炎症抑制关键效应细胞尚不清楚。单核细胞抑制亚型、淋巴细胞和抗炎巨噬细胞可能参与其中。基础研究表明巨噬细胞可以从早期促炎MI细胞转化为晚期修复M2细胞,但具体机制不明确。
研究表明巨噬细胞的吞噬能力在调节表型和抑制炎症反应中起着重要作用。吞噬细胞清除凋亡细胞可能有助于从炎症转化为修复。另外,调节性T细胞等抑制性淋巴细胞亚群可以抑制心梗后炎症反应,成纤维细胞和血管内皮细胞也可能有一定修复作用。
2. 分子抑制信号:
抑制促炎信号通路为维持组织稳态和激活死细胞清除后修复反应所必需。细胞内分子和可溶性介质都被用于心梗后炎症反应抑制研究中。如白介素1受体相关激酶3 (IRAK-3)不激活炎症,但抑制固有免疫信号,并且抑制巨噬细胞源性炎症和成纤维细胞介导的细胞外基质降解。
另外,TGF-β家族、IL-10和促炎可溶性脂质介质作为分泌介质可能也可以抑制心梗后炎症反应。
3. 从炎症到纤维化:
抑制梗死心脏炎症伴随着间叶细胞的激活,从而导致细胞外基质蛋白沉积,进而保留梗死心脏的结构完整性。成年心脏含有大量成纤维细胞,并且可以转化为肌成纤维细胞分泌基质蛋白,是心脏修复的关键。除了心脏固有成纤维细胞、骨髓来源成纤维细胞组细胞、平滑肌细胞和周细胞或许也可以转变为肌成纤维细胞。
此种转化需要几种微环境因素的共同作用:TGF-β活化、特定基质蛋白表达和沉积、机械应力增加以及促炎介质的移除。
三、如何实现抗炎治疗从基础研究向临床治疗的有效转化:
1. 前车之鉴:为什么在基础实验证据如此充分的情况下,研究结果转化到临床如此困难?
运用抗炎治疗减少心梗面积的临床治疗效果令人失望。尽管基础研究表明抗CD11/CD18整合素有效减少心梗面积,但针对β2 整合素的小型临床试验并未获益。另一项大型临床研究表明,对于行PCI的急性MI患者,针对补体系统的临床治疗也未能获益。这些失败让人质疑抗炎治疗的意义。为什么在基础实验证据如此充分的情况下,研究结果转化到临床如此困难?
- 学术界和大众往往对新的有前景的治疗策略过度乐观
- 动物模型结果不能直接预测临床疗效
- 动物模型与人体存在差异
- 人类心梗病理生理过程存在复杂性和异质性
心梗患者遗传背景、性别、年龄 合并症、治疗药物、疾病模式以及一些变量均可以对心梗反应产生重大影响。考虑到复杂的病理生理机制,尝试在动物模型中融入这些变量以达高预测价值是不现实的。
研究表明,年老抑制心梗再灌注验证反应。基于此研究结果,临床中抗炎治疗疗效不佳的其中一个原因可能是心梗患者年老所致。年老相关免疫反应失调使得心梗后抗炎治疗策略设计复杂化。
2. 后事之师:开发个体化、基于生物标记物的治疗方法有效抗炎
临床转化的成功实现需要研究疾病病生过程和理解临床背景,实行这一简单的概念在心梗治疗中的是至高无上的。
过去30年基础研究已经表明心梗后修复和重塑的重要机制。动物模型充分显示了心梗后炎症通路的复杂程度。理解炎症信号时间和空间调节对研究有效治疗方案至关重要。
- 控制炎症级联反应
- 分析不同信号通路或可发现特异有效的治疗策略
炎症扩大缺血心肌损伤尚存在争议,但炎症和纤维化在心脏重塑和心梗后心衰发展中的作用无可厚非。心梗后,左室形态和功能取决于基质降解和基质保留信号之间的平衡。
IL-1β和 MCP-1等促炎介质激活基质金属蛋白酶过度降解基质可以减少心肌张力,导致左室扩张和收缩功能不全。相反,基质保留反应过度激活,可能与TGF-β信号通路增强相关,将促进纤维化,可能导致舒张功能不全。
- 针对不同患者亚群制定不同治疗策略
糖尿病性患者心梗后心衰往往呈现为舒张功能不全,可能反映TGF-β/Smad促纤维化通路过度激活,因此,针对不同患者亚群应制定不同治疗策略。
- 生物标记物与分子成像技术辅助抗炎治疗
分子成像技术可以显示梗死心脏结构、细胞和分子转变,或许在识别炎症过度激活患者方面有很大的潜在价值。此类患者或许可以受益于抑制MCP-1 或IL-1等抗炎治疗。研究表明IL-1抑制剂和中和抗体及IL-1拮抗剂安全可行,IL-1受体拮抗剂治疗STEMI前景乐观。
相反,反映细胞外基质蛋白合成过度的生物标志物或TGF-β过度激活可能有助于识别纤维化重塑患者。这些患者可能获益于抑制Smad3.因此,需要开发个体化、基于生物标记物的治疗方法来有效针对心梗患者炎症反应。
结语:
炎症通路在梗死心脏修复和不良重塑中起着重要作用,针对炎症反应特异性成分的治疗方案对心梗患者意义重大。但是,人类心梗病理生理过程的复杂性是基础研究转化到临床研究的主要挑战。识别促炎反应或纤维通路过度激活的生物标记物或影像学策略或许有助于预防心梗后心衰治疗合理施行。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Nat#
55
#Cardiol#
68
#炎症反应#
76