靶向TROP-2 ADC药物的临床进展
2023-01-01 小药说药 小药说药 发表于上海
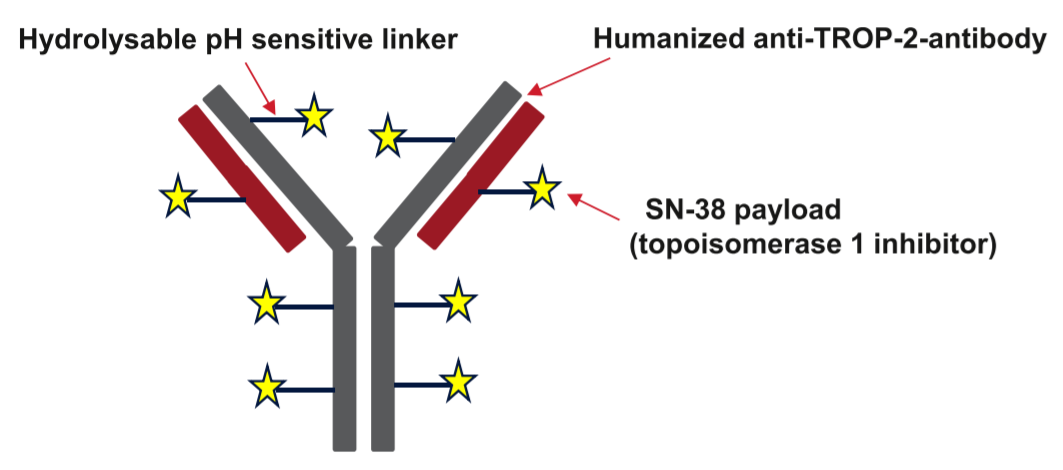
acituzumab govitecan(Trodelvy)是第一个获批的TROP-2靶向ADC,其抗TROP-2抗体通过可水解连接子与SN-38(一种拓扑异构酶抑制剂)偶联。
抗体药物偶联物(ADC)将化疗的强大细胞毒性与抗体的抗原特异性靶向结合在一起,在保护健康细胞的同时,向肿瘤细胞输出有效的细胞毒性,从而降低毒性,提高治疗指数。滋养层细胞表面抗原2(TROP-2)是一种参与钙信号转导的跨膜糖蛋白,在多种肿瘤类型中表达,因此它成为ADC研发的新兴热门靶点。
acituzumab govitecan(Trodelvy)是第一个获批的TROP-2靶向ADC,其抗TROP-2抗体通过可水解连接子与SN-38(一种拓扑异构酶抑制剂)偶联。这种可水解的连接子允许细胞内和细胞外释放膜可渗透的有效载荷,从而实现“旁观者效应”,提高该药物的效力。在预处理的转移性三阴性乳腺癌(TNBC)中,Trodelvy与化疗相比,无进展生存率(PFS)和总生存率(OS)显著提高。报告的常见不良事件(AE)为中性粒细胞减少症和腹泻。Datopotamab deruxtecan(Dato DXd)是另一种TROP-2 ADC,与Trodelvy的不同之处在于它具有可裂解的四肽连接子和更有效的拓扑异构酶抑制剂有效载荷。Dato DXd在未选择的转移性TNBC中显示出初步疗效,这些新型的TROP-2 ADC有可能在转移性乳腺癌(MBC)和早期乳腺癌(EBC)中提供增强的疗效和降低的毒性。
TROP-2是一种跨膜糖蛋白,具有细胞外和细胞内成分,参与钙信号转导。TROP-2与多种细胞信号传导途径有关,包括细胞内钙转导、MAPK信号传导途径、RAF、NF-κB和Cyclin D/E等。
TROP-2在癌细胞中上调,这种增加的表达已经在许多不同的肿瘤类型中看到,包括乳腺癌、结肠癌、非小细胞肺癌(NSCLC)、食管鳞状细胞癌、甲状腺癌和肝胆癌。癌细胞中TROP-2上调的原因尚不清楚,但据推测,TROP-2对细胞增殖和侵袭具有关键的调节作用,这意味着过表达将导致选择性肿瘤进展。事实上,临床前数据表明,TROP-2过表达刺激肿瘤生长,而TROP-2敲低抑制肿瘤生长。
特别是在乳腺癌中,TROP-2表达升高与生存率降低相关。在所有乳腺癌亚型中都检测到TROP-2基因表达,与HER2+乳腺癌相比,HR+/HER2和三阴性乳腺癌(TNBC)中的表达水平更高。因此, TROP-2也别认为是TNBC靶向治疗的一个有吸引力的候选者。
Sacituzumab govitecan(Trodelvy)
sacituzumab govitecan是一种新型ADC,使用可水解的连接子将人源化RS7抗TROP-2 抗体与伊立替康的活性代谢产物SN-38偶联。Trodelvy特别适合作为ADC有几个原因。首先,据估计,其活性代谢产物SN-38的效力是伊立替康的2-3倍,而且具有膜渗透性,使其能够发挥“旁观者效应”。第二,SG的可水解连接子允许SN-38的胞外释放以及胞内释放,从而创建了“旁观者效应”的另一种机制。这种细胞外释放的潜力可能对具有异质性TROP-2表达的肿瘤特别有益。第三,SG提供7.6:1的高DAR,其独特的抗体和连接子设计允许SG保持更高的DAR,而不损害抗体结合或药代动力学特性。最后,与其他拓扑异构酶抑制剂相比,SG的毒性降低,这被认为是由于与抗体偶联的SN-38分子的葡萄糖醛酸化速率较低,而不是直接从伊立替康代谢的SN-38。
Trodelvy在上皮癌的I/II期研究(NCT01631552)
该临床实验第一阶段在25名患者中对13种不同的上皮性肿瘤检测了IMMU-32的安全性和耐受性。这项研究包括不同肿瘤类型的患者,包括乳腺癌、结直肠癌、子宫内膜癌、小细胞肺癌和非小细胞肺癌等。
在研究结束时,有2名患者获得部分应答(PR),16名患者病情稳定(SD),其中6例存活15-20个月以上。在该研究中,没有治疗相关的4级毒性,3级毒性仅限于腹泻(n=1)、疲劳(n=3)和中性粒细胞减少(n=2)。结果显示,IMMU-132总体上是一种耐受性良好的治疗药物。
第二阶段在不同类型肿瘤的研究结果如下:
Trodelvy在乳腺癌患者的Ⅱ期研究
结果显示,69名患者中,2名患者有完全应答,19人有部分响应。本组临床受益率(本研究定义为完全缓解+部分缓解+病情稳定≥6个月)为46%。中位缓解期为8.9个月,中位总生存期为16.6个月,中位无进展生存期为6.0个月。≥3级的不良事件包括贫血(14%)、腹泻(13%)、白细胞减少(16%)和中性粒细胞减少(39%)。
Trodelvy在尿路上皮癌患者的I/Ⅱ期研究
6名患者中有3名有临床显著反应, 无进展生存期6.7-8.2个月, 总生存期7.5个月+到11.4个月+。6名患者中有2名经历了3级不良反应(腰痛和菌血症),未观察到4级不良反应。
Trodelvy在NSCLC患者的Ⅱ期研究
54名转移性NSCLC患者中,临床受益率(本研究定义为完全缓解+部分缓解+病情稳定)≥4个月)为43%。此外,治疗的中位响应持续时间为6个月,中位总生存期为9.5个月,中位无进展生存期为5.2个月。
关于毒性,≥3级的不良反应包括腹泻(7%)、疲劳(6%)、中性粒细胞减少(4%)、恶心(7%)和中性粒细胞减少(28%)。
Trodelvy在SCLC患者Ⅱ期研究
在另一项转移性小细胞肺癌患者的研究中,与基线CT相比,60%的患者显示肿瘤缩小,临床受益率为34%(本研究定义为完全缓解+部分缓解+稳定疾病≥4个月)。中位总生存期为7.5个月,中位无进展生存期为3.7个月。
关于毒性,≥3级的不良反应包括包括贫血(6%)、腹泻(9%)、疲劳(13%)和中性粒细胞减少(34%)。
Trodelvy在尿路上皮癌的II期研究(NCT03547973)
TROPHY 是一项单臂、国际多中心II期临床研究,该研究共招募了112 例曾接受铂类化疗和PD-1或PD-L1抑制剂治疗的局部晚期或转移性UC。
研究结果显示,112例疗效可评估患者的ORR为 27.7%,其中5.4%的患者达到CR,22.3%的患者达到PR。中位缓解持续时间(mDoR)为7.2个月(95%CI:4.7-8.6)。最常见不良反应(发生率>25%)包括中性粒细胞减少、恶心、腹泻、疲劳、脱发、贫血、呕吐、便秘、食欲减退、皮疹和腹痛。
Trodelvy在三阴性乳腺癌的III期研究(NCT02574455)
ASCENT是一项国际性、开放标签III期临床研究,共入组了529例既往接受过至少2种化疗(包括紫杉醇)的复发难治转移性三阴乳腺癌患者。
治疗组中位PFS为5.6个月(4.3~6.3),化疗对照组为1.7个月(1.5~2.6),Trodelvy治疗组可使疾病进展风险降低59%。在次要终点方面,Trodelvy明显改善了患者OS(12.1 vs 6 .7个月),患者死亡风险降低52%,治疗组的ORR为35%(82/235),而化疗对照组仅为5%(11/233)。
安全性方面,相对于对照组,3级以上治疗相关不良事件主要包括中性粒细胞缺乏症(51% vs 33%)、腹泻(10% vs 1%)、白细胞减少症(10% vs 5%)、贫血(8% vs 5%)和粒细胞减少性发热(6% vs 2%)。
Datopotamab deruxtecan (Dato-DXd)
Dato DXd是一种TROP-2定向ADC,其中人源化抗TROP-2 IgG1 单克隆卡昂提通过基于四肽的可切割连接子偶联拓扑异构酶I抑制剂有效负载。该结构中的DAR为~4:1,它在循环中是高度稳定的,这是因为连接子仅设计用于在溶酶体蛋白酶存在下切割。虽然有效载荷(DXd)与Trodelvy中的有效载荷(SN-38)具有相同的作用机制(MOA),但它们之间存在一些重要的差异。DXd的效力是SN-38的10倍,Dato DXd的较长半衰期允许3周的给药计划。此外,DXd的治疗指数有所提高,21天后释放的有效载荷仅为5%,而sacituzumab 3天后释放的净载荷为90%。
ROPION-PanTumor01是一项针对TNBC的1期临床试验,在21例接受datopotamab deruxtecan治疗的可评价患者中,通过盲法独立中心评价,初步客观缓解率(ORR)为43%。
在2021年1月8日数据截止时,5例患者确认完全或部分缓解(CR/PR),另有4例CR/PR等待确认。疾病控制率(DCR)达95%。在TNBC队列中,观察到的datopotamab deruxtecan安全性与之前在该试验的非小细胞肺癌(NSCLC)队列中报道的安全性一致。
PF-06664178
PF-06664178是一种靶向Trop-2的抗体偶联Aur0101(一种auristatin微管抑制剂)的ADC,目前已终止了临床开发。在已进行的1期临床研究中,31例转移性实体瘤患者接受了递增剂量(0.15-4.8mg/kg)的PF-0664178治疗。31例中11例病情稳定,没有完全或部分响应。
关于毒性,在3.6mg/kg剂量下, 33%的患者出现剂量限制性毒性,毒性为4级中性粒细胞减少和3级黏膜炎症。在4.2mg/kg剂量下,1/1(100%)患者出现剂量限制性毒性,3级黄斑丘疹。在4.8mg/kg剂量下,8名患者中有4名(50%)出现剂量限制性毒性,包括4级发热性中性粒细胞减少、4级中毒性表皮坏死松解、4级脱水和3级皮疹。
小结
ADC极大地扩展了乳腺癌患者的治疗选择。在MBC中ADCs的早期开发主要集中于HER2靶向。然而,目前新兴的ADCs已扩展到针对多种乳腺癌亚型的TROP-2。在MBC和尿路上皮癌中通过ADC靶向TROP-2的成功以及在NSCLC中进行的试验已经确立了TROP-2靶向是一种有效且富有前景的策略。
此外,一些其它靶向的ADC也正在临床试验中探索。其中包括patritumab deruxtecan,一种HER3靶向ADC,有效载荷与T-DXd相同,enfortumab vedotin,一种靶向Nectin-4抗体和MMAE有效载荷的ADC。
参考文献:
1. Targeting Trop-2 in solid tumors: future prospects. Onco Targets Ther. 2019; 12: 1781–1790.
2. Antibody-drug conjugates targeting TROP-2: Clinical development in metastatic breast cancer. Breast. 2022 Dec;66:169-177.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言