Clin Cancer Res:Tucatinib获批治疗晚期HER2阳性乳腺癌
2020-10-17 星云 MedSci原创
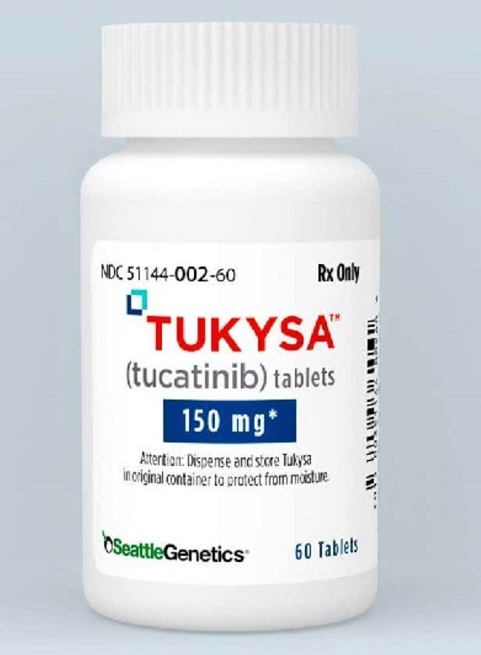
Tukysa(Tucatinib)妥卡替尼 /图卡替尼 (ONT-380)是一种口服TKI(酪氨酸激酶)抑制剂,对HER2具有高度特异性,但对人表皮生长因子受体家族的EGFR没有明显抑制作用。
Tukysa(Tucatinib)妥卡替尼 /图卡替尼 (ONT-380)是一种口服TKI(酪氨酸激酶)抑制剂,对HER2具有高度特异性,但对人表皮生长因子受体家族的EGFR没有明显抑制作用。
2020年4月17日,FDA批准了tucatinib联合曲妥珠单抗和卡培他滨治疗不可手术切除的或转移性HER2阳性的晚期乳腺癌患者,包括在转移发生后已经接受过一种或多种基于抗HER2的方案治疗的脑转移患者。这是在美国FDA肿瘤卓越中心项目Orbis中评估的第一个新分子实体。该次批准是基于HER2CLIMB试验。
HER2CLIMB试验是一项随机化的临床试验,612位受试患者接受tucatinib或安慰剂联合曲妥珠单抗和卡培他滨治疗。
研究结果显示,与安慰剂相比,tucatinib可明显延长患者的无进展存活期(PFS:7.8个月 vs 5.6个月)(HR 0.54, 95% CI 0.42-0.71, p<0.00001)和总体存活期(OS:21.9个月 vs 17.4个月)(HR 0.66, 95% CI 0.50-0.87, p=0.00480)。
接受治疗、病情稳定的患者或有活跃的脑转移的患者占研究人群的48%。有脑转移的患者的PFS可从tucatinib治疗中获益(HR 0.48, 95% CI 0.34-0.69, p<0.0001)。脑转移患者的获益允许在适应症中纳入这一特定人群。
重要的不良反应包括腹泻和肝毒性,这些都列在了用药提醒和预防措施中。
综上,本文总结了tucatinib获FDA批准的过程和支持数据。具体内容参见原文。
原始出处:
Mirat Shah, et al. FDA Approval Summary: Tucatinib for the Treatment of Patients with Advanced or Metastatic HER2-Positive Breast Cancer. Clinical Cancer Research. DOI: 10.1158/1078-0432.CCR-20-2701
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











学习学习
143
#HER2阳性#
102
#Tucatinib#
77