PNAS:周婕/袁国勇/姜世勃等通过呼吸道类器官揭示Omicron高传染性的机制
2023-04-18 “生物世界”公众号 “生物世界”公众号 发表于上海
该研究利用人呼吸道类器官模型,评估了Omicron BA.5及其他变异株在人体呼吸道细胞的感染和复制能力的改变。
新冠病毒变异株在世界各地引发了多次感染高峰。奥密克戎(Omicron)毒株B.1.1.529于2021年11月中旬在南非被首次发现, 之后迅速在全球流行并一直处于快速变异中。自2022年8月初以来,BA.5成为全球主要流行的变异株。与野生型病毒相比,奥密克戎毒株的刺突蛋白(Spike),尤其是受体结合区域(RBD),发生了很多变异。受体结合区域是病毒与宿主细胞受体的主要结合部位,也是中和抗体的主要靶点。
大量的研究表明,Omicron相比之前的变异株更容易逃避抗体的中和,导致免疫逃逸,从而增加了在免疫人群中感染或再次感染的机会。然而,科学家们在思考另一个重要的科学问题:SARS-CoV-2是否在演变过程中,强化了在人呼吸道细胞内生长复制的能力,从而导致传播能力的增强?回答这个问题需要一个可以模拟人类呼吸道上皮的生物模型,以检测病毒在人类呼吸道细胞中的感染和复制情况。
2023年4月17日,香港大学微生物系周婕/袁国勇教授团队,联合类器官先驱Hans Clevers教授及复旦大学姜世勃教授,在《美国国家科学院院刊》(PNAS)发表了题为:Human airway and nasal organoids reveal escalating replicative fitness of SARS-CoV-2 emerging variants 的研究论文。
该研究利用人呼吸道类器官模型,评估了Omicron BA.5及其他变异株在人体呼吸道细胞的感染和复制能力的改变。他们在人鼻粘膜类器官和气道类器官的研究发现,BA.5 Spike蛋白可以提高新冠病毒的入侵效率,并通过形成合胞体,增强病毒在细胞间的传播,从而大大增强了复制能力。也就是说,SARS-CoV-2变异株增强了在人类呼吸道上皮细胞中的复制能力, 使得病毒的在人群中的感染传播能力大大增强。

研究团队首先在气道类器官(Airway Organoid)和鼻粘膜类器官(Nasal Organoid)中研究了野生型新冠病毒(WT)、B.1.1.529 和BA.5的感染和复制情况。结果显示,BA.5感染气道类器官后产生的病毒滴度比WT和B.1.1.529更高(图1A)。在低病毒量感染后,WT和B.1.1.529几乎不能在气道类器官中复制(图1B,C),但BA.5 依然可以有效的感染和复制。在鼻粘膜类器官中的研究结果也表明,BA.5的感染和复制能力显着强于B.1.1.529(图1D,E,F,G)。在鼻粘膜和气道类器官中,BA.5达到了和流行性流感病毒H1N1(H1N1pdm)相当的感染和复制能力(图1H,I)。总的来说,BA.5在人气道和鼻粘膜类器官中表现出很强的,与季节性流感病毒株相当的感染复制能力,从而更容易在人群中传播。
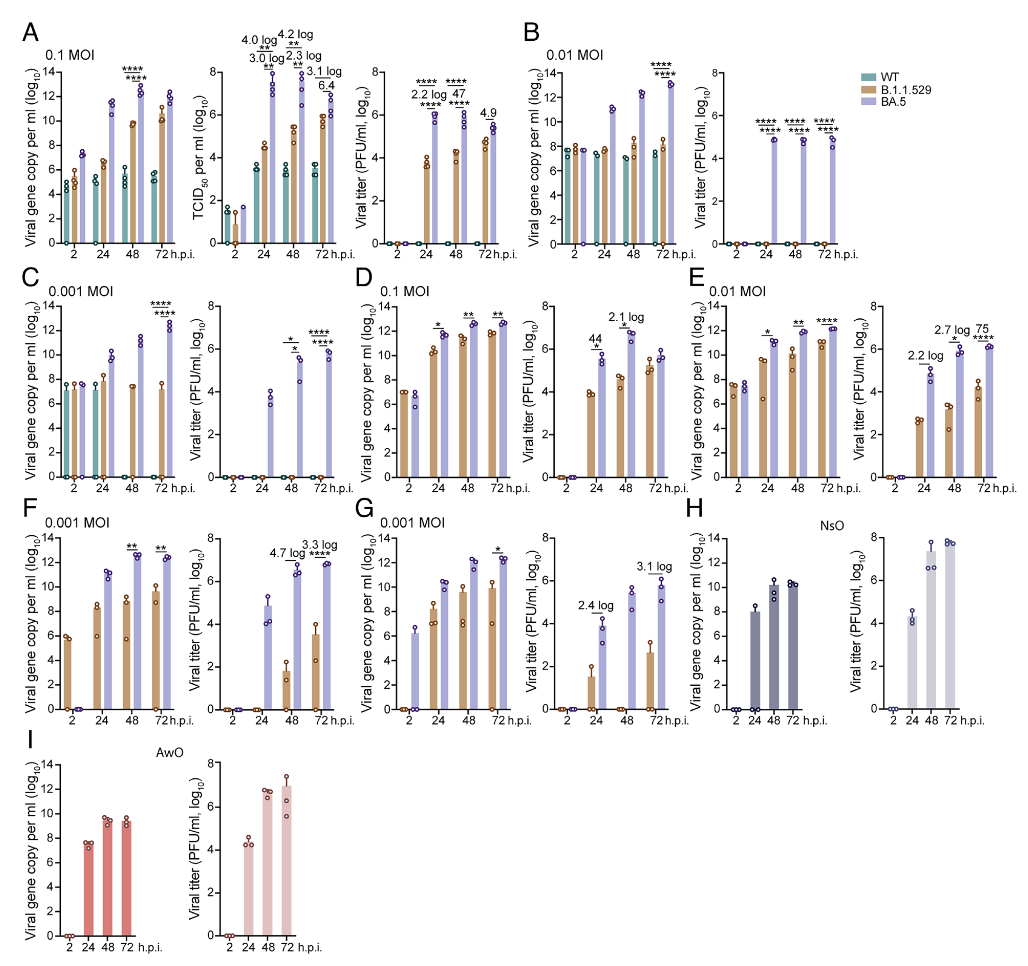
图1:SARS-CoV-2在人气道和鼻粘膜类器官中的感染复制能力
为了更进一步分析新冠病毒在类器官中的感染,研究团队将病毒感染后的类器官进行了免疫染色和共聚焦成像。结果表明,BA.5感染的鼻粘膜和气道类器官中,病毒阳性细胞的数量明显比B.1.1.529和WT增多(图2A,B)。流式细胞术分析也显示, BA.5在气道(图2C)和鼻粘膜类器官(图2D)中的感染率显着高于B.1.1.529和WT。为了研究导致BA.5感染性更高的机制,他们构建了携带BA.4/5、B.1.1.529和WT spike蛋白的假病毒。假病毒感染实验证实,BA.4/5在鼻粘膜类器官中的感染效率显着高于B.1.1.529和WT(图2E)。
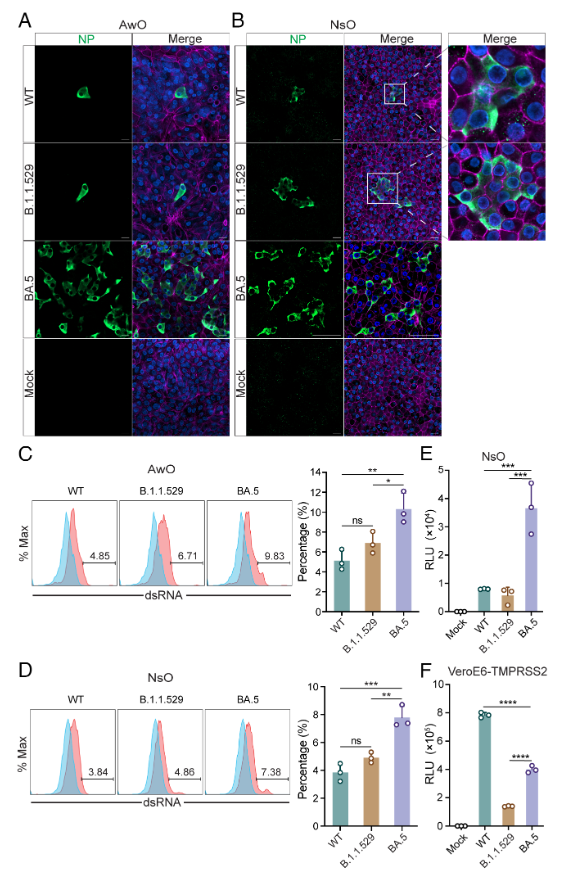
图2:BA.5在人气道和鼻类器官中具有更高的感染率
研究团队发现BA.5感染后的气道类器官(图3A)和鼻粘膜类器官(图3B)可以形成典型的多核合胞体,而WT和B.1.1.529 的感染并不能产生合胞体。为验证BA.5 Spike蛋白是否能在类器官中有效诱导合胞体的形成,研究团队在鼻粘膜类器官中进行慢病毒转导过表达BA.4/5、B.1.1.529 和WT的Spike蛋白。结果显示, BA.5 Spike蛋白的过表达就可以在鼻粘膜类器官中与BA.5感染相类似的多核合胞体形成(图3C)。

图3:BA.5病毒感染和BA.5 Spike蛋白过表达在类器官中引起多核合胞体的形成
有趣的是,在肺泡类器官的感染实验中, BA.5的病毒滴度显着低于WT和BA.1,这表明BA.5引起COVID-19的严重并发症的倾向较低(图4)。
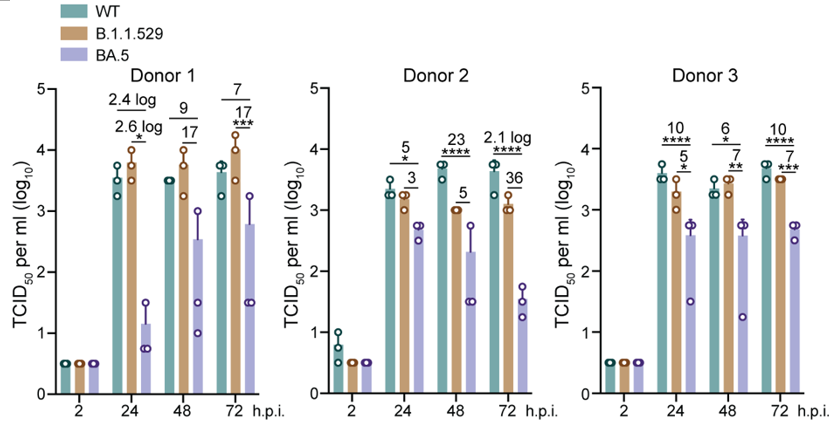
图4:BA.5在人肺泡类器官中的复制能力减弱
香港大学李嘉诚医学院微生物系周婕/袁国勇教授、荷兰Hubrecht 研究所Hans Clevers教授及复旦大学姜世勃教授为该文章的通讯作者。香港大学李嘉诚医学院微生物系研究助理教授李存博士和博士研究生黄晶晶、俞亦飞、万智信为该论文第一作者。
PI简介:
周婕博士,现任香港大学新发传染病国家重点实验室及香港大学李嘉诚医学院微生物系助理教授。周博士团队与类器官技术的创始人荷兰科学院院士Hans Clevers教授合作,建立了世界上第一个来源于肺成体干细胞的类器官。在此基础上,团队开发出了人体呼吸道类器官双向分化技术,建立了成熟的气道类器官和肺泡类器官(图5)。他们还从正常人的鼻腔中无创伤性地刷取少量细胞,高效地建立了鼻粘膜类器官(图5)。相关成果分别发表在美国科学院院刊PNAS(2018),美国微生物会会刊mBio和Cell Discovery(2022)上。此外,在疫情爆发初期,周婕博士团队建立了世界上首个蝙蝠肠道类器官,提供了可靠证据表明新冠病毒起源于蝙蝠(Nature Medicine 2020)。他们之后对蝙蝠肠道类器官培养体系进行优化,并将人与蝙蝠的肠道类器官进行比较,证实了蝙蝠细胞无症状携带病毒的机制(STTT,2022)。
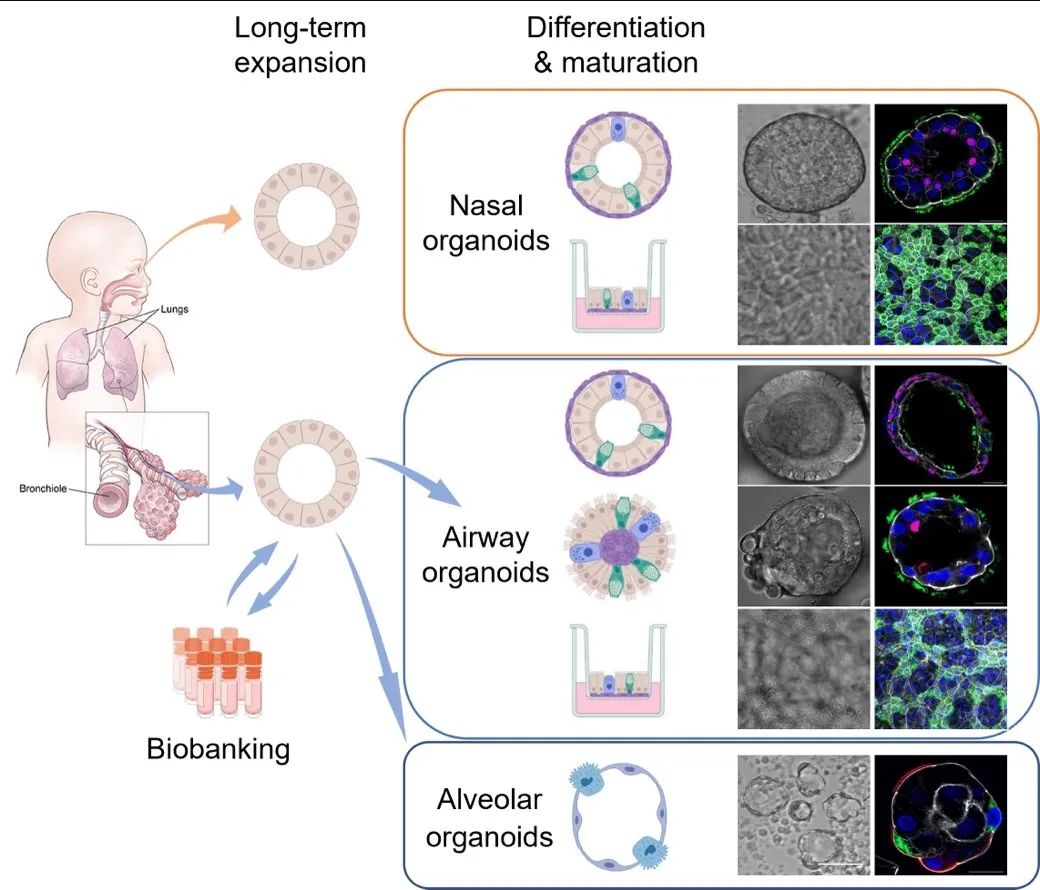
图5:周博士团队建立的人呼吸道类器官培养系统
周婕博士的研究重点是建立类器官用于研究病毒-宿主相互作用,2021年被Clarivate Analytics Essential Science Indicators 评为世界被引用数排名前1% 的学者之一。周博士团队拟招聘具有细胞生物学,分子生物学,免疫学,微生物学及病毒相关研究背景的研究助理,硕士,博士及博士后。有意申请者请将个人简历以邮件方式发送至jiezhou@hku.hk。
原始出处:
Cun Li, et al. Human airway and nasal organoids reveal escalating replicative fitness of SARS-CoV-2 emerging variants. PNAS, 2023.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







