Nature:破解前列腺癌免疫治疗耐药难题:SPP1hi-TAMs成为全新治疗靶点
2024-12-07 生物探索 生物探索 发表于陕西省
前列腺癌中mCRPC对免疫检查点抑制剂疗效不佳,研究发现SPP1hi-TAMs随疾病进展富集,通过腺苷信号通路致免疫治疗耐药,阻断腺苷A2A受体联合治疗可增效,还探讨其在精准医学等方面意义。
引言
前列腺癌是全球男性中最常见的恶性肿瘤之一,尤其是晚期转移性去势抵抗性前列腺癌(mCRPC)。尽管免疫检查点抑制剂(ICIs)已被证明对多种癌症具有显著疗效,但对于mCRPC患者来说,这一治疗策略的效果却不尽人意。这背后的原因复杂且多样,而肿瘤微环境(TME)的免疫抑制性被认为是关键因素之一。
近年来,研究人员发现,肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)和髓系抑制细胞(MDSCs)在促进肿瘤生长和抑制免疫反应中扮演了重要角色。然而,这些髓系细胞种类多样、功能复杂,使得针对它们的治疗策略面临巨大挑战。例如,尽管CSF1R(集落刺激因子1受体)阻断剂曾被寄予厚望,但临床试验的结果却显示出有限的疗效。如何深入理解髓系细胞在前列腺癌免疫抑制中的具体机制,成为破解治疗耐药难题的关键。
12月4日Nature的研究报道“Evolution of myeloid-mediated immunotherapy resistance in prostate cancer”,研究人员利用单细胞RNA测序技术,分析了不同阶段前列腺癌患者肿瘤样本中的髓系细胞,发现了一种高度表达SPP1基因的巨噬细胞亚群(SPP1hi-TAMs)。这种特定细胞随着疾病进展逐渐富集,并通过腺苷信号通路抑制CD8+ T细胞活性,最终导致免疫治疗的耐药性。更令人振奋的是,研究进一步表明,阻断腺苷A2A受体(A2AR)不仅可以有效降低SPP1hi-TAMs的免疫抑制作用,还显著提高了免疫检查点抑制剂的疗效。
该研究不仅揭示了SPP1hi-TAMs在前列腺癌免疫治疗耐药中的核心作用,还提供了一种可能的联合治疗策略,为mCRPC患者带来了新的希望。这一发现强调了从肿瘤微环境入手的治疗潜力,并为未来的精准医学研究提供了重要的指引。

前列腺癌的挑战:为何免疫治疗对某些患者无效?
前列腺癌是全球男性中最常见的恶性肿瘤之一,尤其在老龄化社会中,其发病率和死亡率居高不下。仅在美国,每年新增病例数就高达29万,导致约3.5万例患者不幸去世。尽管当前的治疗手段,如雄激素剥夺治疗(androgen deprivation therapy, ADT),在早期前列腺癌中表现出良好的疗效,但大多数患者最终会进入转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)的阶段。此时,肿瘤不仅对ADT耐药,还常伴随治疗选择有限,患者预后极差。
近年来,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的问世为癌症治疗带来了革命性突破。这种疗法通过阻断抑制T细胞活性的蛋白质(如PD-1、PD-L1和CTLA-4),使免疫系统重新激活,识别并清除肿瘤细胞。在某些癌症类型中,ICIs展现了前所未有的疗效。然而,遗憾的是,mCRPC患者对ICIs普遍反应较差,只有极少数具有特殊分子亚型的患者能够受益。
那么,为什么免疫疗法对mCRPC患者“束手无策”?研究表明,问题的核心在于肿瘤微环境(tumor microenvironment, TME)的免疫抑制特性。在mCRPC中,肿瘤微环境复杂且动态,包含了大量的免疫抑制性髓系细胞(如肿瘤相关巨噬细胞和髓系抑制细胞),它们通过多种机制削弱了T细胞的抗肿瘤活性。更糟糕的是,这些免疫抑制细胞在ADT治疗后会进一步富集,形成难以突破的“免疫屏障”。
尽管髓系细胞的存在是免疫治疗失败的关键原因之一,相关靶向策略却面临巨大挑战。例如,针对集落刺激因子1受体(CSF1R)的阻断剂在临床试验中未能显著改善患者的预后。这种失败反映了髓系细胞种群的异质性及其复杂的免疫调控网络。
揭开髓系细胞的神秘面纱:从复杂到精准
在癌症研究中,髓系细胞一直是一把“双刃剑”。它们在健康状态下负责维持免疫平衡,但在癌症环境中却常被肿瘤“招募”并“改造”,成为促进肿瘤生长和免疫抑制的帮凶。特别是在前列腺癌的肿瘤微环境中,髓系细胞不仅数量众多,功能也复杂多样,包括肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)、髓系抑制细胞(myeloid-derived suppressor cells, MDSCs)和树突状细胞(dendritic cells, DCs)等。
研究发现,这些髓系细胞通过释放多种免疫抑制因子(如IL-10、TGF-β)和代谢产物(如腺苷),削弱了T细胞和自然杀伤细胞(NK细胞)的抗肿瘤活性。然而,髓系细胞并不是单一的群体,而是一个异质性极高的“大家族”。例如,TAMs就分为M1型(促炎性、抗肿瘤性)和M2型(抗炎性、促肿瘤性),它们的比例和功能会随着肿瘤的进展而动态变化。这种复杂性使得针对髓系细胞的治疗策略面临巨大挑战。
幸运的是,单细胞技术的兴起为破解这一谜题带来了突破性进展。通过单细胞RNA测序(single-cell RNA sequencing, scRNA-seq),研究人员可以精确地解析肿瘤组织中每个细胞的基因表达特征。在这项研究中,研究人员对不同阶段前列腺癌患者的肿瘤样本进行了单细胞分析,共获得超过14万单细胞的转录组数据。结果显示,髓系细胞被细分为14种亚群,包括8种巨噬细胞亚群、2种髓系抑制细胞亚群和3种树突状细胞亚群等。
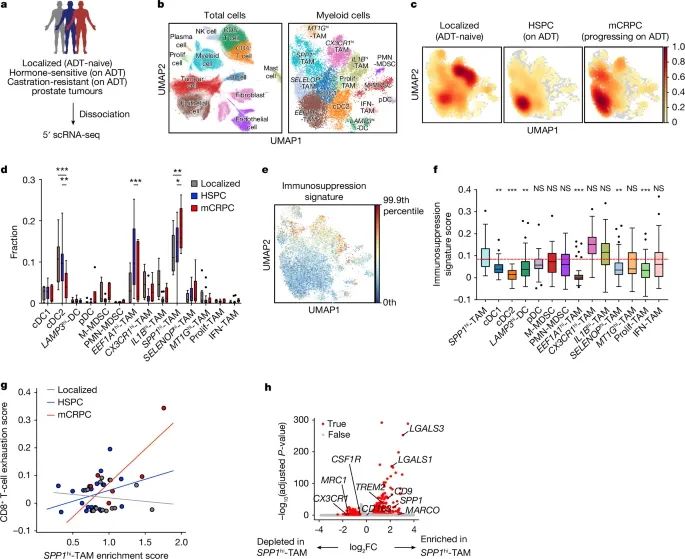
通过单细胞RNA测序(5′ scRNA-seq)技术,揭示了前列腺癌患者肿瘤样本中SPP1高表达的肿瘤相关巨噬细胞(SPP1hi-TAMs)的富集情况及其免疫抑制作用的动态变化(Credit: Nature)
研究对象与方法: 图a描述了研究对象的分类,包括未接受雄激素剥夺治疗(ADT)的局限性前列腺癌患者(n=13)、接受ADT治疗的转移性激素敏感型前列腺癌患者(HSPC, n=24)以及ADT治疗后进展为去势抵抗型前列腺癌患者(mCRPC, n=6)。通过对这些患者的肿瘤样本进行单细胞RNA测序(10x Genomics),研究人员深入分析了肿瘤微环境(TME)中髓系细胞的组成和功能。
髓系细胞的异质性: 图b展示了通过UMAP聚类图对肿瘤样本细胞类型和髓系细胞亚群的识别。研究共鉴定出多种髓系细胞亚群,包括8种巨噬细胞亚群、2种髓系抑制细胞(MDSC)亚群及3种树突状细胞(DC)亚群,进一步显示了髓系细胞在TME中的高度异质性。
SPP1hi-TAMs的动态富集: 图c和图d量化了髓系细胞亚群在前列腺癌疾病进展中的频率变化。研究发现,随着疾病从局限性前列腺癌进展至mCRPC,SPP1hi-TAMs的数量显著增加(与局限性前列腺癌相比P=0.002,与HSPC相比P=0.04)。这一结果表明SPP1hi-TAMs可能是晚期疾病阶段的重要免疫抑制因子。
免疫抑制基因表达特征: 图e和图f显示,SPP1hi-TAMs具有较高的免疫抑制基因表达分数,与其他髓系细胞亚群相比表现出更强的免疫抑制能力。研究还发现,这些基因特征在mCRPC患者中显著增强,进一步强化了SPP1hi-TAMs在抑制免疫反应中的作用。
与T细胞耗竭的关联: 图g揭示了SPP1hi-TAMs的富集程度与CD8+ T细胞耗竭特征之间的相关性。mCRPC患者中,这种相关性更为显著(P=0.07,R=0.780),表明SPP1hi-TAMs可能通过诱导T细胞耗竭促进免疫治疗耐药。
SPP1hi-TAMs的特异基因表达: 图h分析了SPP1hi-TAMs与其他髓系细胞亚群之间的差异基因表达。SPP1hi-TAMs显著上调了与免疫抑制和腺苷信号通路相关的基因(如SPP1、CD73),而关键巨噬细胞靶点基因(如CSF1R)的表达水平较低。这一特性可能解释了传统CSF1R阻断疗法对mCRPC疗效有限的原因。
SPP1hi-TAMs:免疫治疗耐药的“幕后推手”
在探究前列腺癌免疫治疗耐药性时,研究人员发现了一群关键的“幕后推手”——高度表达SPP1基因的肿瘤相关巨噬细胞(SPP1hi-TAMs)。这一髓系细胞亚群在疾病进展中逐渐占据主导地位,不仅数量显著增加,还展现出强大的免疫抑制功能。
通过单细胞RNA测序(scRNA-seq),研究人员识别出SPP1hi-TAMs在mCRPC患者肿瘤微环境中的富集程度远高于早期阶段的前列腺癌。组织染色实验进一步验证了这一发现:与早期激素敏感型前列腺癌相比,晚期去势抵抗性前列腺癌患者中SPP1hi-TAMs的数量显著增加。这些细胞不仅富集SPP1基因表达,还伴随CX3CR1和CSF1R等关键分子表达的下降,后者是传统抗巨噬细胞治疗的主要靶点之一。这种分子特性的变化可能解释了CSF1R阻断剂治疗失败的原因。
那么,SPP1hi-TAMs如何在肿瘤中发挥免疫抑制作用?研究表明,这一细胞亚群通过腺苷信号通路实现了强效的免疫抑制。腺苷是一种代谢产物,通过与腺苷A2A受体(A2AR)的结合,抑制了CD8+ T细胞的增殖和功能。SPP1hi-TAMs在高氧耗和缺氧环境中表现出显著的腺苷相关基因(如CD73)的过表达,释放了大量腺苷分子,从而进一步强化了肿瘤微环境的免疫抑制性。
研究中,小鼠实验清楚地展示了SPP1hi-TAMs的这一功能。当SPP1hi-TAMs与CD8+ T细胞共同培养时,T细胞的增殖率和活性显著下降,表明这些巨噬细胞通过腺苷信号阻碍了免疫反应的有效性。此外,SPP1hi-TAMs的富集与T细胞耗竭基因表达的上升高度相关,这表明其直接影响了抗肿瘤免疫反应的核心环节。
动物实验的启示:从分子机制到治疗策略
理解SPP1hi-TAMs在免疫治疗耐药中的作用,离不开动物模型的深入验证。在这项研究中,研究人员使用前列腺癌小鼠模型,不仅再现了人类肿瘤微环境的复杂性,还揭示了SPP1hi-TAMs的功能机制及其对治疗的影响。
研究团队通过移植MyC-CaP前列腺癌细胞建立小鼠模型,并通过单细胞RNA测序技术,在模型中成功识别出与人类SPP1hi-TAMs相对应的髓系细胞亚群。这些细胞以高度表达Spp1、Cd9和Lgals3基因为特征,同时显著缺乏CSF1R的表达,这一特性与临床观察中CSF1R阻断剂治疗无效的现象完全一致。
为了评估SPP1hi-TAMs的功能,研究人员采用了共培养实验和免疫检查点抑制剂(ICIs)联合治疗模型。在体外实验中,SPP1hi-TAMs通过腺苷信号途径抑制CD8+ T细胞的增殖和活性,进一步证实了其强大的免疫抑制作用。在体内,研究人员通过将SPP1hi-TAMs直接注射到接受ICIs治疗的小鼠肿瘤中,观察到ICIs的疗效显著下降,表明SPP1hi-TAMs是ICIs耐药的关键驱动因素。
更令人振奋的是,该研究还探索了腺苷A2A受体(A2AR)阻断剂在治疗中的潜力。研究发现,通过使用A2AR抑制剂ciforadenant,可以显著降低SPP1hi-TAMs的免疫抑制作用,同时增强CD8+ T细胞的抗肿瘤活性。在小鼠模型中,联合使用A2AR阻断剂和ICIs,不仅有效抑制了肿瘤生长,还显著延长了小鼠的生存期。
这些动物实验清楚地表明,SPP1hi-TAMs通过腺苷信号通路推动免疫治疗耐药,而A2AR阻断剂则为破除这一机制提供了有效的解决方案。
联合治疗的突破:腺苷阻断如何改变局面
在免疫治疗领域,联合疗法正在成为突破癌症治疗瓶颈的关键策略。针对SPP1hi-TAMs通过腺苷信号通路导致的免疫抑制,研究团队探索了腺苷A2A受体(A2AR)抑制剂与免疫检查点抑制剂(ICIs)联合治疗的可能性,初步结果振奋人心。
在临床前小鼠模型中,研究人员首先评估了单独使用A2AR抑制剂ciforadenant的效果。结果显示,A2AR抑制剂显著降低了肿瘤中SPP1hi-TAMs的数量,并减少了CD8+ T细胞的耗竭现象(标记为CD38+PD-1+),从而有效抑制了肿瘤的生长。当ciforadenant与PD-1抑制剂联合使用时,疗效进一步提升,肿瘤生长明显减缓,CD8+ T细胞的多功能性(如同时分泌IFN-γ和TNF-α的能力)显著增强。这表明腺苷阻断通过解除免疫抑制,为ICIs激发T细胞活性提供了更有利的环境。
这一成果在早期临床试验中也得到了验证。在一项针对晚期mCRPC患者的I期临床试验中,研究人员测试了ciforadenant与PD-L1抑制剂atezolizumab的联合疗法。24名患者中,有25%的患者在治疗后前列腺特异性抗原(PSA)水平显著下降,且部分患者的肿瘤体积明显缩小。进一步分析发现,治疗前肿瘤中SPP1hi-TAMs的高丰度可能预示着更好的治疗效果,这为开发基于生物标志物的精准治疗策略提供了线索。
联合疗法的成功不仅归功于A2AR抑制剂有效削弱了SPP1hi-TAMs的免疫抑制作用,还在于PD-1或PD-L1抑制剂激发了更强的抗肿瘤免疫反应。这种协同效应为治疗mCRPC开辟了新的路径,尤其是那些对单一ICIs治疗无反应的患者。
未来的治疗新思路
肿瘤治疗的未来,正在从“治愈肿瘤”向“重塑微环境”转变。在这场转变中,SPP1hi-TAMs的发现不仅为mCRPC患者的治疗带来了新的希望,也为精准医学提供了全新的思路。作为一种高度特异的肿瘤相关巨噬细胞亚群,SPP1hi-TAMs展现出了巨大的潜在价值。
首先,SPP1hi-TAMs可以作为一种重要的生物标志物,帮助预测免疫治疗的效果。在临床试验中,研究人员发现患者肿瘤组织中SPP1hi-TAMs的丰度与联合治疗的疗效显著相关。通过检测SPP1hi-TAMs的水平,医生或许能够筛选出更有可能受益于A2AR抑制剂与免疫检查点抑制剂联合治疗的患者群体,从而实现个性化治疗。这种基于生物标志物的精准医学策略,有望提升治疗的成功率,并避免无效治疗带来的经济和身体负担。
其次,SPP1hi-TAMs本身也是一个极具潜力的治疗靶点。研究显示,SPP1hi-TAMs通过腺苷信号通路抑制抗肿瘤免疫反应,同时还能通过其他促炎性因子(如IL-1β)进一步恶化肿瘤微环境。未来的研究可以进一步探索更多抑制SPP1hi-TAMs功能或减少其数量的方法,例如针对腺苷信号通路和炎症因子的双靶点治疗策略,从而从源头上瓦解免疫抑制。
此外,肿瘤微环境的复杂性决定了单一治疗手段往往难以完全奏效。未来的治疗应当注重多通路、多靶点的综合干预,尤其是结合免疫调控和代谢调节的策略,以彻底扭转TME的不利局面。研究表明,通过单细胞技术解析的微环境数据,不仅有助于发现新的细胞群体,还能推动新型药物的开发。
未来的医学图景或许将聚焦于重建一个“健康的”肿瘤微环境,为患者带来更长久的生存与更高的生活质量。这一方向充满挑战,但也充满希望。
参考文献
Lyu, A., Fan, Z., Clark, M. et al. Evolution of myeloid-mediated immunotherapy resistance in prostate cancer. Nature (2024). https://doi.org/10.1038/s41586-024-08290-3
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#前列腺癌# #mCRPC#
17