Nature:从二维到三维:RNA分子动态结构的全新解析之路
14小时前 生物探索 生物探索 发表于陕西省
本文介绍 HORNET 方法,阐述其因应 RNA 结构研究难题而生,结合 AFM 与 DNN 优势实现溶液环境下单分子 RNA 多构象解析,展示应用实例及独特价值,探讨其在多领域的未来潜力。
引言
RNA分子作为生命活动的重要组成部分,其结构的多样性和动态性对功能的实现至关重要。然而,RNA分子的高异质性和柔性使得解析其三维结构成为一个长期未解决的挑战。传统方法如核磁共振(NMR)、X射线晶体学和冷冻电镜(cryo-EM)虽然在解析稳定RNA结构上卓有成效,但面对具有多种构象的动态RNA分子时,却往往力不从心。随着RNA研究的快速发展以及RNA在生物医学领域的广泛应用,例如RNA靶向药物开发和合成生物学设计,对能够全面解析RNA复杂结构的技术需求愈发迫切。
在此背景下,研究人员开发出一种名为HORNET的新方法(Holistic RNA Structure Determination),结合了原子力显微镜(AFM)和深度神经网络(DNN)的优势,首次实现了在溶液环境下对单分子RNA多构象的直接可视化和结构解析。通过利用AFM的高信噪比和DNN的学习能力,HORNET不仅能够识别RNA分子在不同构象下的全局拓扑信息,还能以原子分辨率预测其三维结构。与传统方法依赖信号平均不同,HORNET可以捕捉RNA分子的异质性,这一特点尤其适用于研究大分子RNA的动态变化。(12月18日 Nature “Determining structures of RNA conformers using AFM and deep neural networks”)
这一创新技术的问世,为RNA结构生物学提供了一种突破性的工具。例如,研究人员成功解析了RNase P RNA和HIV-1 Rev响应元件RNA(RRE RNA)等多种RNA分子的异质性结构,揭示了这些分子在生理条件下的动态构象及其对功能的贡献。这一研究不仅深化了我们对RNA分子结构与功能关系的理解,也为开发基于RNA的创新药物和生物技术应用铺平了道路。
HORNET方法的独特之处在于其整合了AFM的精确拓扑信息和机器学习的强大预测能力,为长期困扰科学界的RNA异质性结构研究提供了新的解决方案。

RNA的“动态舞者”:为什么RNA结构如此复杂?
RNA(核糖核酸)不仅是遗传信息的传递者,更是生命活动的“动态舞者”。作为分子中的多面手,RNA能够在细胞环境中以多种构象存在,而这一特性正是其功能实现的基础。然而,与蛋白质不同,RNA的动态性和异质性使其成为研究人员解读的难题。
RNA的结构复杂性源自其独特的化学和物理属性。研究表明,许多功能性RNA分子,如核酶(ribozymes)和核小体,能够在不同的环境下采取多种三维构象,这些构象并非随机变化,而是受控于序列中的特定结构域。例如,一个包含210个核苷酸(nt)的RNA分子即使保持良好的二级结构,也能在生理条件下表现出高度的构象异质性。这种现象已在研究中得到了实验验证,结果表明RNA的构象异质性不同于未折叠蛋白质的无序状态,而是功能性RNA的一种特性。
RNA的动态特性赋予了其多重功能。例如,RNase P RNA在催化前tRNA的成熟过程中需要多种构象,以适应不同底物和细胞环境。这种异质性还使RNA能够与不同的配体特异性结合,为其参与调控、催化和信息传递提供了分子基础。
RNA的动态性不仅让研究人员对其“舞蹈”的复杂节奏感到敬畏,也昭示着这一分子在生物学和医学领域的巨大潜力。
研究人员的困境:传统方法的局限性
研究人员在揭示RNA分子复杂结构的道路上面临着诸多技术挑战。尽管核磁共振(NMR)、X射线晶体学和冷冻电镜(cryo-EM)在解析蛋白质和稳定RNA分子的结构方面取得了巨大成功,但这些传统方法在应对RNA的动态特性和异质性时,常常显得捉襟见肘。
RNA分子的动态性和柔性是理解其功能的关键。研究表明,许多功能性RNA并非以单一稳定的三维结构存在,而是动态地游走于多个构象之间。然而,传统方法要求样品的高度均一性,这与RNA的多态性天然矛盾。例如,NMR虽然能够提供高分辨率的原子级信息,但仅适用于小分子RNA或稳定的二级结构,面对大分子RNA的动态性时,信号重叠和复杂性令解析工作变得异常艰难。
X射线晶体学以其清晰的三维分子图谱著称,但RNA分子的柔性和异质性使其在晶体环境中难以形成稳定的周期性排列。即使成功结晶,获得的静态快照也难以反映RNA在生理条件下的真实动态。
冷冻电镜(cryo-EM)作为一种突破性技术,可以捕捉到大分子复合物的形态,但其依赖信号平均的特性无法有效解析RNA分子的异质性。特别是当RNA以多种构象共存时,冷冻电镜的分辨能力往往被限制在分子轮廓级别,而非原子精度。
更重要的是,RNA结构的复杂性远远超越了这些传统技术的设计初衷。许多RNA序列的三维结构在目前的数据库中没有对应,因此像AlphaFold这样的基于蛋白质结构预测的工具对RNA无能为力。RNA结构研究领域因缺乏大规模的结构数据库和序列-结构关联,而长期被困于技术瓶颈中。
这些传统方法的局限性催生了研究人员对新方法的渴望,而HORNET的出现正是为破解这一困境带来了新的曙光。
解锁RNA奥秘的新钥匙:HORNET方法的诞生
为了破解RNA结构研究中的难题,研究人员开发了一种名为HORNET(Holistic RNA Structure Determination)的全新方法。该方法结合了原子力显微镜(AFM)的高分辨率成像技术与深度神经网络(DNN)的强大学习能力,首次实现了RNA分子在溶液环境下多种构象的直接解析。这项技术不仅填补了现有技术的空白,还为RNA结构生物学开辟了一个全新的研究方向。
HORNET的核心理念是通过AFM捕捉RNA分子的高精度表面拓扑图像,然后借助深度神经网络从中解析出三维结构。AFM以其高信噪比著称,能够在生理条件下直接观察单个RNA分子的构象变化。相比于传统依赖信号平均的方法,AFM的高灵敏度使其能够分辨RNA分子的异质性,并清晰呈现其主要的二级和三级结构特征。例如,研究人员利用AFM捕捉到长度超过200个核苷酸的RNA分子不同构象的细节,分辨率可达11至12埃(Å),足以显示双螺旋的沟槽结构。
然而,单纯的AFM图像并不能直接揭示RNA的原子级三维结构。为此,HORNET整合了深度神经网络,通过训练超过350万种RNA模型的数据库,使其能够从AFM的二维图像中提取峰值能量、拓扑特征以及构象间的动态关联。深度神经网络不仅能识别RNA分子的整体构象,还能准确预测其与真实结构的偏差,其均方根偏差(r.m.s.d.)可低至3.5 Å。
这种方法的突破性在于其全面性与精确性:AFM提供了实验数据的物理约束,而深度学习则确保了对RNA分子异质性的细致解析。研究人员利用HORNET成功解析了多种功能性RNA,包括RNase P RNA和HIV-1 Rev响应元件RNA(RRE RNA),展现了RNA在不同生理状态下的动态特性。
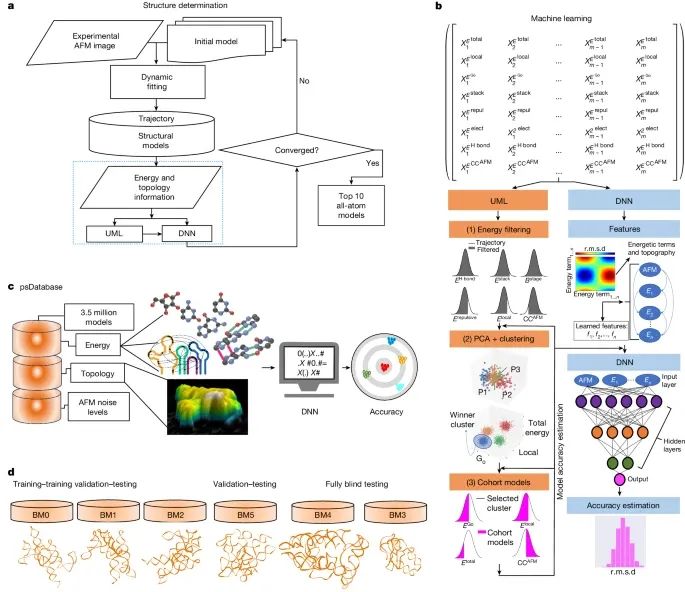
基于HORNET的整体RNA结构解析流程(Credit: Nature)
HORNET的总体工作流程(a)
HORNET方法从实验获取的AFM拓扑数据(包括x、y和z三维信息)和初始模型开始,通过AFM数据和基于结构的伪势能函数驱动动态拟合过程。在这一过程中,生成了粗粒度模型,这些模型包含了能量值的完整列表以及与AFM拓扑的整体拟合程度(CCAFM)。这些信息随后被传递到无监督机器学习(UML)和/或深度神经网络(DNN)中,用于模型的聚类和精度估算,主要以均方根偏差(r.m.s.d.)作为衡量指标。如果DNN收敛,即模型群体的r.m.s.d.分布中有显著部分低于7 Å,则将最优的前10个模型转化为全原子坐标模型。如果未收敛,则基于不同的初始模型或延长动态拟合时间重新进行计算。
UML和DNN的主要步骤(b)
图示详细展示了UML和DNN的关键分析步骤,包括主成分分析(PCA)和基于能量和拓扑特征的聚类。DNN通过利用RNA伪数据库(psDatabase)的结构训练,进一步提高了模型精度的估算能力。
RNA伪数据库(psDatabase)(c)
展示了一个包含350万个连续轨迹模型的数据库,这些模型来自RNase P RNA(RPR)的催化域,用于训练和优化机器学习算法。经过训练的DNN架构能够基于AFM拓扑数据,准确估算RNA结构模型的精度。
HORNET的基准测试(d)
HORNET方法使用了大约5600万个动态拟合生成的轨迹模型,这些模型分为以下几个组别:训练-训练验证-测试组(BM0、BM1和BM2),用于训练和初步验证DNN模型的能力。验证-测试组(BM5),用于进一步验证算法性能。完全盲测组(BM3和BM4),用于测试DNN对未见数据的泛化能力。
从二维影像到三维结构:HORNET如何运作?
HORNET方法的神奇之处在于它能够将原子力显微镜(AFM)生成的二维拓扑影像,转化为精确的RNA三维结构模型。这一过程既依赖AFM的高信噪比数据,也得益于深度神经网络(DNN)的学习和预测能力,为RNA结构解析提供了全新视角。
HORNET的工作流程分为三个主要阶段。首先,AFM通过其顶级的成像技术捕捉RNA分子的表面形态。在生理条件下,AFM能够以纳米级分辨率直接观察单个RNA分子的构象特征。这些高质量的二维图像不仅展示了RNA的整体轮廓,还包含了关键的局部信息,例如双螺旋沟槽和结构域的排列。相比于传统信号平均技术,AFM的单分子成像避免了异质性信息的丢失。
接下来,HORNET利用动态拟合技术,将这些二维影像与初始的粗粒度RNA模型相匹配。这个过程中,研究人员引入伪势能函数(pseudo-potentials)和经典吉布斯自由能(Gibbs free energy)约束,逐步优化模型的拟合精度。在数百万次模型拟合的基础上,HORNET能够筛选出与实验影像最匹配的构象模型。
最后,深度神经网络登场。研究团队构建了一个包含超过350万个RNA模型的训练数据库,通过机器学习算法让网络掌握从二维影像中提取三维信息的能力。训练后的网络不仅能够精准评估每个模型的结构精度,还能从大量候选模型中识别出最佳的十个原子坐标模型。在研究中,HORNET通过无监督学习和有监督学习相结合的方法,将解析精度控制在均方根偏差(r.m.s.d.)低于3.5 Å。
这一整合了实验与计算技术的工作流程,让HORNET能够实现传统方法难以企及的效果。例如,HORNET在解析HIV-1 Rev响应元件RNA的过程中,不仅展示了RNA的多构象特性,还揭示了其与配体结合的关键位点及结构变化。这种将二维影像“还原”为三维结构的能力,让RNA的动态世界得以前所未有的清晰呈现。
应用实例:揭开RNase P RNA和HIV-1 RRE RNA的动态秘密
HORNET方法的实际应用充分展现了其在RNA研究中的强大功能。通过解析功能性RNA分子的异质性构象,HORNET成功揭开了RNase P RNA和HIV-1 Rev响应元件RNA(RRE RNA)在动态状态下的结构奥秘,为RNA功能与结构之间的关系提供了新的见解。
RNase P RNA是一种具有催化功能的核酶,参与前体tRNA的剪切成熟。在研究中,HORNET通过AFM捕捉到RNase P RNA的多个构象,并利用深度神经网络解析了其三维结构特征。这些构象不仅展示了RNA分子在不同状态下的结构差异,还揭示了其构象变化与底物结合及催化活性之间的密切关联。例如,研究发现RNase P RNA在不同构象下表现出显著的灵活性,这种灵活性可能是其适应多种底物的关键。此外,通过比较不同构象的模型,研究人员进一步确认了多个关键结构域在RNA功能中的重要作用。
另一项突破性应用是对HIV-1 RRE RNA的研究。RRE RNA是HIV病毒生命周期中的关键分子,负责与Rev蛋白结合并促进病毒RNA的核输出。然而,由于其异质性和动态性,RRE RNA的三维结构长期未能明确。HORNET通过AFM捕捉到五种不同的RRE RNA构象,并通过动态拟合和深度学习解析了其三维模型。这些模型显示,RRE RNA在不同构象下的两个Rev结合位点始终保持面对面的排列,且其间的距离在45至70 Å之间变化。这一发现不仅验证了RRE RNA的构象灵活性,还揭示了这种动态性可能是其特异性识别Rev蛋白的基础。
这些证据充分说明了HORNET方法在RNA结构解析中的独特优势。它能够在单分子层面揭示RNA的动态特性,为研究RNA的功能机制和药物靶点提供了重要工具。无论是RNase P RNA的底物适应性,还是RRE RNA与Rev蛋白的特异性相互作用,HORNET都以其强大的解析能力为RNA研究注入了新的活力。
HORNET的独特价值:改变RNA结构研究的游戏规则
RNA的结构解析一直是生命科学领域的难题,尤其是那些具有高度异质性和动态性的RNA分子。传统技术虽然提供了RNA结构研究的重要基础,但在应对异质性RNA分子时,其局限性显而易见。而HORNET方法的诞生,不仅为RNA结构解析提供了新工具,还从根本上改变了这一领域的研究规则。
HORNET的独特价值在于其整合了实验数据与计算模型的能力,使得RNA分子的动态特性得以精准还原。通过AFM的高分辨率成像技术,HORNET能够在生理条件下捕捉单个RNA分子的构象信息,而无需依赖传统技术的信号平均。这意味着,HORNET可以直接观察到RNA的异质性,为揭示RNA分子在不同环境下的真实动态提供了可能。
另一方面,HORNET结合了深度神经网络的学习能力,从而克服了现有RNA数据库的局限性。RNA分子的三维结构在数据库中的覆盖率极低,而HORNET通过训练超过350万个模型的伪数据库,构建了能够预测未知RNA结构的高效算法。这种结合实验和计算的方式,不仅提高了结构预测的精度(均方根偏差低至3.5 Å),还为RNA研究提供了可扩展的分析框架。
此外,HORNET方法还展示了对大分子RNA和复杂构象的解析能力。传统方法往往受限于分子大小或结构复杂性,而HORNET通过动态拟合技术和全局拓扑约束,可以解析超过200核苷酸的RNA分子。这种能力使HORNET能够研究更多具有生物学功能的重要RNA分子,例如RNase P RNA和HIV-1 RRE RNA。
最重要的是,HORNET方法为RNA靶向药物开发提供了新途径。例如,在HIV-1 RRE RNA的研究中,HORNET揭示了关键结合位点的动态变化,为设计更高效的抗病毒分子奠定了基础。它的应用不仅扩展了我们对RNA生物学的理解,也为RNA在医学和生物技术中的广泛应用铺平了道路。
HORNET的未来潜力
首先,在RNA靶向药物开发中,HORNET技术的引入将改变传统的药物筛选模式。RNA作为药物靶点的吸引力日益增长,尤其是在治疗难以攻克的疾病(如癌症、病毒感染和神经退行性疾病)中。然而,RNA的异质性和动态性长期限制了靶点预测和药物设计的效率。HORNET通过捕捉RNA分子在生理条件下的真实构象,揭示了关键功能区域的动态变化。例如,研究人员利用HORNET解析HIV-1 RRE RNA的构象,确定了关键结合位点的相对位置和动态特性。这一发现为开发高效阻断HIV病毒复制的药物提供了直接指导。
其次,HORNET在合成生物学领域展现了巨大潜力。设计具有特定功能的RNA设备(如开关、传感器或催化剂)需要对RNA的结构与功能关系有深刻的理解。HORNET的动态结构解析能力,为合成RNA分子的优化提供了可靠支持,使得RNA设备的设计更加高效精准。例如,利用HORNET解析的RNA构象可以指导设计多功能核酸分子,以实现精准调控基因表达或靶向特定分子路径的能力。
此外,HORNET的应用还可延伸至新兴的RNA疗法,如mRNA疫苗和RNA干扰(RNAi)技术。通过深入了解RNA的动态特性,研究人员可以优化RNA药物的稳定性和特异性,从而提高疗效并减少副作用。在新冠病毒mRNA疫苗的快速开发背景下,HORNET技术有望为下一代RNA疫苗的设计提供革命性支持。
未来,随着HORNET技术的不断优化,其在其他领域的潜在应用也不容小觑,如RNA-蛋白相互作用的研究、RNA纳米技术的开发等。HORNET不仅是一种解析RNA分子的新工具,更是一座连接基础科学和实际应用的桥梁,为RNA研究和生物技术的创新开辟了广阔的前景。
参考文献
Degenhardt MFS, Degenhardt HF, Bhandari YR, Lee YT, Ding J, Yu P, Heinz WF, Stagno JR, Schwieters CD, Watts NR, Wingfield PT, Rein A, Zhang J, Wang YX. Determining structures of RNA conformers using AFM and deep neural networks. Nature. 2024 Dec 18. doi: 10.1038/s41586-024-07559-x. Epub ahead of print. PMID: 39695231.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










RNA分子作为生命活动的重要组成部分,其结构的多样性和动态性对功能的实现至关重要。然而,RNA分子的高异质性和柔性使得解析其三维结构成为一个长期未解决的挑战。
2
#深度神经网络# #原子力显微镜#
4