ERA-EDTA 2020:RNAi疗法公司Alnylam再发力!Lumasiran治疗1型原发性高草酸尿症III期临床成功
2020-06-08 MedSci原创 MedSci原创
Lumasiran达到ILLUMINATE-A的主要终点,相对于安慰剂而言,草酸尿的平均减少量为53.5%
在2020年第57届欧洲肾脏协会-欧洲透析和移植协会(ERA-EDTA)国际大会上,RNAi治疗公司Alnylam Pharmaceuticals宣布了其RNAi疗法lumasiran治疗1型原发性高草酸尿症(PH1)的III期临床研究ILLUMINATE-A的阳性数据。

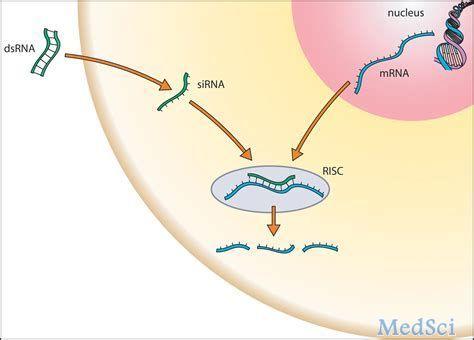
Lumasiran是皮下给药的靶向羟基酸氧化酶1(HAO1)的RNAi治疗药物,HAO1编码乙醇酸氧化酶(GO)。因此,通过沉默HAO1并耗尽GO酶后,Lumasiran可以抑制草酸盐的产生,草酸盐是直接影响PH1疾病进展的代谢产物。Lumasiran是利用Alnylam的增强稳定化学(ESC)-GalNAc-缀合物技术制备而成,可通过皮下给药提高药效和耐用性。
Lumasiran达到ILLUMINATE-A的主要终点,相对于安慰剂而言,草酸尿的平均减少量为53.5%(p = 1.7x10 -14);与基线相比,草酸尿平均减少65.4%。研究的所有次级终点均得到满足,包括尿草酸盐接近正常化(84%)或正常化(52%)的患者比例,而安慰剂组为零。
并且Lumasiran具有令人鼓舞的安全性和耐受性,没有严重的不良事件(AE),轻度的注射部位反应(ISR)是最常见的药物相关AE。
PH1是一种由草酸盐过量生产引起的罕见病,草酸尿水平升高与晚期肾脏疾病和其他全身性并发症的进展有关。
根据ILLUMINATE-A结果,Alnylam向美国食品和药物管理局(FDA)提交了新药申请(NDA)。FDA已批准NDA的优先审查。此外,lumasiran的营销授权申请(MAA)也已提交给欧洲药品管理局(EMA),并获得了加速评估的称号。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#ERA#
77
#Alnylam#
88
#LAM#
74
#I期临床#
77
#原发性#
74
#III#
62
#RNAi#
83
#II期临床#
101
#EDTA#
92
#III期#
62